Маркеры аутоиммунных заболеваний для рассеянного склероза

Рассеянный склероз (РС) – хроническое ремиттирующее демиелинизирующее заболевание центральной нервной системы с непредсказуемым, часто прогрессирующим течением. Встречается преимущественно у лиц молодого возраста (20-40 лет). Чаще это заболевание встречается в странах умеренного климата и северных регионах. Самый высокий показатель заболеваемости РС установлен в Северной Ирландии (130 случаев на 100 тыс. населения) и в США (80 случаев на 100 тыс. населения). В Украине этот показатель составляет 25 случаев на 100 тыс. населения. Практически неболеют РС в тропических странах – Китае, Японии и очень редко – в Африке и Индии.
Первый случай заболевания был описан в 1835 году французским врачом Ж.Крювелье. Два года спустя об этом заболевании в Великобритании сообщил Р.Карсвелл. К середине XIX века уже накопилось множество сведений об этом заболевании. В 1868 году французский невролог Ж.Шарко суммировал все патоморфологические признаки рассеянного склероза и разработал его диагностические критерии.
Этиология рассеянного склероза неизвестна. Сейчас признано, что РС является мультифакторным заболеванием, в возникновении которого ведущую роль играют вирусная инфекция (ретровирусы, вирус кори, краснухи, гриппа, паротита), генетическая предрасположенность и географический фактор. Участие инфекционного фактора в инициации РС подтверждается повышением титра противовирусных антител при этом заболевании. Также установлено, что в 15-20 % случаев заболевание носит семейный характер и в 20-50 раз чаще возникает у родственников больных РС, чем в общей популяции. Показано, что рассеянный склероз ассоциируется с наличием генов повышенного риска – HLA-A3, HLA-B7, HLA-DR2. Маркерами тяжелого течения заболевания являются HLA-А3 и HLA-А5, легкого – HLA-А1, А2 и HLA-А9. Гены HLA-А19, HLA-А28, HLA-В17 и HLA-В27 являются протективными для рассеянного склероза. Географический фактор связывают с особенностями климата, характером воды и почвы, содержанием в них микроэлементов (Zn, Co, Cu) и концентрацей в этих регионах лиц с определенным HLA-генотипом.
В основе рассеянного склероза лежит аутоиммунный процесс. Ведущую роль в демиелинизации нервной ткани играют аутореактивные сенсибилизированные Т-лимфоциты. У больных с активным процессом всегда выявляется инфильтрация нервной ткани лимфоцитами и высокие концентрации активированных Т-клеток в спиномозговой жидкости. В эксперименте показана возможность переноса аутоиммунного энцефалита (экспериментальной модели РС) интактным животным с помощью Т-лимфоцитов. В 90% случаев заболеваний РС выявляются антитела к белкам нервной ткани, прежде всего, к основному белку, липо- и гликопротеину миелина. Также у пациентов выявляется повышенное содержание в периферической крови иммунных комплексов. Аутоиммунные реакции приводят не только к разрушению миелина и формированию глиозных бляшек и рубцов, но и к развитию сосудисто-воспалительных и пролиферативных процессов в центральной нервной системе, нарушению проницаемости гемато-энцефалитического барьера. У больных с данной патологией в крови и спиномозговой жидкости всегда выявляется повышенное содержание таких провоспалительных цитокинов, как: ФНО?, ИНФ-гамма, ИЛ-1, ИЛ-2. При рассеянном склерозе, как правило, поражаются головной и спинной мозг, зрительные нервы, что приводит к нарушению соответствующих функций организма. В зависимости от превалирования локализации повреждений в ЦНС различают церебральную, спинальную и цереброспинальную формы РС. Последняя форма заболевания наблюдается у 2/3 больных.
Первыми симптомами заболевания являются преходящие моторные, сенсорные или зрительные нарушения. При развитии заболевания почти всегда имеется нижний спастический парапарез либо тетрапарез. Наряду с ними выражены мозжечковые расстройства: атаксия, дизартрия, нистагм. Обычно наблюдается грубый тремор конечностей, реже головы; дрожание выявляется при активных движениях, но может носить и статический характер. Широко известная триада Шарко (нистагм, интенционный тремор, скандированная речь) отмечается лишь у 10% больных. Поражение зрительных нервов проявляется снижением остроты зрения (стойкая слепота очень редка) и побледнением височных половин дисков зрительных нервов. Обычно нарушен процесс мочеиспускания. У многих больных имеет место своеобразная эйфория; в далеко зашедших стадиях болезни нередко наблюдается деменция. Для заболевания характерно ремиттирующее течение: обострения сменяются значительным улучшнием, а нередко и полным исчезновением всех или отдельных признаков болезни. Длительность ремиссий от нескольких дней до нескольких лет; особенно полноценны они в первые годы болезни. Через несколько лет, однако, большинство больных нуждается в постоянной помощи из-за параличей и атаксии.
Лечение больных РС включает применение патогенетических и симптоматических средств. Патогенетическая терапия направлена на подавление развития аутоиммунных реакций и предупреждение деструкции ткани мозга активированными лимфоцитами и их цитотоксинами. В период обострения заболевания назначают глюкокортикостероиды (метипред в пульс-дозах, короткий курс дексаметазона), иммунодепрессивные препараты (циклоспорин-А), при выраженном прогрессировании заболевания и резистентности к метипреду – препараты интерферонов (бетаферон и иммуноглобулины для в/в (актагам). Для неспецифической коррекции иммунных расстройств, элиминации из крови циркулирующих иммунных комплексов, аутоантител, нормализации работы Т-системы иммунитета проводят гемосорбцию и плазмаферез. В качестве специфического иммуномодулятора таким больным рекомендуется назначение кополимера-1 (копаксона). Копаксон представляет собой смесь синтетических полипептидов, состоящих из 4 аминокислот, представленных в разных пропорциях и случайной последовательности: L-глютаминовая кислота, L-аланин, L-тирозин, L-лизин. Этот синтетический пептид является аналогом естественного доминантного пептида основного белка миелина, который является основным сенсибилизирующим антигеном Т-лимфоцитов при РС. Копаксон, будучи введенным в организм, за счет доминантной конкуренции с естественным пептидом миелина во взаимодействии с Т-лимфоцитами, приводит к подавлению формирования аутореактивных клеток и продукции ими провоспалительных факторов. В итоге наступает прерывание аутоиммунного процесса и демиелинизация нервной ткани.
Симптоматическая терапия направлена на коррекцию двигательных нарушений, нейропсихических расстройств, нарушенных функций тазовых органов, расстройств чувствительности, коррекцию двигательных и чувствительных синдромов.
Целенаправленная нейроиммунная коррекция способна продлевать на очень длительный срок ремиссию заболевания с сохранением трудоспособности, при этом существенно снижая остроту данной социальной проблемы.
Иммунная система человека – это сложный механизм. Она состоит из клеток, защищающих его от проникновения патогенных микроорганизмов. Случается и так, что в работе защитной системы происходит сбой и она по ошибке начинает атаковать клетки собственного организма.
Аутоиммунные заболевания
За создание антител, блокирующих действие микробов, инфекций и прочих патогенов отвечают лимфоциты. Часть их является клетками-санитарами. Их задачей является уничтожение тканей собственного организма при их патологическом видоизменении. Под влиянием определённых факторов система может дать сбой. В этом случае лимфоциты начинают атаку здоровых клеток, запуская процесс саморазрушения организма.
Причины их агрессивного поведения могут быть внутренними и внешними. К первым относится наследственность. Генные мутации могут передаваться из поколения в поколение. Таким образом, если предки страдали от какого-либо аутоиммунного заболевания, вероятность его возникновения очень высока.
Внешними причинами являются:
- негативное воздействие окружающей среды;
- тяжёлый и затяжной характер течения инфекционных заболеваний.
Кроме того, в некоторых случаях лимфоциты не могут отличить собственные видоизменённые клетки от возбудителей и атакуют обоих.
Существует множество аутоиммунных заболеваний, симптоматика которых различна. Единственная их особенность – постепенное развитие на протяжении всей жизни человека.
Наиболее часто диагностируемыми аутоиммунными патологиями являются:
- ревматоидный артрит;
- рассеянный склероз;
- сахарный диабет 1-го типа;
- васкулит;
- красная волчанка;
- пузырчатка;
- тиреоидит Грейвса;
- миастения;
- склеродермия;
- антифосфолипидный синдром;
- болезнь Крона;
- гломеролунефрит;
- витилиго;
- псориаз;
- миокардит и пр.
Список аутоиммунных патологий очень длинный. Без лечения большая их часть представляет серьёзную опасность как для здоровья, так и для жизни пациента. Огромное значение имеет своевременная диагностика. Немаловажную роль играет и компетентность лечащего врача, который на протяжении многих лет может и не заподозрить наличие аутоиммунной патологии. Если он сомневается в диагнозе, а тревожные симптомы продолжают беспокоить, рекомендуется обратиться к другим специалистам и сдать кровь на анализ.
В лаборатории в процессе исследования изучают маркеры аутоиммунных заболеваний. Если выявлено повышение уровня какого-то из них или сразу нескольких, это свидетельствует о развитии патологии.
Существует великое множество маркеров аутоиммунных заболеваний. Ниже приведены те, концентрация которых не соответствует норме наиболее часто по сравнению с другими.
Повышен маркер к тиреоидной пероксидазе
Не всегда подобный результат анализа является признаком опасных заболеваний. Тиреопероксидаза – это фермент щитовидной железы. Незначительное увеличение его концентрации может являться следствием психоэмоционального напряжения, хирургических вмешательств и физиопроцедур в области шеи. Также его уровень повышается при патологиях щитовидной железы.
Если маркер аутоиммунного заболевания АТ ТПО повышен сильно и уже длительное время, это позволяет заподозрить наличие гипотиреоидизма. Данная патология характеризуется поражением щитовидной железы собственными иммунными клетками. В результате нарушается её работа, что может послужить причиной дисфункции многих органов и систем.
Повышенный уровень маркера аутоиммунного заболевания АТ ТПО также может свидетельствовать о:
- иных видах тиреоидита;
- хронической почечной недостаточности;
- сахарном диабете;
- ревматизме;
- травмировании органов эндокринной системы;
- базедовой болезни;
- послеродовых нарушениях в работе щитовидной железы.
Точная постановка диагноза зависит от концентрации антител в крови. Если выявлено заболевание аутоиммунного характера, его лечение будет заключаться в приёме гормональных препаратов.
Повышен маркер к глиадину
Увеличение концентрации иммуноглобулинов G и А может являться признаком патологий соединительной ткани, интерстициальных заболеваний лёгких, синдрома мальадсобции. Но в большинстве случаев повышенный маркер аутоиммунного заболевания свидетельствует о целиакии. При данной патологии поражается слизистая тонкого кишечника, что служит пусковым фактором спаечного процесса и различных дистрофических изменений. Для улучшения состояния необходимо строго соблюдать безглютеновую диету.
Повышен маркер к инсулину
Антитела (АТ) к данному гормону говорят о разрушении клеток поджелудочной железы. Повышение маркера аутоиммунного заболевания в этом случае свидетельствует о сахарном диабете 1-го типа. Результатом развития данной патологии становится недостаток инсулина.
Для точной постановки диагноза необходимо сдать кровь на анализ. Если уровень сахара в ней увеличен, то наличие болезни подтверждается. Как правило, диабетики 1-го типа страдают сразу от нескольких аутоиммунных патологий.
Повышен маркер к тиреоглобулину
В результате анализа также можно выявить онкологические заболевания. Тиреоглобулин – это белок-предшественник гормонов щитовидной железы. Контроль за его уровнем позволяет диагностировать различные заболевания органа на самой ранней стадии.
Если маркер аутоиммунного заболевания АТ ТГ повышен, это может свидетельствовать о:
- Болезни Грейвса;
- тиреоидите Хашимото;
- раке щитовидной железы;
- диффузном нетоксическом зобе.
Анализ не является информативным для оценки эффективности назначенного лечения.
Повышен маркер к двуспиральный ДНК
Подобный результат исследования может свидетельствовать о системной красной волчанке. Это распространённое аутоиммунное заболевание, течение которого сопровождается поражением сосудов и соединительной ткани.
Помимо повышенного уровня маркера к двуспиральной ДНК увеличиваются показатели антител к:
- волчаночному антикоагулянту;
- антинуклеарному фактору;
- кардиолипину (классов G и М);
- нуклеосомам.
Если данные маркеры аутоиммунных заболеваний повышены, это также может являться признаком:
- ревматизма;
- миелита;
- гемолитической анемии;
- острого лейкоза;
- тяжёлых патологий печени;
- аутоиммунного гепатита;
- плазмоцитомы;
- склеродермии и пр.
Повышен маркер к протромбину
Данное вещество служит фактором свёртывания крови. Антитела к нему вмешиваются в процесс, провоцируя возникновение тромбов.
Если данный маркер аутоиммунного заболевания повышен, это является признаком антифосфолипидного синдрома. Данный термин применяется к целой группе расстройств:
- системной склеродермии;
- красной волчанке;
- ревматоидному артриту;
- злокачественным заболеваниям.
Это объясняется тем, что вырабатываемые иммунной системой антитела атакуют и разрушают фосфолипиды, являющиеся частью клеточных мембран.
Также при повышении маркера к протромбину существенно увеличивается вероятность возникновения инфаркта миокарда.
В заключение
Главной задачей иммунной системы человеческого организма является его защита от действия патогенных микроорганизмов. За данный процесс отвечают лимфоциты. Под влиянием внешних факторов или за счёт генной мутации, передающейся из поколения в поколение, в работе системы может произойти серьёзный сбой. В результате защитные силы начинают атаковать собственные клетки. На сегодняшний день известно множество аутоиммунных заболеваний, которые без своевременного лечения могут привести к серьёзным осложнениям.
Данный вариант исследования, помимо оценки основных субпопуляций лимфоцитов, уровня циркулирующих иммунных комплексов и основных классов иммуноглобулинов, включает в себя более углубленный анализ малых популяций В-лимфоцитов. Это В-1 клетки (популяция, связанная с продукцией аутоантител), В-клетки памяти, а также Т-регуляторные клетки. Анализ этих клеток в совокупности с основными субпопуляциями лимфоцитов позволяет определить выраженность аутоиммунного компонента в течение заболевания, в динамике оценить эффективность проводимой иммуносупрессивной и противовоспалительной терапии.
* Результаты исследования выдаются с заключением врача – аллерголога-иммунолога, доктора медицинских наук.
Набор тестов:
Иммунограмма, иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии.
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens.
Проточная цитометрия, иммунотурбидиметрия, ИФА.
Какой биоматериал можно использовать для исследования?
Как подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования.
- Полностью исключить прием лекарственных препаратов в течение 24 часов перед исследованием (по согласованию с врачом).
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
В современном понимании иммунный статус человека – это совокупность лабораторных показателей, характеризующих количественную и функциональную активность клеток иммунной системы в данный момент времени. Оценка иммунного статуса проводится с помощью иммунологического лабораторного обследования – иммунограммы. Иммунограмма крови не отражает избирательно состояние патологически измененного органа или системы, но позволяет оценить иммунную систему в целом (суммарный эффект изменения активности иммунной системы в ответ на чужеродный антиген).
Определение клеточного состава (иммунофенотипирование) лимфоцитов крови – основной компонент в оценке иммунного статуса – выполняется методом проточной цитофлюориметрии.
Иммунофенотипирование – это характеристика клеток, полученная при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD-антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития.
CD-антигены (англ. cluster of differentiation antigens) – это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера. CD могут быть распознаны с помощью соответствующих моноклональных антител. Используя флюоресцентно меченные моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии рассчитать содержание лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
В основе проточной цитофлюориметрии лежит фотометрическое и флюоресцентное измерение отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
Метод позволяет не только определить количественное соотношение основных популяций лимфоцитов –
- Т-лимфоциты (CD3 +CD19 - ),
- Т-хелперы/индукторы (CD3 +CD4 + CD45 + ),
- Т-цитотоксические лимфоциты (Т-ЦТЛ) (CD3 +CD8 + CD45 + ),
- истинные натуральные "киллеры" (NK-клетки) (CD3 -CD56 +CD45 + ),
- В-лимфоциты (CD19 +CD3 - ), –
но и оценить малые клеточные популяции, а также изучить их функциональную активность:
- Т-лимфоциты, экспрессирующие маркеры NK-клеток (Т-NK-клетки) (CD3 +CD56 +CD45 + ),
- NK-клетки, экспрессирующие альфа-цепь антигена CD8 (CD3 - СD8 + CD45 + ),
- В-1-клетки (CD19 +CD5 +CD27 -CD45 + ), связанные с продукцией аутоантител,
- активированные В-лимфоциты (CD3 -CD25 + CD45 + ),
- В-2-клетки (CD19 +CD5 -CD27 -CD45 + ),
- В-клетки памяти (CD19 +CD5 -CD27 +CD45 + ),
- активированные Т-лимфоциты (CD3 +HLA-DR + CD45 + ) и активированные цитотоксические лимфоциты (CD8 +HLA-DR + CD45 + ),
- В-лимфоциты и активированные NK-клетки (CD3 -HLA-DR + CD45 + ),
- активированные Т-лимфоциты, экспрессирующие альфа-цепь рецептора ИЛ-2 (CD3 +CD25 + CD45 + ),
- регуляторные Т-хелперные клетки (CD4 +CD25brightCD127negCD45 + ), выполняющие иммуносупрессорную функцию.
Такое всестороннее изучение клеточного состава лимфоцитов в совокупности с результатами других тестов, входящих в состав исследования, позволяет установить более тонкие механизмы иммунологических нарушений, уточнить степень и глубину поражения иммунной системы и подобрать препарат для последующей адекватной иммунокорректирующей терапии, оценки эффективности проводимого лечения, определения прогноза заболевания.
Когда назначается исследование?
Исследование рекомендовано для комплексного обследования пациентов, входящих в группу риска по аутоиммунным и иммунопатологическим синдромам:
- ревматоидный артрит;
- рассеянный склероз;
- диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, дерматомиозит);
- аутоиммунный тиреоидит;
- неспецифический язвенный колит и т.д.
Что означают результаты?
Уровень различных клеточных популяций лимфоцитов может повышаться или понижаться при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
В Юсуповской больнице применяются все современные точные методы диагностики рассеянного склероза, включая иммунологические исследования крови.
Иммунологические показатели при рассеянном склерозе могут изменяться и отражать динамику заболевания. Их оценка помогает контролировать течение патологии, вовремя выявлять начинающиеся обострения и ремиссии.
Помимо иммунологического анализа крови, в Юсуповской больнице применяются такие эффективные методы диагностики при рассеянном склерозе, как иммуноферментный анализ, транскраниальная магнитная стимуляция, генотипирование полиморфных вариантов генов, исследование вызванных потенциалов.
У нас есть все возможности для того, чтобы вовремя установить правильный диагноз, контролировать состояние пациента в динамике, своевременно назначать эффективное лечение.
Наши специалисты









Цены на диагностические исследования при рассеянном склерозе
Иммунологические исследования
Рассеянный склероз является аутоиммунным заболеванием, поэтому для диагностики и скрининга важно следить за состоянием клеточного и гуморального иммунитета. Для это в Юсуповской больнице применяются иммунологические исследования. Материалом исследования является кровь.
Показатели крови при рассеянном склерозе
Наиболее информативными показателями при рассеянном склерозе являются следующие:
- уровень CD4+-T-лимфоцитов;
- уровень CD8+-Т-лимфоцитов;
- соотношение CD4+/CD8+ T-лимфоцитов;
- уровень интерферона-гамма.
Иммунологические исследования целесообразно применять для контроля за течением рассеянного склероза, так как показатели могут варьироваться и отображать динамику заболевания. Также важно иметь в виду, что изменение иммунологических показателей опережает развитие клинической картины.
Изменение показателей при обострении
С началом обострения в крови меняется соотношение клеток Т-помощников (CD4+-T-лимфоцитов) и Т-супрессоров (CD8+-Т-лимфоцитов). Исследование позволяет обнаружить неясное по происхождению обострение, определить, насколько активно долго длящееся обострение и целесообразно ли для уменьшения его проявления соответствующее лечение.
Не менее важным показателем является соотношение CD4+/CD8+ T-лимфоцитов. В норме оно составляет около 1,3, а у больных рассеянным склерозом - 1,7-1,8.
Изменения интерферонового статуса
Интерфероновый статус также претерпевает значительные изменения в различные периоды заболевания. Повышение уровня интерферона в сыворотке крови может свидетельствовать об острой стадии заболевания, а нормализация показателей обычно совпадает с процессами выздоровления. Также исследования свидетельствуют о прямой связи между показателями уровня интерферона-гамма и тяжестью заболевания и обратной связи с количеством интерферона-альфа.
Юсуповская больница обладает возможностями проведения всех необходимых диагностических мероприятий при рассеянном склерозе, включая иммунологические исследования. Высококвалифицированные специалисты помогут интерпретировать результаты исследований и составят индивидуальный план лечения.

Результаты магнитно-резонансной томографии здорового мозга (слева) и пациента с рассеянным склерозом (справа). Фото: Jessica Wilson/Science Photo Library
Канадские медики сообщили о результатах клинических испытаний радикального подхода к лечению рассеянного склероза стволовыми клетками, пишет New Scientist. Предлагаемый ими метод можно назвать экстремальным. Представьте, что лечение или полностью избавит вас от болезни, или убьёт.
При рассеянном склерозе собственная иммунная система человека атакует организм, нападая на защитную миелиновую оболочку нервных волокон в головном мозге, спинном мозге и зрительном нерве. Очаги болезни постепенно разрастаются. Миелин выполняет роль электрической изоляции для электропроводных нервных волокон. Повсеместное нарушение изоляции приводит к нарушениям в передаче тока по электрической цепи во всём организме. Нервная система постепенно начинает сбоить, человека поражает слепота или паралич, и в конце концов нервная система полностью выходит из строя, что означает смерть.
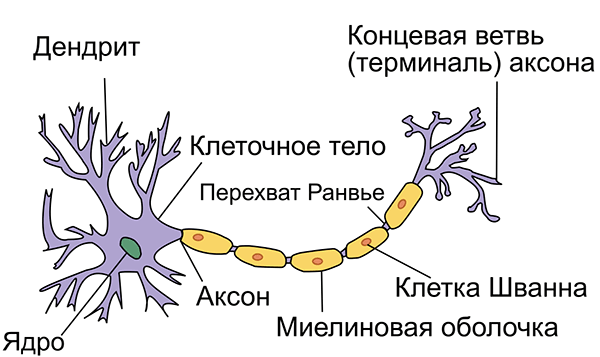
Структура нейрона. Оранжевым цветом показана миелиновая оболочка
Рассеянный склероз возникает в молодом и среднем возрасте (15-40 лет). Причины возникновения заболевания врачам до конца неизвестны, но к настоящему времени обнаружено несколько факторов, которые коррелируют с появлением рассеянного склероза.
- Расстояние от экватора (вероятно, связано со снижением выработки эндогенного и потребления экзогенного витамина D на территориях с меньшим количеством солнечного света), зона высокого риска — регионы севернее 30-й параллели на всех континентах.
- Стресс.
- Курение.
- Вакцинация против гепатита В (несмотря на результаты научного исследования, Всемирная организация здравоохранения опубликовала заявление, что анализ имеющихся сведений не подтверждает гипотезу о том, что вакцинация против гепатита B увеличивает риск развития заболевания).
- Низкий уровень мочевой кислоты.
Главной особенностью болезни является одновременное поражение нескольких различных отделов нервной системы, что приводит к появлению у больных разнообразных неврологических симптомов.
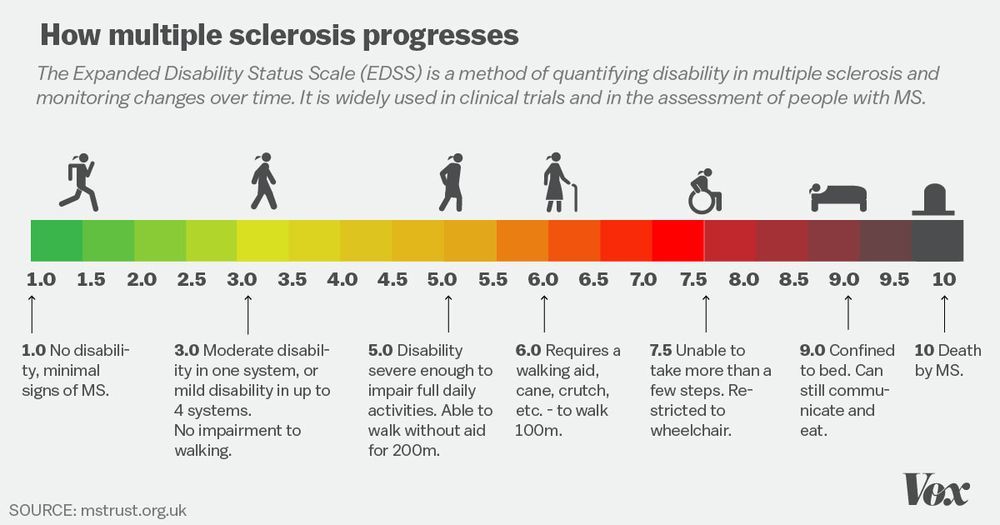
От рассеянного склероза страдает около 20 миллионов человек в мире, чаще женщины, проживающие в более северных странах, таких как Канада и Россия, северные районы США.
Существующие медикаменты могут ослабить частоту или силу атак иммунной системы на миелиновую оболочку нервных клеток, но не устраняют болезнь и не действуют на некоторых пациентов.
Радикальный подход канадских медиков предполагает лечение болезни путём полного уничтожения существующей иммунной системы и её переустановки с помощью стволовых клеток. Стволовые клетки — особый вид клеток в организме, которые способны специализироваться самостоятельно или давать потомство в виде специализированных типов клеток. В данном случае их используют для создания новой иммунной системы.
Такой метод лечения предполагает, что болезнь должна полностью исчезнуть. Иммунная система прекращает атаки на организм. Более того, как показали клинические тесты, с годами организм человека способен перестроиться и устранить повреждения, нанесённые болезнью в предыдущие годы. То есть нервная система самовосстанавливается, так что к пациенту постепенно возвращается утерянные функции.
Несмотря на рискованный подход, результаты клинических испытаний внушают оптимизм. Например, одна из принимавших участие в эксперименте пациенток Дженнифер Молсон (Jennifer Molson) из канадской провинции Онтарио решилась на экспериментальное радикальное лечение 14 лет назад, когда болезнь достигла такой стадии, что девушка находилась под круглосуточным наблюдением врачей в больнице Оттавы, передвигаясь только на ходунках, с тростью или в инвалидном кресле. Когда её отпускали на выходные, то за девушкой ухаживал её парень, и она полностью полагалась на его помощь: он резал ей еду и кормил, одевал её и купал в ванной. То есть Дженнифер уже не могла жить нормальной полноценной жизнью без посторонней помощи. К моменту максимального развития болезни девушка потеряла контроль над мочевым пузырём и кишечником.
Пациенты с настолько тяжёлой формой рассеянного склероза согласятся на любое экспериментальное решение, даже очень рискованное. Поэтому Дженнифер Молсон стала одной из первых, кто принял участие в клинических испытаниях по полной переустановке иммунной системы. В 2002 году врачи начали уничтожать её иммунную систему. Она стала одним из 24 пациентов, которых отобрали для первого клинического теста этого экспериментального метода.
Интересно, что данный метод лечения рассеянного склероза был обнаружен совершенно случайно при лечении больных лейкемией, которые одновременно страдали от рассеянного склероза. Лейкемия (лейкоз) — злокачественное заболевание кроветворной системы, один из методов лечение которой предполагает извлечение клеток костного мозга с дальнейшим уничтожением иммунной системы человека при помощи интенсивной химиотерапии. Образец клеток костного мозга очищают от раковых клеток и возвращают в организм для создания новой, чистой иммунной системы. К удивлению врачей, такой метод перезапуска иммунной системы у некоторых пациентов вылечил не только лейкемию, но и рассеянный склероз.
Сегодня несколько медицинских центров в мире предлагают такое радикальное экспериментальное лечение рассеянного склероза при условии, что пациент страдает от тяжёлой формы заболевания и обычные лекарства не действуют. В случае, если у пациента болезнь средней тяжести, то врачи предлагают более мягкую форму химиотерапии, что уменьшает вероятность излечения заболевания.
Из 24 пациентов, которые приняли участие в канадском клиническом тесте, у 17 человек развитие болезни удалось остановить. Правда, переустановка иммунной системы далась им непросто: химиотерапия сопровождается потерей волос, выпадением ногтей, тошнотой, диареей, она вызывает бесплодие и раннюю менопаузу у женщин. Но самое опасное — это риск инфекции, когда у человека иммунная система полностью отсутствует в первые недели, а потом очень слаба. Именно из-за инфекции одному из пациентов пришлось пересаживать печень, и он умер из-за осложнений трансплантации.
Спустя 18 месяцев после начала лечения Дженнифер Молсон заметила первые физические улучшения, а уже через три года смогла вернуться к работе. К настоящему времени её жизнь полностью вернулась в нормальное русло, болезнь исчезла бесследно, и Дженнифер ничем не отличается от всех остальных здоровых людей. По выходным она катается на лыжах и гребёт на каяке. В будние дни Дженнифер трудится научным сотрудником в той самой больнице Оттавы, где раньше находилась в качестве неизлечимо больного пациента.
Научная работа с результатами клинических тестов в Канаде опубликована 8 июня 2016 года в журнале The Lancet (doi: 10.1016/S0140-6736(16)30169-6, pdf). Это первая в мире научная работа, которая описывает успешное лечение рассеянного склероза с долговременным положительным эффектом без использования специальных медикаментов.
В первой таблице приведены данные о 24 пациентах, которые подверглись процедуре замены иммунной системы между октябрём 2001 года и декабрём 2009 года.
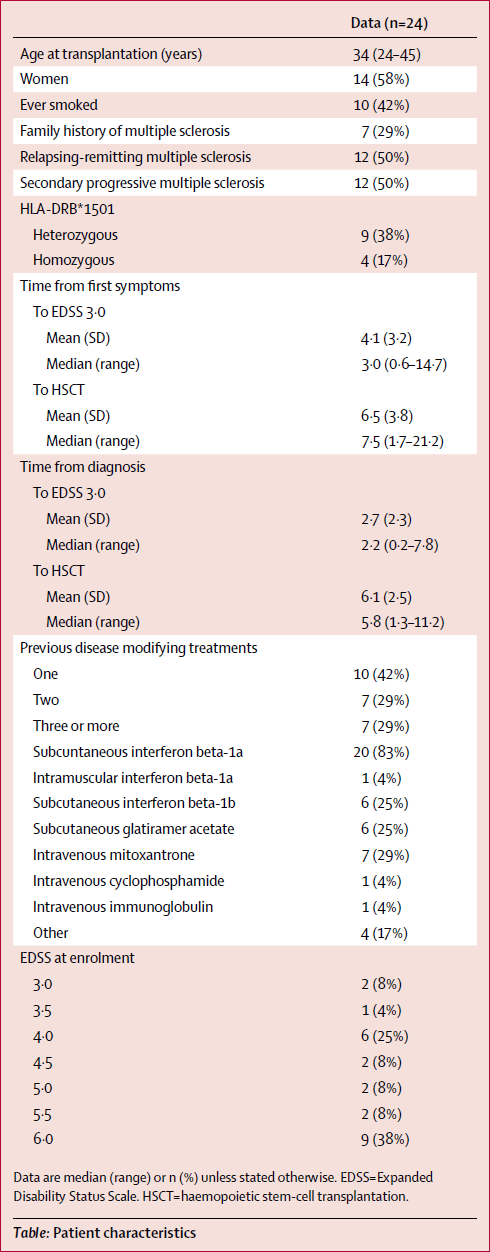
Ни у одного пациента не отмечено рецидивов болезни после лечения стволовыми клетками. Всего проведено 314 процедур МРТ (отмечены штрихами на правой диаграмме), среднее время слежения за пациентами после лечения составляет 6-7 лет. Крестик означает смерть пациента, звёздочка — цензура научного исследования, когда пациент впоследствии получил дополнительное альтернативное, экспериментальное или ненадёжное лечение, так что его исключили из выборки.


Дженнифер Молсон на разных этапах восстановления после лечения
На данный момент реальная смертность при лечении составляет 1% (не 4%, как в этом клиническом тесте на 24 пациентах). Сейчас врачи хотят опробовать другой вариант химиотерапии, который с меньшей вероятностью вызовет осложнения на печень. Возможно, смертность удастся снизить. Можно попробовать и менее радикальные варианты химиотерапии, чтобы найти баланс между эффективностью и токсичностью, говорят эксперты.
Читайте также:


