Санофи препараты для рассеянного склероза
Молодость — это неисчерпаемые возможности для активной жизни, создания семьи, построения карьеры. Именно в молодости чаще всего проявляется рассеянный склероз - заболевание, которому подвержены около 200 тысяч людей по всей России.
Мы в Санофи делаем всё, чтобы рассеянный склероз не становился препятствием для полноценной жизни, помогая повысить качество жизни пациентов.
Рассеянный склероз (РС) — это заболевание центральной нервной системы, при котором собственные иммунные клетки поражают оболочку нервов. Без необходимого лечения заболевание прогрессирует, и пациенту становится всё сложнее заниматься повседневными делами.

Причины возникновения рассеянного склероза до конца не выяснены. Известно, что на его развитие могут повлиять многие факторы:

Рецидивирующе-ремиттирующий рассеянный склероз (РРРС) — одна из форм заболевания, встречается у 85% пациентов, чаще у женщин 20–30 лет. Это наиболее мягкая форма РС, она протекает с чёткими обострениями, которые длятся в среднем 2 недели. Постепенно симптомы стихают или вовсе исчезают. Между рецидивами (периодами обострений) может пройти несколько недель, месяцев или даже лет. Обычно через 10–20 лет РРРС переходит на следующую стадию — вторично- прогрессирующий РС (ВПРС). С этого момента обострения происходят чаще, а периоды между ними протекают с постепенным ухудшением общего состояния здоровья.

При терапии рассеянного склероза важно снизить частоту обострений, правильное питание играет здесь не последнюю роль.
Диета не подразумевает отказа от самого любимого — лишь небольшую коррекцию ежедневного рациона. При этом важно сохранить все полезные вещества и снизить калорийность пищи.
Физическая активность также очень важна пациентам с РС. Она помогает жить активно и долго обходиться без посторонней помощи. Можно заниматься любым видом спорта, главное - следовать рекомендациям врача и не допускать переутомления, а также выделять достаточное количество времени на отдых и сон.
Поддержание здорового образа жизни может способствовать улучшению состояния, но только в комплексе со своевременной терапией.
Вот уже более 10 лет компания Санофи работает над лечением рассеянного склероза.
Мы придерживаемся индивидуального подхода к пациентам, поддерживаем обратную связь с исследователями, врачами и пациентами,
совместно разрабатываем программы поддержки пациентов. Благодаря совместной работе нам удалось достичь значительных успехов
в продлении полноценной активной жизни пациентов.
Вопросы о рассеянном склерозе
Aubagio™ эффективен при лечении рассеянного склероза
Рассеянный склероз относится к аутоиммунным заболеваниям и характеризуется поражением миелиновой оболочки нервных волокон головного и спинного мозга Т- и В-лимфоцитами, в результате чего нарушается процесс передачи нервных импульсов с дальнейшим развитием чувствительных и двигательных нарушений. Aubagio™ ингибирует митохондриальные ферменты в Т- и В-лимфоцитах, блокируя их пролиферацию и активность и таким образом предотвращая их повреждающее действие на мие линовую оболочку.
Клиническое исследование TEMSO длилось 2 года и включало 1088 пациентов с рецидивирующими формами рассеянного склероза из 21 страны. Применение Aubagio™ в пероральной форме на 31% снизило риск развития рецидивов рассеянного склероза по сравнению с плацебо. Время до появления первого рецидива также было существенно отсрочено. Так, у 53,7% пациентов, принимавших 7мг препарата, и 56,5% пациентов, принимавших 14 мг этого лекарственного средства, удалось избежать появления рецидива в течение всего срока исследования (2 года), в то время как в группе плацебо этот показатель составил 45,6%.
Сейчас еще продолжаются исследования эффективности терифлуномида при лечении пациентов с рассеянным склерозом: TOWER, TENERE, TERACLES (в качестве дополнительной терапии к назначению бета-интерферона) и TOPIC.
В августе текущего года компания подала заявку на получение одобрения в Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration) и планирует подать заявку в Европейское агентство по лекарственным средствам (European Medicines Agency) в I квартале 2012 г.
Санофи и ее подразделение Genzyme объявили о публикации результатов базового исследования III фазы экспериментального препарата терифлуномид для перорального применения один раз в сутки TEMSO в The New England Journal of Medicine (NEJM). Результаты показали, что терифлуномид в дозировке 14 мг значительно снижал ежегодную частоту рецидивов, снижал темпы прогрессирования нетрудоспособности и приводил к улучшению некоторых показателей активности заболевания по результатам магнитно-резонансной томографии (МРТ), включая появление новых и увеличение существующих поражений головного мозга. Терифлуномид обладает благоприятным профилем безопасности, нежелательные явления отмечались с одинаковой частотой у участников в группах активной терапии и плацебо.
В исследовании TEMSO (TEriflunomide Multiple Sclerosis Oral – Терифлуномид для перорального применения при рассеянном склерозе) принимали участие 1088 человек с рецидивирующими формами РС из 126 центров в 21 стране. TEMSO – первое исследование в рамках обширной программы клинических исследований, включающей более 4000 участников из 36 стран и являющейся одной из крупнейших программ клинических исследований разрабатываемых в настоящее время пероральных препаратов против РС, в рамках которой уже завершены или проводятся в настоящее время пять клинических исследований III фазы.
Регистрационное досье на терифлуномид было подано в Управление по контролю за продуктами питания и лекарственными средствами США (FDA) в августе 2011 г., а подача на регистрацию в Европейское агентство по лекарственным препаратам (ЕМА) ожидается в первом квартале 2012 года. Результаты исследования TEMSO будут включены во все заявки на регистрацию.
Результаты исследования TEMSO показали, что в отличие от плацебо, терифлуномид, применяемый один раз в сутки:
Пока препарат не зарегистрирован ни в одной стране мира. В клинических исследованиях Российские центры участвовали очень активно, так что опыт работы с препаратом у нас есть, а это очень важно для регистрации в России. Финголимод, например, был зарегистрирован сначала в России, а потом уже в США, а через почти год в Европе.
Другое дело, что в США и Европе зарегистрированный препарат люди могут получать бесплатно практически сразу, а у нас надо ждать, иногда долго.
Пока препарат не зарегистрирован ни в одной стране мира. В клинических исследованиях Российские центры участвовали очень активно, так что опыт работы с препаратом у нас есть, а это очень важно для регистрации в России. Финголимод, например, был зарегистрирован сначала в России, а потом уже в США, а через почти год в Европе.
Другое дело, что в США и Европе зарегистрированный препарат люди могут получать бесплатно практически сразу, а у нас надо ждать, иногда долго.
Санофи и Джензайм, компания группы Санофи объявили сегодня основные результаты исследования TENERE – сравнительного клинического исследования III фазы эффективности, безопасности и переносимости терифлуномида, применяемого внутрь один раз в сутки, и интерферона бета-1а (Rebif®) – одобренного препарата для парентерального введения у лиц с рецидивирующими формами рассеянного склероза (РРС). Исследование TENERE, в котором принимали участие 324 пациента стало вторым завершенным из пяти исследований эффективности терифлуномида при РС. Таким образом, программа клинической разработки терифлуномида является самой большой и обширной среди разрабатываемых препаратов против рассеянного склероза.
В группах получавших препарат Rebif® не обнаружено статистически значимого превосходства перед получавшими терифлуномид (7 мг и 14 мг) с точки зрения риска неэффективности терапии – основной конечной точки исследования. Риск неэффективности терапии определяли как подтвержденный рецидив или полное прекращение терапии по любой причине, в зависимости от того, что происходило в первую очередь. В данном исследовании 48,6 процентов получавших терифлуномид перорально в дозировке 7 мг (n=109) и 37,8 процентов пациентов, получавших терифлуномид в дозировке 14 мг перорально (n=111) достигли основной конечной точки, в то время как в группе получавших интерферон бета 1-а ее достигли 42,3 процента больных (n=104).
При оценке предполагаемого ежегодного числа рецидивов в группах, получавших лечение терифлуномидом в суточной дозе 14 мг (0,259) и Rebif® (0,216) различий не обнаружено. Данный показатель был выше в группе получавших терифлуномид в дозировке 7 мг (0,410). Процент пациентов, у которых отмечались нежелательные явления в процессе терапии, был сходным во всех группах исследования. Частота полного прекращения терапии в исследовании в связи с нежелательными явлениями, развившимися во время терапии, была выше в группе получавших Rebif® (21,8 процента против 8,2 процента в группе получавших терифлуномид в дозировке 7 мг и 10,9 процента в группе получавших терифлуномид в дозировке 14 мг).
Терифлуномид в обеих дозировках (7 мг и 14 мг) в целом хорошо переносился. Большинство нежелательных явлений, отмечавшихся в группе получавших терифлуномид, были легкой степени тяжести и включали назофарингит, диарею, истончение волос и боль в спине. Эти реакции развивались чаще, чем в группе получавших Rebif®. Самыми частыми нежелательными явлениями в группе получавших Rebif® были повышение уровня аланин-аминотрансферазы, головная боль и гриппоподобные симптомы. Они возникали чаще, чем в группах получавших терифлуномид. Во время исследования не произошло ни одного случая смерти.
Ожидается, что Джензайм представит подробные результаты исследования TENERE во время ближайшего медицинского конгресса. Компания включит результаты исследования в регистрационную заявку, подаваемую в ЕМА в Европейском Союзе, наряду с успешными результатами исследования III фазы TEMSO. Предположительно компания подаст заявку на государственную регистрацию в ЕМА в первом квартале 2012 г. Заявка на регистрацию терифлуномида была принята к рассмотрению Управлением по пищевым продуктам и лекарственным средствам США (FDA) в октябре 2011 г.

В конце октября в Париже состоялась ежегодная конференция по рассеянному склерозу ECTRIMS. Специалисты обсуждали целый ряд вопросов, касающихся аспектов этого заболевания: диагностики, терапии, препаратов, изменяющих течение РС (ПИТРС) и т.д.

Пугающая неизвестность
Рассеянный склероз возникает, как правило, в молодом и среднем возрасте (18-40 лет), и в разных странах им страдают 30-70 человек на 100 000 населения. Это аутоиммунное заболевание, поскольку его причина – бунт некоторых иммунных клеток против организма. В результате разрушается миелиновая оболочка нервных волокон головного и спинного мозга, что зачастую приводит к инвалидности.
Симптомы РС обычно проявляются в виде нарушения двигательных функций. Однако самих пациентов пугает даже не столько инвалидность, сколько невидимые окружающим последствия этого коварного хронического и прогрессирующего заболевания: нарушение когнитивных функций, проблемы с мочевым пузырем, утомляемость, депрессия. Об этом рассказала Шошана П. (Shoshana P.) из Брайтона (Англия), которой диагноз был поставлен в 28-летнем возрасте, и она живет с ним уже 10 лет.
Зри в корень
Профессор неврологии и медицинский директор Центра реабилитации и РС в г. Оверпелт (Бельгия) Барт Ван Виймеерш (Bart Van Wijmeersch) подтвердил, что инвалидизирующие факторы при РС распознать очень трудно. И помочь врачу не упустить их могут сами пациенты, которые должны серьезно относиться ко всем симптомам, постоянно следить за своей болезнью, контролировать ее.
Доктор и пациент – это одна команда, подчеркивают представители пациентских сообществ и медики, отмечая, что комплаенс при РС чрезвычайно важен. По словам Джорджа Пеппера, чтобы достичь максимального эффекта в лечении, пациент должен признать наличие у себя заболевания и откровенно говорить врачу о своих симптомах, чтобы помочь осуществить наиболее точный подбор ПИТРС.
Идеальный баланс
Действительно, работа невролога с больным РС не заканчивается однократным назначением препаратов. Врач должен постоянно наблюдать пациента, контролировать его симптомы и, при необходимости, корректировать лечение. Поскольку здесь неминуема дилемма: сильные ПИТРС могут вызвать нежелательные явления, а слабые – не достичь цели.
До сих пор неизвестно ни одного случая полного выздоровления от рассеянного склероза: изменения в нервной системе больного со временем нарастают, а вместе с ними и симптомы. Однако с помощью современных ПИТРС можно замедлить накопление повреждений в головном и спинном мозге, уменьшить частоту и тяжесть обострений, отсрочить наступление инвалидности, помочь человеку как можно дольше сохранить трудоспособность, способность к самообслуживанию. Для этого начинать лечение лучше на ранней стадии, пока болезнь еще не привела к сильным нарушениям. Но даже если человек болен достаточно давно, терапия может принести пользу.
Своя колея
Основной проблемой пациентов в России является позднее начало медикаментозной терапии. Задача невролога - распознать РС на ранней стадии и направить пациента в специализированный центр рассеянного склероза. Такие центры или, по крайней мере, кабинеты есть сегодня в каждом субъекте РФ. Однако количество и квалификация работающих в них специалистов сильно разнятся. Если, к примеру, в таком центре в Москве могут работать 5-10 специалистов, способных установить окончательный диагноз и назначить правильное лечение, то в других регионах это может быть один кабинет с одним врачом на огромную территорию. И даже если невролог в районной больнице заподозрит у пациента РС и направит его к специалисту, не факт, что больной попадет туда своевременно.
В российском регистре 82 700 пациентов с РС, то есть на 100 тыс. населения приходится 56 больных рассеянным склерозом. Хотя, по оценкам экспертов, таких пациентов должно быть порядка 100-150 тыс.
Существует проблема и с приверженностью к терапии. Для того, чтобы ПИТРС первой линии были эффективны, их необходимо применять регулярно, в соответствии с назначением лечащего врача. Нередко бывает, что пациенты самостоятельно прекращают терапию в случае, если они начинают испытывать дискомфорт при применении тех или иных методов лечения, что приводит к новым обострениям и ухудшению прогноза.
- Главная
- Новости МФРС
- Новые оральные препараты от РС
Больше никаких иголок? Новые оральные препараты от РС
В настоящее время есть шесть препаратов, используемых для замедления прогрессии РС (Авонекс, Бетаферон, Копаксон, Ребиф, Новантрон и Тайсебри). Но, если Вы получаете лекарство один раз в день или один раз в неделю подкожно или внутримышечно, Вы снова и снова имеете дело с иглой. Эффективные оральные препараты от РС в течение долгого времени были желанным решением. Теперь, многочисленные фармацевтические компании мчатся наперегонки друг с другом и со временем, чтобы получить одобрение Американской Администрации по санитарному надзору за качеством Пищевых продуктов и Медикаментов (FDA) для своих особенных предложений.
Большинство приведенных ниже препаратов в настоящее время находится на Фазе III испытаний (последняя фаза испытаний перед заявлением на одобрение FDA), которая обычно длятся 2-3 года. Также требуется время для того, чтобы сопоставить данные, обратиться к FDA за одобрением нового препарата, и получить это одобрение. Если он отвечает требованиям, то препарат может получить Приоритетное Рассмотрение, которое ускорит процесс рассмотрения FDA.
Теперь, большими вопросами являются: что это за препараты, как они работают, насколькоони эффективны, каковы их потенциальные побочные эффекты, и когда они получат одобрение FDA и попадут на рынок? Давайте посмотрим…
Финголимод (Fingolimod (FTY720)) – препарат, спонсируемый Novartis Pharma и Bayer, является применяемым орально, ежедневно модифицирующим лечением для рецидивирующе-ремитирующего РС. Финголимод держит T клетки иммунной системы в лимфатических узлах далеко от центральной нервной системы. Финголимод уменьшал коэффициент ежегодных рецидивов больше, чем на 50%, по сравнению с плацебо, и уменьшал видимое на МРТ воспаление, приблизительно у 80% пациентов без активных мозговых повреждений. Наиболее общими неблагоприятными событиями, о которых сообщалось, были: назофарингит, головная боль и грипп. Испытания Фазы III начались в июне 2006 и будут проходить в течение двух лет. Набор для участия в них все еще продолжается. Местные центры набора – Центр РС в Эвэргрине (425-899-5370), Сиэтлский Институт Неврологии в Шведском Медицинском Центре (206-215-3565) и Центр Рассеянного Склероза Вирджинии Мэйсон (206-625-7373 Дополнительный 61386). Для большей информации см.Clinical Trial Information.
Милинакс (Mylinax)(Оральный Кладрибин) – препарат, спонсируемый Merk SeronoI VAX. Милинакс – принимаемое орально, ежедневно, модифицирующее лечение для рецидивирующе-ремитирующего РС. Милинакс мешает поведению и быстрому увеличению (пролифирации) определенных белых клеток крови, особенно лимфоцитов, вовлеченных в патологический процесс РС. Предыдущие клинические испытания показали положительный эффект кладрибина, применяемого в виде инъекций у пациентов с РС. В этих испытаниях наблюдалось сокращение развития новых повреждений головного мозга, видимых на изображениях МРТ, и клиническая польза. В сентябре 2006 FDA назвала оральный кладрибин продуктом Быстрого Пути. Под таким названием оральный кладрибин имеет право на Приоритетный Обзор, и FDA может рассмотреть части маркетингового заявления для обзора прежде, чем новое заявление препарата будет закончено. Испытания Фазы III закончили регистрацию в январе 2007 и будут длиться 2 года.
Терифлюномид(Teriflunomide) – препарат, спонсируемый Sanofi-Aventis. Терифлюномид – принимаемое орально, ежедневно, модифицирующее лечение для рецидивирующе-ремитирующего и вторично-прогрессирующего РС. Он, как считается, предотвращает взаимодействие T клеток в иммунной системе, вовлеченных в повреждение миелиновой оболочки. Во время оригинального испытания находящиеся на плацебо пациенты, которые переключились на терифлюномид, испытали до 85% уменьшения в новых активных областях активности болезни, увиденное на МРТ, и более низкий коэффициент рецидивов; в то время как в группе высокой дозы было меньше пациентов, испытывавших увеличение инвалидизации. Лечение хорошо переносилось, хотя были жалобы на головные боли и тошноту. В настоящее время проходит набор для участия в Фазе III испытаний этого препарата (см.Clinical Trial Information), которая будет длиться два года.
BG-12 – спонсируемый Biogen Idec.BG-12 – оральный фумарат для рецидивирующе-ремитирующего РС, Он является иммуномодулятором с комбинацией цитопротективных и противовоспалительных свойств. Фаза II контролируемых клинических испытаний орального BG-12 привела к 69% сокращению активного воспаления на снимках МРТ у 257 человек с рецидивирующе-ремитирующим РС. В 24-недельном испытании оральный препарат проявил существенное воздействие на улучшение, T2 и T1 повреждения, увиденные на МРТ, и имел следствием 32% сокращение рецидивов, но последний эффект не был статистически существенен. Препарат хорошо переносился. Наиболее обычные неблагоприятные события были: покраснение, желудочно-кишечные нарушения, головная боль и назофарингит. Фаза III клинических испытаний началась в январе 2007, но набор все еще продолжается (см.Clinical Trial Information).Испытания продолжатся два года.
CDP323 – спонсируемый UBC и Biogen Idec.CDP323 – оральный антагонист VLA-4 (как Тайсебри). Безопасность и переносимость CDP323 были оценены на здоровых добровольцах в трех отдельных изучениях Фазы I. CDP323 хорошо переносился с профилем неблагоприятных событий, сопоставимым с плацебо. Фаза II исследований началась в июне 2007, и результаты ожидаются к концу 2008.
Так, когда же эти препараты будут одобрены? Если с испытаниями все пройдет хорошо, Novartis надеется представить FTY720 (Финголимод) для одобрения FDA в 2009, хотя с Милинаксом (оральный Кладрибин), в течение быстрого пути FDA, на заключительном этапе, они могут идти нога в ногу, не далеко оставив позади своих конкурентов.
Безусловно, самые дорогие препараты — те, которые создаются для людей с неизлечимыми или смертельными заболеваниями со сложной морфологией. Например, компания Novartis при описании стоимости своих препаратов делает акцент на их клиническом значении, влиянии на пациентов и систему здравоохранения в целом, а также на существенном улучшении качества жизни.
Симптомы рассеянного склероза существенно варьируются. Некоторые люди с тяжелым течением заболевания могут потерять способность ходить и есть, в то время как другие могут испытывать длительные периоды ремиссии без каких-либо новых симптомов.
Ремиттирующий рассеянный склероз — наиболее распространенное течение заболевания. Он характеризуется четко выраженными приступами новых или нарастающих неврологических симптомов. Эти приступы, также называемые рецидивами или обострениями, сопровождаются периодами частичного или полного выздоровления (ремиссиями). Во время ремиссий, все симптомы могут исчезнуть, или некоторые симптомы могут становиться постоянными. Однако явного прогрессирования заболевания в периоды ремиссии не наблюдается. Приблизительно у 85% людей с РС первоначально диагностируется именно РРС.
Большинство людей с диагнозом РРС в срок от 3–5 лет с появления первых симптомов приходят к вторичному прогрессирующему течению болезни, при котором со временем происходит ухудшение неврологических функций и инвалидизация пациента.
В 2010 году FDA одобрило препарат Gilenya, ставший широко применяемым для лечения РС. Месячный курс данного препарата стоит $2500.
Novartis даже подала иск в прошлом году, пытаясь заблокировать продажи непатентованных версий Gilenya после истечения срока действия основного патента на препарат в августе. Однако пока судебная тяжба ни к чему не привела.
В США около миллиона человек живут с РС, в России — порядка 150 тыс. человек с подтвержденным диагнозом РС, а во всем мире этим недугом страдают 2,3 млн человек. Последним методом лечения РС, одобренным FDA, был окрелизумаб в 2017 году. Это анти-CD20 моноклональное антитело, поражающее зрелые B-лимфоциты, являясь иммуносупрессором. Он вышел на рынок с заявленной стоимостью $65 000 за год лечения.
По сравнению с естественным течением болезни, пациенты, которых лечили препаратом, демонстрировали значительные улучшения моторного развития — дети смогли держать головку и самостоятельно сидеть.
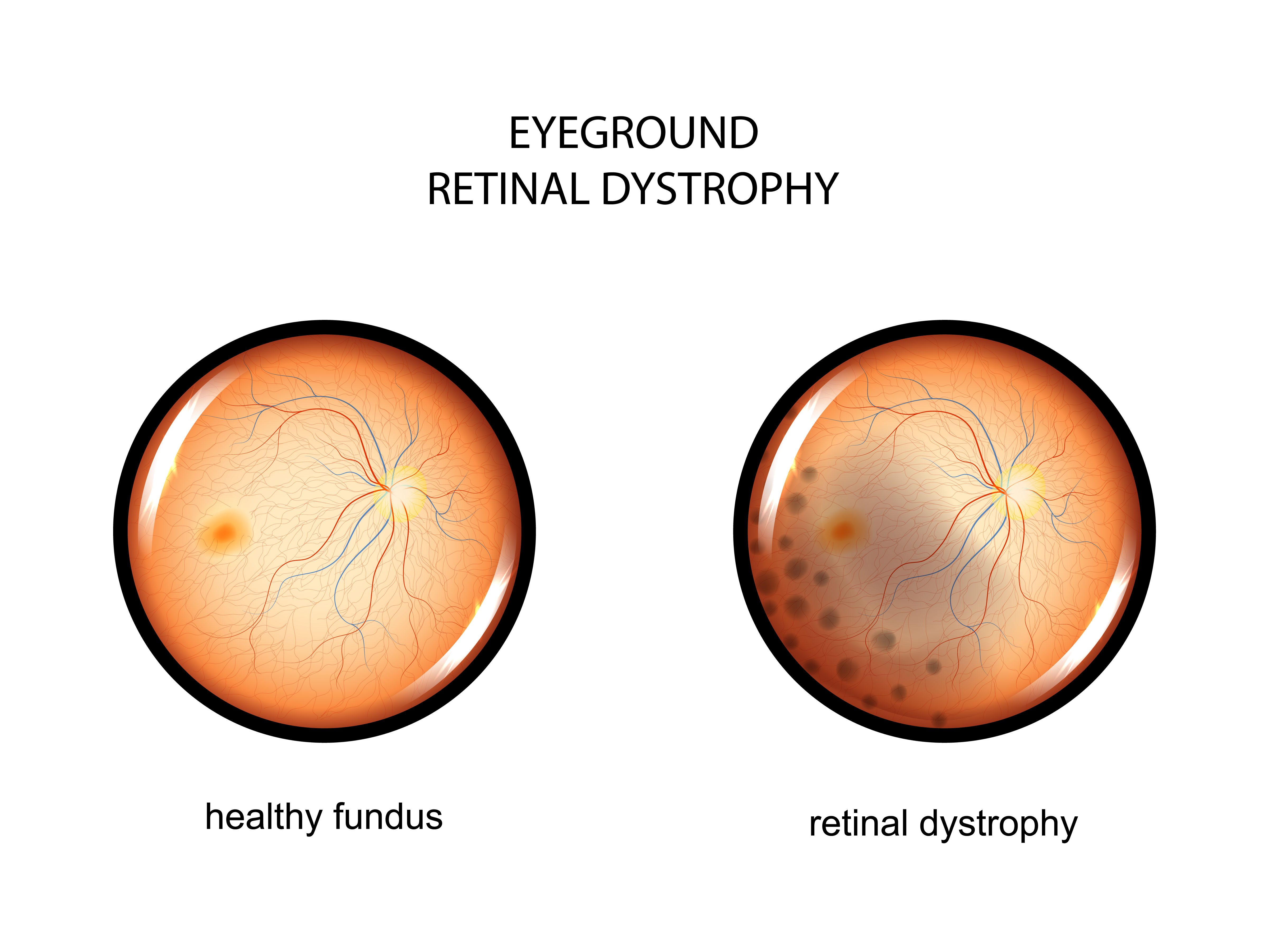
Ген RPE65 кодирует специфичный фермент клеток сетчатки глаза, участвующий в регенерации светочувствительного пигмента, который необходим для палочек и колбочек, чтобы обеспечить человеку нормальное зрение. Мутации в этом гене приводят к снижению или отсутствию уровней активности фермента, блокируя зрительный цикл и приводя к ухудшению зрения. Существует несколько типов наследственных заболеваний сетчатки, связанных с вышеназванным геном. Наиболее распространенными считают врожденный амавроз Лебера и пигментный ретинит. Из-за биаллельных мутаций гена RPE65 (генных мутаций обоих родителей) страдающие этими заболеваниями часто сталкиваются с никталопией (ночной слепотой) из-за снижения светочувствительности в детском или раннем взрослом возрасте и нистагмом (непроизвольными движениями зрачков). По мере прогрессирования заболевания происходят потеря периферического зрения, развитие туннельного зрения и, в конечном итоге, потеря центрального зрения, что означает полную слепоту.
Ретинальная дистрофия или наследственные дегенеративные заболевания сетчатки — это целый ряд болезней, которые отличаются по своей патологии, симптомам, а также последствиями. Очень трудно предсказать, насколько сильно ухудшится зрение, и как быстро будет прогрессировать заболевание, но во многих случаях люди с наследственной дистрофией сетчатки могут полностью потерять свое зрение.
Врожденный амавроз Лебера (ВАЛ) — редкое наследственное заболевание, которое приводит к нарушению деятельности сетчатки глаза и ухудшению зрения в раннем детстве, часто прямо с рождения. Из всех заболеваний, связанных с дегенерацией сетчатки, ВАЛ начинается раньше всего и может иметь наиболее тяжкие последствия. Уровень потери зрения при ВАЛ различается от случая к случаю, но остается стабильным в 75% случаев. У примерно 15% детей отмечается прогрессирующая потеря зрения, а у 10% может отмечаться некоторое незначительное, часто временное, улучшение.
Но FDA уже одобрило его для лечения двух редких заболеваний — хронического гранулематозного заболевания и тяжелого злокачественного остеопороза.
Хроническое гранулематозное заболевание — наследственное заболевание, при котором иммунная система отсутствует или не функционирует должным образом.
Синдром Хантера представляет собой рецессивное наследственное заболевание, вызванное недостаточным уровнем в организме лизосомального фермента. Проще говоря, необходимый для правильного углеводного обмена фермент не вырабатывается в нужных количествах и полисахариды (естественные сахара) неправильно усваиваются. В связи с отсутствием или наличием дефектного фермента у пациентов с синдромом Хантера полисахариды накапливаются в лизосомах клеток, приводя к клеточному перенасыщению, органомегалии, разрушению тканей и нарушению функций внутренних органов. Частота заболевания в мире составляет один человек на 100 тысяч. В России зарегистрировано около 150 пациентов.
Наследственный ангионевротический отек (HAE) — очень редкое и потенциально смертельное заболевание, которое встречается примерно у одного из 10 тыс. человек в мире. Главный симптом HAE — отеки в различных частях тела. У пациентов часто бывают приступы мучительной боли в животе, тошнота и рвота, вызванные отеком кишечной стенки. Отек дыхательных путей особенно опасен и может привести к смерти от удушья.
У пациентов с НАЭ имеется дефект в гене, который контролирует белок крови, называемый ингибитором С1. Генетический дефект приводит к выработке либо неадекватного, либо нефункционального белка C1-Inhibitor. Нормальный C1-Inhibitor помогает регулировать сложные биохимические взаимодействия систем на основе крови, участвующих в борьбе с болезнями, воспалительной реакцией и коагуляцией. Поскольку дефектный C1-Inhibitor не выполняет надлежащим образом свою регуляторную функцию, может возникнуть биохимический дисбаланс и продуцировать нежелательные пептиды. Они побуждают капилляры высвобождать жидкость в окружающую ткань, вызывая тем самым отек.
Стоимость жизненно важных препаратов зависит от множества исходных данных, но и их польза неоспорима. Обеспечить идентичную замену дефектным клеткам или способствовать выработке нужных для больного ферментов, зачастую могут только сложные разработки, в которых задействованы большое количество специалистов. В России, к большому сожалению, еще не все эти лекарства одобрены или выдаются по квоте всем нуждающимся. Но однажды мы к этому придем.


Препарат для лечения рассеянного склероза разработан международной инновационной компанией (Швейцария), он не имеет аналогов на мировом и российском рынке. Как сообщил глава московского подразделения компании Ларс Нильсен, уже подана заявка на включение препарата в перечень для лечения орфанных заболеваний. Препарат востребован в нашей стране. Общее число больных рассеянным склерозом сейчас составляет примерно 150 тысяч человек, а тяжелой первично прогрессирующей формой, для лечения которой до сих пор не было эффективных средств, 4, 5 тысячи.


Глава российской компании, где будет локализовано производство, Василий Игнатьев, подчеркнул, что производственные, технологические возможности российского участника проекта позволяют обеспечить локализацию с соблюдением всех требований Правил надлежащей производственной практики(GMP), а также хранение и дистрибьюцию препарата на всей территории России. Он подчеркнул, что это не первый совместный проект - швейцарская компания локализовала в нашей стране производство уже 17 высокотехнологичных лекарств. Первая партия лекарства поступит на российский рынок в сентябре 2020 года.
Кроме того, международная фармкомпания также локализует в нашей стране еще один препарат, предназначенный для лечения тяжелой формы гемофилии. В основном он будет востребован для лечения детей и его применение поможет кардинально улучшить качество жизни маленьких пациентов, отметил руководитель российской компании-партнера по проекту локализации Владимир Бабий.


Как заявил на конференции первый заместитель министра промышленности и торговли Сергей Цыб, благодаря грамотному правовому регулированию фармотрасли, этот сегмент экономики остается одним из самых привлекательных для инвестиций международных фармгигантов. В то же время, отметил Цыб, при сохранении благоприятных условий для локализации фармпроизводств в России, огромное внимание уделяется поддержке собственных инновационных лекарственных разработок, в том числе, нацеленных и на экспорт.
На конференции в Светлогорске присутствовали представители регуляторных органов из разных стран Европы (Венгрия, Хорватия и др.) , Африки (Египет), Латинской Америки, Азии. Сотрудничество в области синхронизации правил и требований, принятых в разных странах, - одно из необходимых условий как переноса к нам иностранных передовых технологий, так и экспорта российских новых вакцин и лекарственных препаратов.
Читайте также:


