Блокаторы натриевых каналов при эпилепсии
Нейрональный потенциал-зависимый натриевый канал представляет собой белковый комплекс, состоящий из большой трансмембранной а-субъединицы (структурно-функциональной основы канала) и двух малых b-субъединиц (модулирующих инактивацию Na-канала и уровень экспрессии а-субъединицы) [Wallace R. et al.].
Данное заболевание наследуется по аутосомно-доминантному типу с неполной пенетрантностью и характеризуется фебрильными судорогами (наблюдаемыми не только в типичном возрасте 5 лет, но и позднее), а также различными видами афебрильных генерализованных припадков (тонико-клонических, миоклонических, атонических, абсансов) или их сочетанием, что может сопровождаться развитием фенотипа миоклонически-астатической эпилепсии.
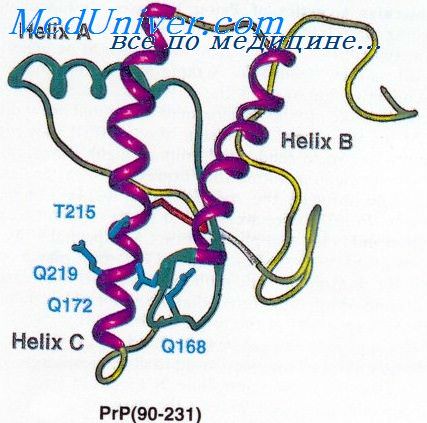
Интересно отметить, что, помимо мутаций в генах натриевых каналов, фенотип данной формы эпилепсии может быть связан также с повреждением гена у2-субъединицы рецептора ГАМК [Baulac S. et al.].
Заболевания, обусловленные повреждением кальциевых каналов. Потенциал-зависимые кальциевые каналы играют ключевую роль в высвобождении нейротрансмиттеров. Нейрональный кальциевый канал является мультимерным белковым комплексом, в состав которого входит a1-субъединица, формирующая остов канала, и вспомогательные субъединицы Р, у и a2 [Escayg A. et al.]. Известно, как минимум, семь различных генов, кодирующих субъединицу а,, и 4 го мологичных гена, кодирующих субъединицы кальциевого канала.
Взаимодействие между а,- и бета-субъединицами регулирует амплитуду кальциевого тока, его потенциал-зависимость и кинетику активации и инактивации [De Waard M., Campbell К.].
В 2000 году A. Escayg с соавторами, проводя скрининг гена Р4-субъединицы кальциевого канала (CACNB4, хромосома 2q22-23) в большой выборке семейных случаев эпилепсии, обнаружили мутации в данном гене в 2 семьях с аутосомно-доминантной идиопатической генерализованной эпилепсией [Escayg A. et al.]. Интересно, что одна из выявленных мутаций была также обнаружена у больного с семейной энизодической атаксией, близкой по клиническим характеристикам к эпизодической атаксии 2-го типа (ацетазол-чувствительной).
Основной же вариант эпизодической атаксии-2 обусловлен нонсенс-мутациями гена другой субъединицы кальциевого канала - а1А(ген CACNL1А4). Таким образом, синдромы кальциевых каналов, аналогично описанным выше KCNA1-ассоциированным синдромам калиевых каналов, свидетельствуют о патогенетической взаимосвязи между эпилептическими припадками и острыми пароксизмами атаксии при каналопатиях.
Конкретный механизм патогенетического эффекта мутаций в гене CACNB4 заключается в нарушении взаимодействия мутантной бета-субъединицы с аА-субъединицей кальциевого канала, что приводит к сокращению быстрого компонента инактивации канала и снижению потока ионов кальция в активизированные нейроны в процессе генерации потепциалов действия [Escayg A. et al.].
Карбамазепин (Тегретол, Финлепсин) является производным иминос-тильбена, наряду с выраженным противоэпилептическим эффектом оказывает нормотимическое (улучшение настроения) и антидепрессивное действие. Кроме того, карбамазепин обладает выраженной анальгетической активностью.
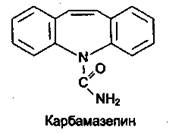
Противосудорожное действие препарата связано с блокадой натриевых каналов мембран нервных клеток. Уменьшает способность нейронов поддерживать высокочастотную импульсацию, типичную для эпилептогенной активности.
В дополнение к этому препарат может действовать пресинаптически, нарушая высвобождение медиатора за счет блокады пресинаптических натриевых каналов.
Является препаратом выбора для предупреждения парциальных судорог и больших судорожных припадков. Используется для ослабления нейропатической боли, в частности, при невралгии тройничного нерва (является препаратом выбора). Применяют также для профилактики маниакально-депрессивных состояний.
Карбамазепин при приеме внутрь почти полностью всасывается из ЖКТ в кровь, скорость всасывания индивидуальна и подвержена колебаниям. Максимальная концентрация в плазме после приема внутрь достигается в течение 4-5 ч. В грудном молоке концентрация вещества достигает 60% от концентрации в плазме крови матери. Метаболизируется в печени, повышает скорость собственного метаболизма за счет индукции микросомальных ферментов печени. Один из метаболитов — карбамазепин-10,11-эпоксид — обладает противосудорожной, антидепрессивной и антиневралгической активностью. Выводится в основном почками (более 70%).
Карбамазепин вызывает многочисленные побочные эффекты, среди которых потеря аппетита, тошнота, головная боль, сонливость, атаксия; нарушение аккомодации; диплопия (двоение в глазах), нарушения сердечного ритма, гипонатри-емия, гипокальциемия, гепатит, аллергические реакции, лейкопения, тромбоци-топения, агранулоцитоз (требуется контроль картины крови). Существует риск развития тератогенного действия. Применение препарата при беременности возможно только по жизненным показаниям. Так как карбамазепин угнетает психомоторные реакции, его не следует назначать лицам, деятельность которых требует повышенного внимания (например, водителям автотранспорта). Карбамазепин повышает скорость метаболизма, вследствие чего снижает в крови концентрацию некоторых лекарственных веществ, в том числе противоэпилептических препаратов (клоназепама, ламотриджина, натрия вальпроата, этосуксимида и др.).
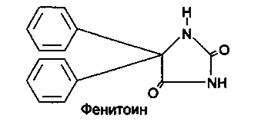
Механизм противосудорожного действия фенитоина связывают с блокадой натриевых каналов, уменьшением вхождения в нейроны ионов натрия, что препятствует генерации и распространению высокочастотных разрядов, снижает возбудимость нейронов и препятствует их активации при поступлении к ним импульсов из эпилептогенного очага.
Используется для лечения различных форм эпилепсии, за исключением малых судорожных припадков, в частности для предупреждения парциальных судорог и больших судорожных припадков. Для предупреждения судорожных припадков фенитоин назначают внутрь в виде таблеток. Фенитоин-натрий применяют для купирования эпилептического статуса, вводят внутривенно. При приеме внутрь скорость всасывания препарата из ЖКТ в значительной степени зависит от лекарственной формы, состава таблеток (размера частиц, вспомогательных веществ), при этом время достижения максимальной концентрации вещества в крови может варьировать в пределах от 3 до 12 ч. Фенитоин интенсивно связывается с белками плазмы крови (на 90%). Метаболизируется в печени, основной неактивный метаболит - 5-(п-гидроксифенил)-5-фенилгидантоин — подвергается конъюгации с глюкуроновой кислотой. В основном выводится из организма почками в виде метаболитов. Период полуэлиминации варьирует от 12 до 36 ч в зависимости от концентрации фенитоина в плазме крови (большие значения tVj наблюдаются при высоких концентрациях вещества в крови, что связано с насыщением ферментов печени, метаболизирующих фенитоин).
Фенитоин вызывает многочисленные побочные эффекты: головокружение, возбуждение, тошноту, рвоту, тремор, нистагм, атаксию, диплопию, гирсутизм; гиперплазию десен (особенно у молодых людей), снижение уровня фолатов и мегалобластную анемию, остеомаляцию (связано с нарушением метаболизма витамина D), аллергические реакции и др. Отмечено тератогенное действие. Вызывает индукцию микросомальных ферментов в печени и таким образом ускоряет метаболизм ряда лекарственных веществ (кортикостероиды, эстрогены, теофил-лин), повышает их концентрацию в крови.
Ламотриджин (Ламиктал) блокирует натриевые каналы мембран нейронов, а также уменьшает выделение глутамата из пресинаптических окончаний (что связывают с блокадой натриевых каналов пресинаптических мембран). Ламотриджин применяют практически при всех формах эпилепсии: для предупреждения парциальных судорог, больших судорожных припадков, малых приступов эпилепсии. Назначают для лечения эпилепсии, устойчивой к другим противо-эпилептическим средствам, или как дополнение к терапии другими препаратами. Побочные эффекты: сонливость, диплопия, головная боль, атаксия, тремор, тошнота, кожные высыпания.
Дата добавления: 2015-04-07 ; просмотров: 1518 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Важно понять механизм действия противоэпилептических средств и их фармакокинетику, чтобы эффективно использовать данные средства в клинической практике.
механизм действия противоэпилептических средств
Противоэпилептические средства (ПЭП) предназначены для того чтобы способствовать преобладанию торможения нервной системы над возбуждением, и тем самым предотвратить судорожную активность. ПЭП могут быть сгруппированы в соответствии с их основным механизмом действия, хотя многие из них имеют несколько действий.
Основные группы включают блокаторы натриевых каналов, текущие ингибиторы кальция, гамма-аминомасляной кислоты (ГАМК) усилители, глутамат-блокаторы, ингибиторы карбоангидразы, гормоны и препараты с неизвестными механизмами действия. Про историю лечения эпилепсии можете прочитать здесь.
Блокаторы натриевых каналов
Механизм действия противоэпилептических средств блокирующих натриевые каналы. Блокирование потенциала действия осуществляется через натриевые каналы. Каждый канал натрия динамически существует в следующих 3-х состояниях:
Во время активизации потенциала действия, эти каналы существуют в активном состоянии и способствуют притоку ионов натрия. Во время рефрактерного периода, количество натриевых каналов резко уменьшается. При постоянной стимуляциимногие из этих каналов становятся неактивными, что делает аксон неспособным распространяться потенциал действия.
ПЭП, которые нацелены на натриевые каналы, предотвращают возвращение этих каналов в активное состояние, стабилизируя их в неактивном состоянии.
Блокаторы кальциевых каналов
Механизм действия противоэпилептических средств блокирующих кальциевые каналы.Существуют кальциевые каналы в 3 известных формах: L, N, и T. Эти каналы являются небольшими и инактивируются быстро. Приток кальция в состоянии покоя производит частичную деполяризацию мембраны, содействуя развитию потенциала действия после быстрой деполяризации клетки.
Функция Кальциевых каналов как у “кардиостимуляторов ” способствуют нормальной ритмической активности мозга. Особенно это актуально для таламуса. Т-кальциевые каналы, как известно, играют важную роль в разрядах абсансов. ПЭП, которые ингибируют эти Т-кальциевые каналы особенно полезны для управления абсансами.
ГАМК усилители
Механизм действия противоэпилептических средств ГАМК усилителей. Гамма-аминомасляная кислота (ГАМК) имеет 2 типа рецепторов, А и В. ГАМК связывается с ГАМК-А рецептором, проходит в клетку с хрорид ионом, что облегчается действующими каналами хлорид иона. Этот приток хлорида увеличивает негатив клетки (то есть, более отрицательный мембранный потенциал покоя). Это приводит к трудности клетки в достижении потенциала действия. Рецептор ГАМК-B связан с калиевыми каналами.
Гамма-аминомасляная кислота (ГАМК)-рецептор опосредует хлорид (Cl-) приток, что приводит к гиперполяризации клетки и ее ингибирование. ПЭП могут действовать для повышения Cl-притока или уменьшать концентрацию ГАМК.ГАМК получают путем декарбоксилирования глутамата, опосредованного действием фермента декарбоксилазы глутаминовой кислоты. Некоторые ПЭП могут выступать в качестве модуляторов этого фермента, повышая производство ГАМК.
Глутамат блокаторы
Механизм действия противоэпилептических средств блокирующих рецепторы глутамата. Рецепторы глутамата связывают глутамат, возбуждающий нейротрансмиттер аминокислот. После связывания глутамата, рецепторы облегчают прохождение как натрий, так и ионов кальция в клетку, в то время как ионы калия идут обратным током от клетки.
Рецептор глутамата имеет 5 потенциальных участков связывания, а именно:
ПЭП, которые изменяют эти рецепторы антагонистичны глутамату.
Схематическое изображение N-метил-D-аспартат (NMDA) рецепторов.
Ингибиторы карбоангидразы
Механизм действия противоэпилептических средств ингибирующих карбоангидразу. Ингибирование фермента карбоангидразы увеличивает концентрацию ионов водорода внутри клетки и снижает рН. Ионы калия выходят из клетки и переходят в буфер кислотно-щелочного статуса. Это событие приводит к гиперполяризации и увеличивает эпилептический порог клеток.
Половые гормоны
Прогестерон является естественным противосудорожным, который действует за счет увеличения хлоридной проводимости в рецепторы ГАМК-А и. С другой стороны, эстроген действует как судорожное средство путем уменьшения хлоридной проводимости.

Каковы причины и механизмы развития эпилепсии? На какие звенья заболевания можно повлиять, для облегчения состояния? Важная информация далее.
Причины эпилепсии? Самые разнообразные
Эпилепсия может возникнуть на фоне целого ряда заболеваний. Например, причиной эпилепсии могут стать доброкачественные и злокачественные опухоли головного мозга, травмы головного мозга, аутоиммунные заболевания, а также неврологические заболевания, такие как инсульт и болезнь Альцгеймера (Vincent, 2011). Это приобретённые формы эпилепсии, которые имеют чёткую причину.
Но бывает и так называемая идиопатическая форма, когда причины эпилепсии не выявлены.
Предполагается, что важную роль играет генетика: при наличии заболевания у близкого родственника риск эпилепсии в 5 раз выше (Bhalla, 2011).
Приступы могут быть спровоцированы определёнными факторами, например, резкое снижение уровня сахара в крови (гипогликемия), обезвоживание, усталость, недостаток сна, стресс, чрезмерное тепло или холод, депрессия, яркие световые вспышки. У некоторых приступы провоцируют определённые продукты питания или экологические факторы.
Причины и механизмы развития эпилепсии
Натрий и калий при растворении в жидких средах организма ионизируются и приобретают электрический заряд и участвуют в генерировании электрических импульсов в мозге. Изменение концентрации этих электролитов влияет на электрическую активность в нервных клетках. Сниженные уровни натрия в крови (гипонатриемия) связаны с увеличением частоты приступов в перекрёстном исследовании, в котором участвовало 363 пациента (Halawa, 2011). Например, эпилептические приступы описаны в клиническом докладе о состоянии 54-летней женщины, которая потребляла большое количество безалкогольных напитков. Потребление большого количества воды снижало концентрацию ионов натрия, что и провоцировало приступ (Mortelmans, 2008). Дефицит магния и кальция также может стать причиной эпилептического приступа или фактором, утяжеляющим приступ (Castilla-Guerrera, 2006).
Метилксантины, в том числе кофеин, представляют собой семейство природных стимуляторов, которые обнаружены во многих пищевых продуктах и напитках, включая кофе, чай и шоколад. Метилксантины повышают активность центральной нервной системы и возбудимость нервных клеток. Множество наблюдений свидетельствует о том, что при правильно подобранной терапии и контроле эпилепсии частота приступов повышается при потреблении кофе.
- 4 чашки кофе в день увеличивают частоту приступов от двух в месяц до нескольких в неделю.
- 5–6 чашек кофе в день спровоцировало два приступа в течение месяца у молодого человека с полностью компенсированной эпилепсией (Blaszczyk, 2007; Kaufman, 2003; Bonilha, 2004).
Экспериментальные модели показывают, что кофеин снижает судорожной порог, снижая эффективность противоэпилептических препаратов (Chrościńska-Krawczyk, 2011). Клинические наблюдения подтверждены экспериментальными исследованиями на животных, что подтверждает необходимость ограничения потребления кофе у больных с эпилепсией (Jankiewicz, 2007).
Исследование 2003 г. показало, что эмоциональный стресс утяжеляет судорожные приступы у 64% больных эпилепсией (Haut, 2003). Другие исследования подтвердили эти выводы (Gilboa, 2011; Maggio and Segal, 2012). Точно так же усугубляют состояние усталость и недостаток сна (Frucht, 2000; Nakken, 2005).
Свободные радикалы играют важную роль и могут быть одним из механизмов нарушения работы нервных клеток при эпилепсии (Waldbum and Patel, 2010; Pieczenik and Neustadt, 2007). Свободные радикалы повреждают белковые структуры, ДНК и оболочки нервных клеток. Факторов, повышающих уровень свободных радикалов, множество, в том числе черепно-мозговая травма, нейродегенеративные заболевания (Halliwell, 2001).
Аспартам – подсластитель, заменитель сахара. Фенилаланин, в который превращается аспартам в организме, в высоких концентрациях является токсичным в отношении нервных клеток. Поэтому есть предположение, что очень высокие дозы аспартама могут стать причиной эпилепсии и вызвать судороги. Было установлено, что у детей приём аспартама в дозировке 40 мг/кг веса (или около 2800 мг на 70 кг веса) повышает электрическую активность в головном мозге, хотя и без возникновения судорожных приступов. Для пояснения: одна банка диетической колы содержит 180 мг аспартама. Таким образом, дозировка, исследуемая у детей, эквивалентна более чем 15 банкам колы для взрослого. Справедливости ради нужно отметить, что в обзоре, опубликованном в 2002 г., не было установлено связи между приёмом аспартама и эпилепсией (Butchko, 2002), однако эпилептикам рекомендуется ограничить потребление продуктов с аспартамом.
Глутамат натрия – усилитель вкуса. Установлено, что глутамат натрия, который широко применяется в продуктах питания, может вызвать судороги у животных, но взрослому человеку получить с продуктами питания очень высокие дозировки, эквивалентные тысячам граммов глутамата, практически невозможно. Тем не менее есть данные, что глутамат может снизить судорожный порог у детей с эпилепсией и приступ может возникнуть при минимальной провокации (Shovic, 1997). Кроме того, ряд врачей отмечает улучшение состояния и контроля над эпилепсией у пациентов, которые избегают продуктов с глутаматом.
Многие экологические токсины, включая некоторые пестициды и тяжёлые металлы, могут вызывать судороги. Например, ртуть и свинец утяжеляют эпилепсию (Landrigan, 1990; Brenner, 1980; Istoc-Bobis, 1987). Кроме того, инсектициды, относящиеся к органофосфатам, увеличивают электрическую активность мозга и могут вызывать судороги (Sanborn, 2002; Simpson, 2002).
Стандартное лечение эпилепсии включает в себя приём противоэпилептических препаратов в течение многих лет.
- блокаторы натриевых каналов (карбамазепин, лаотриджин, фенитоин);
- блокаторы натриевых каналов (вальпроевая кислота);
- активаторы гамма-аминомасляной кислоты (бензодиазепины, барбитураты);
- блокаторы рецепторов глутамата (топирамат);
- ингибиторы карбоангидразы (ацетазоламид).
Выбор препарата основывается на клинической диагностике, а также характере эпилепсии, возможных рисках и побочных эффектах для пациента при его приёме. Наиболее оптимальным является применение одного препарата – монотерапия. Результатом оптимально подобранного препарата и дозировки является отсутствие судорожных припадков. В целом почти 50% взрослых пациентов и 66% детей отмечают эффект от первого же препарата (Kwan and Brody, 2001; Prunetti and Perucca, 2011). Если к первому препарату снижается чувствительность или развиваются побочные эффекты, происходит его замена. При невозможности подобрать один эффективный препарат, используется комбинация противоэпилептических средств.
Вместе с тем коррекция образа жизни, характера питания и специальные фитонутриенты повышают эффективность проводимой терапии, снижают количество побочных эффектов, позволяют сохранять чувствительность к лекарствам и не наращивать объём медикаментозной терапии.


Антиэпилептические препараты (АЭП) и механизм их действия






Эпилепсия связана с возникновением стойкого очага возбуждения в мозге человека. Большая группа близко расположенных нейронов (основных функциональных клеток головного мозга) слишком активно генерирует электрические потенциалы, и они затем распространяются на другие отделы мозга 2.
Для того, чтобы понять, как работают АЭП, нужно сказать несколько слов про передачу сигнала между нейронами. Электрический сигнал идёт по нервному волокну. Ток в волокне образуется из-за переменного открытия и закрытия ионных каналов на поверхности клетки. Когда натрий и кальций проникают в нервную клетку через специализированные каналы, а калий стремится её покинуть, на мембране нейрона возникает разность зарядов, которая и является нервным сигналом, передающимся по нервному волокну. Когда электрический разряд доходит до окончания нервного волокна, из него в синаптическую щель начинает выделяться нейромедиатор – специальное вещество, передающее сигнал другому нейрону. Нейромедиатор может возбуждать клетку (например, глутамат) или снижать её активность (гамма-аминомасляная кислота, сокращенно – ГАМК) 3.

АЭП способны влиять на разные этапы описанного процесса и тем самым нормализовать работу нейронов. АЭП можно разделить на группы по их механизму действия следующим образом:
Блокаторы натриевых каналов:
- Ламотриджин препятствует избыточному выделению возбуждающего глутамата и мешает уже выделившемуся нейромедиатору вызывать в клетке возникновение электрического сигнала 4.
- Карбамазепин блокирует натриевые каналы на поверхности нейрона, препятствуя дальнейшему прохождению сигнала 4;
Влияющие на ГАМК:
Блокаторы кальциевых каналов:
- Этосуксимид блокирует кальциевые каналы, что также препятствует распространению сигнала по нервному волокну 4;

Модуляторы синаптических везикул протеина 2А:
- Леветирацетам усиливает воздействие нейромедиаторов, снижающих возбуждение нейрона и предполагается, что он обладает комплексным механизмом действия 4;
Препараты с множественным механизмом действия:
- Действие топирамата в основном заключается в увеличении тормозящего действия ГАМК на нервные клетки 4.
- Вальпроевая кислота увеличивает количество ГАМК в центральной нервной системе, однако механизм действия вальпроевой кислоты не до конца изучен и предполагается, что она обладает комплексным механизмом действия 4;

Все АЭП можно разделить на две большие группы – традиционные (базовые) препараты и, так называемые, новые препараты, полученные относительно недавно. При этом нельзя однозначно сказать, что новые препараты лучше традиционных, препараты, которые были синтезированы раньше, изучены более подробно. Врачам хорошо известны их побочные эффекты и взаимодействие с другими препаратами. появление новых молекул связано с поиском препаратов для тех случаев, где традиционные лекарства не сработали. Сейчас новые лекарства часто используются как дополнение к основной терапии к базовому препарату. 8

Антиэпилептические препараты (АЭП) являются одним из способов лечения эпилепсии. Самыми распространенными формами выпуска являются капсулы, таблетки и гранулы для приёма внутрь. Они в свою очередь делятся на препараты немедленного и замедленного высвобождения. Первые обладают важным недостатком: быстрый подъём концентрации препарата и её последующее снижение. В результате препарат оказывает более сильное действие на организм в начале своего пребывания в организме, но оно быстро уменьшается после достижения пиковой концентрации. При последующем уменьшении содержания препарата в крови снижается его воздействие на центральную нервную систему 5.

Таблетки с замедленным высвобождением препарата лишены описанного выше недостатка. Действующее вещество в несколько слоёв расположено на специальной основе. Растворяясь, такая таблетка даёт выход новым порциям препарата. При этом его концентрация поддерживается в течение длительного времени 5. Препараты с замедленным высвобождением могут уменьшить частоту приёма таблеток. У этого есть два важных последствия для лечения эпилепсии. Во-первых, пациенту становится удобнее выполнять назначения врача, то есть повышается приверженность терапии, за счёт уменьшения принимаемых таблеток. Во-вторых, такая форма выпуска позволяет лучше контролировать заболевание, за счёт отсутствия пиков концентрации препарата в крови, и её быстрого падения. В итоге изменение формы принимаемого препарата улучшает процесс лечения заболевания. Кроме таблеток с замедленным высвобождением есть ещё и гранулы с подобным принципом действия. Гранулы с замедленным высвобождением препарата могут насыпаться в жидкости или полужидкую пищу (йогурты), что облегчает применение лекарства у детей и лиц с затрудненным глотанием 6.

Среди лекарственных форм, в которых могут быть даны АЭП, есть не только таблетки и капсулы. Особое место в терапии эпилепсии занимают препараты в виде раствора, сиропа или капель, которые удобно применять в детской практике. Они лучше глотаются, так как являются жидкими. Часть препаратов может иметь в комплекте шприц для дозирования препарата или специальные мерные ложечки. Эти приспособления позволяют упростить процесс приёма препарата, а при определённой доле фантазии даже превратить его в игру. Форма в виде сиропа также может быть применена у пациентов с ограничением глотания.

Успехи эпилептологии и синтез новых противоэпилептических средств существенно изменяют стратегию и тактику лечения эпилепсии. Этому вопросу посвящено ряд работ как
отечественных, так и зарубежных авторов. Даже несколько по-иному формулируется основная цель лечения эпилепсии: если в недалеком прошлом главной целью было исчезновение или существенное уменьшение частоты припадков, то в настоящее время целью терапии определено улучшение качества жизни больного. Следовательно, главным является решение не чисто медицинских, а социальных проблем при помощи медицинских, социальных, педагогических, трудовых и других мероприятий, то есть, речь идет о реабилитации.
В 1996-1999 гг. нами были разработаны этапы лечения и реабилитации больных эпилепсией, включающие 5 основных следующих вопросов:
- Принятие решения о назначении противоэпилептических средств.
- Выбор антиконвульсантов.
- Профилактика осложнений.
- Социальные аспекты терапии.
- Популяризация медицинских знаний.
Первые три вопроса касаются особенностей проведения терапевтических мероприятий, т. е. кого, чем и как лечить. В настоящее время сюда следует включить раздел о принятии решения об отмене актиконвульсантов, так как осложнения от медикаментов, которые следует применять годами (в среднем 2-4 года), не должны превышать пользы от лечения. Это особенно важно в случае терапевтически резистентных форм эпилепсии. Не вызывает сомнения роль популяризации медицинских знаний и работа с родителями, которые должны помощниками врачей в проведении терапевтических мероприятий.
1. Принятие решения о назначении противоэпилептических средств
С классических позиций лечения любых заболеваний наиболее правильным можно было бы считать, что назначение противоэпилептических средств показано только при диагностировании эпилепсии как болезни. Хотя некоторые авторы придерживаются этой тактики, также обсуждаются следующие показания к назначению антиконвульсантов после однократного припадка: вероятность и высокий риск повторения, последствия рецидива для пациента (например, атонические припадки с внезапными падением), наследственность по эпилепсии, эпилептиформные изменения на ЭЭГ, очаговые неврологические расстройства, снижение интеллекта. А ведь однократный припадок - это еще не эпилепсия.
Несколько спорным является профилактическое (превентивное) лечение эпилепсии на стадии угрозы ее возникновения. Здесь необходимо учитывать два аспекта профилактики: первичная, касающаяся всех болезней, это здоровый образ жизни, и вторичная профилактика - выявление и лечение тех болезней, которые могут привести к возникновению других, более серьезных заболеваний. Примером тому является вторичная профилактика инфарктов миокарда, инсультов, детских церебральных параличей. Применительно к эпилепсии у детей угрозой возникновения данного заболевания нередко являются фебрильные припадки, которые могут быть простыми и сложными. При наличии последних, даже однократных, на первом году жизни или повторных в более поздние сроки показано назначение противоэпилептических средств. Об этом свидетельствуют как результаты наших прошлых исследований, так и работы последних лет. По данным сотрудника нашей кафедры Е. Е. Шарко, на большом клиническом материале было установлено, что в 18,8% случаев первым клиническим проявлением эпилепсии были фебрильные судороги. Значительно реже, по нашим данным, это могут быть также ночные страхи, ночные кошмары, респираторные аффективные припадки и конвульсивные обмороки. Нами разработаны критерии риска возникновения эпилепсии при данных пароксизмах.
2. Выбор антиконвульсантов
К препаратам первого выбора мы относим и фенобарбитал для лечения судорог у новорожденных и детей раннего возраста, реже - в более старшем возрастном периоде. В связи с широким использованием вальпроаты и иминостильбены производятся различными фармацевтическими фирмами под разными торговыми названиями. В настоящее время в Беларуси из вальпроатов имеются в основном конвульсофин, депакин и орфирил, а из иминостильбенов - карбамазепин, финлепсин, тимонил, зептол.
Наиболее широкий спектр действия у вальпроатов. Они могут назначаться при любом проявлении эпилепсии. То же касается и производных карбамазепина, за исключением абсансов и миоклонических припадков. В практической работе вальпроаты более широко используются при генерализованных, а карбамазепины - при парциальных припадках. В то же время, например, при парциальных судорожных припадках с одинаковым успехом могут быть назначены как вальпроаты, так и карбамазепины. Выбор конкретного антиконвульсанта, как пишет A. Arzimanoglou, - привычка врача, которая нами рассматривается как образ действий, основанный на личном опыте.
В настоящее время опубликован ряд работ о лечении всех разновидностей эпилепсии лишь одним препаратом. Мы полагаем, что такой подход научно не обоснован. Несомненно, что у разных врачей существует привычка использовать определенный препарат из одной химической группы, что обосновывается личным опытом. Мы, например, из иминостильбенов чаще назначаем финлепсин, а из вальпроатов - конвульсофин, используя и другие их аналоги. Это согласуется с мнением и других авторов. Главные требования к любому медикаменту - высокая эффективность, минимум побочных действий и доступная цена.
Последний социальный фактор играет существенную роль, в этом плане следует более широко использовать препараты отечественного производства. В случае побочных действий от антиконвульсантов первого выбора, их непереносимости, неэффективности или противопоказаний к использованию можно назначить препараты второго выбора, главным образом бензонал (бензобарбитал), сукцинимиды (суксилеп), клоназепам (антелепсин, ривотрил) и, значительно реже, дифенин и триметин.
В настоящее время в Беларуси зарегистрированы и используются топамакс и ламиктал. Приводим краткую характеристику этих медикаментов.
Топамакс по химической структуре является сульфамат-замещенным моносахаридом, по механизму действия - блокатором натриевых и кальциевых вольтажных каналов. Потенцирует эффекты ГАМК на ГАМК-эргические рецепторы, ингибирует карбоангидразу. При приеме внутрь быстро всасывается. С белками плазмы связывается 13-17% препарата. Выводится почками. Период полураспада препарата составляет 21-23 ч, что обуславливает возможность одно- или двукратного приема в течение суток. Стабилизация концентрации составляет 5-8 дней.
Является эффективным препаратом для лечения различных клинических проявлений эпилепсии, прежде всего локализованной формы. Используется в виде моно- и политерапии при терапевтически резистентных формах заболевания, при этом его эффективность составляет 10-20%. Может применяться для первичного лечения локализованной и генерализованной эпилепсии, особенно в начальных периодах болезни. Имеются указания об эффективности при таких труднокурабельных формах эпилепсии, как синдром Уэста и Леннокса-Гасто. По нашим данным, урежение частоты припадков на 50-60% при терапевтически резистентных формах эпилепсии наступило у половины больных. Эффективность лечения, вплоть до исчезновения припадков, повышалась при одновременном приеме пиридоксина.
Препарат с успехом используется при головной боли напряжения.
Из побочных эффектов в начале лечения могут быть общая слабость, утомляемость, головные боли, временное затруднение мышления, что лишь в единственном случае потребовало отмены препарата. Указанные нарушения обычно проходили в процессе лечения. При длительном приеме топамакса в дозировке 150-200 мг/сут наступало небольшое уменьшение массы тела.
Начальная доза - 1 мг/кг в день, поддерживающая - 5-9 мг/кг в день.
Ламиктал - одно из первых новых противоэпилептических средств. Механизм его действия связан с блокадой потенциалзависимых натриевых каналов пресинаптической мембраны нейронов в фазе медленной инактивации. Это приводит к снижению высвобождения возбуждающих медиаторов, главным образом глутамата, а также аспартата в синаптическую щель. При пероральном приеме препарат быстро всасывается. Пик концентрации в плазме крови наступает через 2-2,5 ч. Период полувы-деления составляет около 30 ч, а при одновременном приеме с вальпроатами - 60 ч. Используется для лечения детей с различными типами локализованной эпилепсии, а также при генерализованных судорожных припадках и абсансах, особенно атипичных и с атоническим компонентом. Назначается также при трудно поддающихся лечению инфантильных спазмах. Не оказывает влияния на рост и массу тела. Сохраняет и улучшает когнитивные функции. Используется при лечении синдрома Уэста. Наши данные также указывают на достаточную эффективность при терапевтически резистентных формах эпилепсии.
Из побочных действий возникает сонливость, головная боль, тошнота, тремор, атаксия, но они встречаются редко. Более серьезным осложнением является кожная сыпь, обычно макулопапулезного типа, что требует отмены препарата. Выпускается в таблетках по 50, 100, 200 мг.
Начальная доза при монотерапии - 0,6 мг/кг в день, а в сочетании с вальпроатами - 0,15 мг/кг в день, поддерживающие дозы соответственно 5-15 и 1-5 мг/кг в день.
Основные принципы лечения эпилепсии в детском возрасте можно сформулировать следующим образом:
- Монотерапия - лечение одним препаратом в зависимости от характера припадков и соматического состояния организма. В случае недостаточной эффективности дозировка медикамента повышается до максимальной суточной. В случае отсутствия эффекта данный препарат постепенно заменяется другим из другой химической группы, а при недостаточном эффекте добавляется еще один препарат.
- Непрерывность и длительность - не менее 2-4 (и даже 5 лет) после последнего припадка.
- Преемственность в амбулаторном и стационарном лечении в плане конкретных препаратов и дозировок.
- Тщательный контроль состояния ребенка во время лечения с целью выявления побочных действий препарата.
- Раннее выявление и лечение сопутствующих заболеваний.
- Возрастная корректировка - повышение дозировки с возрастом ребенка.
- Участие родителей в проведении лечения - понимание целей и задач, создание соответствующего режима.
Весьма актуально изучение терапевтически резистентных форм эпилепсии, когда последовательное использование двух антиконвульсантов не дает терапевтического эффекта. Причины такого состояния носят как субъективный (врачебные ошибки), так и объективный характер. К субъективным факторам относятся следующие:
- Несоответствие антиконвульсанта форме эпилепсии вследствие неправильной диагностики.
- Нерациональная полипрагмазия.
- Частая замена антиконвульсантов.
- Недоучет соматического состояния больного (заболевания печени, почек, крови и др.).
- Необоснованная и неправильная попытка лечения всех форм эпилепсии одним препаратом.
- Нарушение режима лечения вследствие неправильного понимания родителями сущности эпилепсии.
К объективным причинам относятся так называемые катастрофические формы эпилепсии в виде ранних детских энцефалопатий: синдромы Айкарди, Отахары, Уэста, Леннокса-Гасто, а также другие формы эпилепсии - синдромы Кожевникова и Расмуссена, Ландау-Клеффнера, симптоматические эпилепсии при мальформациях, факоматозах, нарушениях обмена.
В подобных случаях больные нередко годами принимают по 3 и даже 4 антиконвульсанта, которые не уменьшают частоту припадков. В таких случаях следует принимать решение об устранении избыточного лечения, что имеет как благоприятные стороны, так и определенный риск.
Общая эффективность лечения эпилепсии оставляет желать лучшего. В настоящее время эффективность лечения в виде устранения припадков или уменьшения их частоты более чем на 50% составляет 80%. Большое количество новых противоэпилептических препаратов существенно не повысило эффективность проводимой терапии.
В этой связи рано говорить о курабельности эпилепсии и возможности вылечить данную болезнь. В то же время современная тактика лечения эпилепсии позволяет существенно улучшить качество жизни больного.
- Вторичная профилактика эпилепсии в виде раннего назначения антиконвульсантов при угрозе ее возникновения может уменьшить частоту данной болезни.
- Препаратами первого выбора для лечения различных клинических форм эпилепсии у детей являются вальпроаты и иминостильбены (аналоги карбамазепина).
- Новые противоэпилептические средства (топирамат и ламиктал) являются препаратами второго выбора и могут использоваться в виде моно- и политерапии. Они являются достаточно эффективными при лечении терапевтически резистентных форм эпилепсии в детском возрасте.
- В комплексном лечении эпилепсии у детей могут применяться церебро- и гепатопротекторы при выраженных когнитивных расстройствах, прогрессирующей атрофии головного мозга и нарушении функции печени.
Читайте также:


