Современная тактика лечения эпилепсии
Основные стратегические положения терапии эпилепсии — своевременное начало, комплексность, непрерывность, длительность, преемственность. Тактика лечения — максимальная его индивидуализация.
Эпилепсия — всегда драматическое событие для самого больного и его семьи. Психологи считают, что наиболее тяжело переносится отсутствие прогноза. Больной эпилепсией постоянно находится в ожидании припадка. Это порождает тревогу, беспокойство, депрессию, страх. К этому прибавляются определенные ограничения в укладе жизни (нельзя водить машину, принимать алкоголь, нарушать режим сна — бодрствования), часто создается необходимость перемены работы или угроза полной ее потери и т. д. Вследствие названных причин у больных эпилепсией снижается качество жизни.
Основная стратегическая цель и критерий эффективности лечения эпилепсии — улучшение качества жизни больного.
Успех лечения эпилепсии возможен только при заинтересованном партнерстве врач — больной и врач — семья больного. Необходимо максимально успокоить больного и его близких, убедить их в том, что при правильном систематическом длительном лечении в сочетании с соблюдением соответствующего режима (об ограничениях в образе жизни было сказано выше) имеются реальные шансы на успех. Категорически запрещается резкая отмена и даже пропуск приема антиэпилептических препаратов (АЭП). Отмена или замена их производится только врачом, причем постепенно и, как правило, отмена не менее чем через три года от последнего припадка с учетом данных ЭЭГ.
Следует иметь в виду неблагоприятное влияние многолетнего применения антиэпилептических препаратов на организм, в частности на память, внимание, темп мышления и т.д., поэтому спешить с назначением АЭП не следует. Так, при реактивных припадках следует рекомендовать категорически избегать провоцирующих факторов либо максимально нивелировать их. Например: немедленно ввести антипиретики детям, склонным к фебрильным судорогам при малейшем повышении температуры; исключить недосыпание и тем более работу в ночную смену при приступах, провоцируемых недостаточностью сна, и т. д. При некоторых непровоцируемых приступах также иногда целесообразно не спешить с назначением АЭП, например при редких эпилептических припадках сна, при доброкачественной форме юношеской миоклонической эпилепсии, в случаях редких бессудорожных припадков.
Терапевтические дозы и фармакологические характеристики основных антиэпилептических препаратов - АЭП 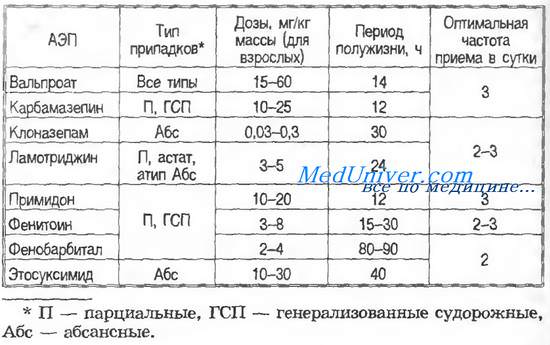
При выборе АЭП на первый план выступают форма эпилепсии и тип эпилептического припадка. АЭП имеют различные механизмы воздействия, которые в конечном счете:
1) способствуют поляризации клеточных мембран эпилептических нейронов (блокирование втока Na+ в клетку или выхода из нее К+);
2) нормализуют трансмиттерный баланс в глутаматергической и ГАМКергической системах.
При симптоматической или криптогенной эпилепсии со сложными и простыми парциальными припадками равноэффективны фенобарбитал, фенитоин (дифенин), карбамазепин (финлепсин, тегретол, тимонил), вальпро-ат (депакин, конвулекс, ацедипрол), ламотриджин (ла-миткал). Однако фенобарбитал обладает выраженным угнетающим действием (у детей часто, наоборот, вызывает гиперактивное состояние). Фенитоин имеет узкую терапевтическую широту и нелинейную фармакинетику, токсичен. Ламотриджин дорог. Поэтому фактически средствами первой очереди выбора являются вальпроаты и карбамазепин.
То же можно сказать о вторично генерализованных припадках, однако при наличии в ЭЭГ помимо очаговых эпилептических проявлений также генерализованных синхронных симметричных пик-волновых разрядов средством первой очереди выбора может стать вальпроат. Последний безусловно является абсолютно предпочтительным при идиопатической эпилепсии с первично генерализованными припадками, как судорожными, так и аб-сансами. При абсансах средством второй очереди выбора являются сукцинимиды — этосуксимид (суксилеп, пик-нолепсин, заронтин). Возможна их комбинация с валь-проатами. При судорожных припадках, развивающихся на фоне интоксикации, в частности эклампсии, а также при нефрите у детей прежде всего показано применение солей магния — обычно сульфата магния внутривенно. При всех видах припадков может быть показан в качестве дополнительного средства, особенно у детей, диа-карб, который помимо своих дегидратационных свойств обладает также истинной противоэпилептической активностью. Среди производных бензодназепина имеется ряд препаратов, в той или иной мере обладающих противо-эпилептическим эффектом. Это диазепам (седуксен, сибазон, реланиум), который применим главным образом при эпилептическом статусе; клоназепам, подавляющий ми-оклонические и некоторые другие эпилептические приступы; нитразепам, назначаемый при некоторых видах детской эпилепсии (детский спазм, синдром Леннокса — Гасто). Вигабатрин и габапентин не метаболизируются в печени, в связи с чем могут назначаться при ее заболеваниях; практически не взаимодействуют с другими АЭП. Получен обнадеживающий результат применения вигабатрина при наиболее трудной форме эпилепсии — синдроме Леннокса — Гасто. Имеются также АЭП с медленным контролируемым освобождением, которые при одно-, двукратном приеме способны обеспечить более стабильную концентрацию их в крови, а следовательно, обладают лучшим эффектом и меньшей токсичностью. К ним относится тегретол CR, финлепсинретард и депакин-хроно.
В последнее время на лекарственном рынке появился ряд новых АЭП — окскарбазепин (по сравнению с карба-мазепином обладает более стабильной концентрацией действующего вещества в крови и меньшей токсичностью), ламотриджин (ламиктал), упомянутые выше вигабатрин, габапентин, а также клобазам и др. Эти препараты могут быть эффективными главным образом при простых, сложных и вторично генерализованных припадках. Ламотриджин, по имеющимся данным, эффективно действует при наиболее трудно купируемых приступах у детей — атипичных (сложных) абсансах, атонических припадках и, как показано в последнее время, при первично генерализованных судорожных приступах.
Тактика лечения эпилепсии — максимальная индивидуализация в зависимости от ряда факторов: типа припадков и формы эпилепсии, возраста больных (у детей дозы АЭП на килограмм массы тела больше, у пожилых — меньше); приуроченности припадков к циклу сон — бодрствование (при припадках сна большая часть суточной дозы АЭП дается на ночь; часто больные получают корректоры сна, например феназепам, аллопу-ринол и др.); физического состояния больного и др. Большую проблему представляют больные с сопутствующими заболеваниями печени, поскольку АЭП обладают гепатотоксичностью. В настоящее время эта проблема упрощается в связи с появлением АЭП, не метаболизирующихся в печени (вигабатрин, габапентин). В таблице приведены дозы и характеристики основных АЭП.
Успехи эпилептологии и синтез новых противоэпилептических средств существенно изменяют стратегию и тактику лечения эпилепсии. Этому вопросу посвящено ряд работ как
отечественных, так и зарубежных авторов. Даже несколько по-иному формулируется основная цель лечения эпилепсии: если в недалеком прошлом главной целью было исчезновение или существенное уменьшение частоты припадков, то в настоящее время целью терапии определено улучшение качества жизни больного. Следовательно, главным является решение не чисто медицинских, а социальных проблем при помощи медицинских, социальных, педагогических, трудовых и других мероприятий, то есть, речь идет о реабилитации.
В 1996-1999 гг. нами были разработаны этапы лечения и реабилитации больных эпилепсией, включающие 5 основных следующих вопросов:
- Принятие решения о назначении противоэпилептических средств.
- Выбор антиконвульсантов.
- Профилактика осложнений.
- Социальные аспекты терапии.
- Популяризация медицинских знаний.
Первые три вопроса касаются особенностей проведения терапевтических мероприятий, т. е. кого, чем и как лечить. В настоящее время сюда следует включить раздел о принятии решения об отмене актиконвульсантов, так как осложнения от медикаментов, которые следует применять годами (в среднем 2-4 года), не должны превышать пользы от лечения. Это особенно важно в случае терапевтически резистентных форм эпилепсии. Не вызывает сомнения роль популяризации медицинских знаний и работа с родителями, которые должны помощниками врачей в проведении терапевтических мероприятий.
1. Принятие решения о назначении противоэпилептических средств
С классических позиций лечения любых заболеваний наиболее правильным можно было бы считать, что назначение противоэпилептических средств показано только при диагностировании эпилепсии как болезни. Хотя некоторые авторы придерживаются этой тактики, также обсуждаются следующие показания к назначению антиконвульсантов после однократного припадка: вероятность и высокий риск повторения, последствия рецидива для пациента (например, атонические припадки с внезапными падением), наследственность по эпилепсии, эпилептиформные изменения на ЭЭГ, очаговые неврологические расстройства, снижение интеллекта. А ведь однократный припадок - это еще не эпилепсия.
Несколько спорным является профилактическое (превентивное) лечение эпилепсии на стадии угрозы ее возникновения. Здесь необходимо учитывать два аспекта профилактики: первичная, касающаяся всех болезней, это здоровый образ жизни, и вторичная профилактика - выявление и лечение тех болезней, которые могут привести к возникновению других, более серьезных заболеваний. Примером тому является вторичная профилактика инфарктов миокарда, инсультов, детских церебральных параличей. Применительно к эпилепсии у детей угрозой возникновения данного заболевания нередко являются фебрильные припадки, которые могут быть простыми и сложными. При наличии последних, даже однократных, на первом году жизни или повторных в более поздние сроки показано назначение противоэпилептических средств. Об этом свидетельствуют как результаты наших прошлых исследований, так и работы последних лет. По данным сотрудника нашей кафедры Е. Е. Шарко, на большом клиническом материале было установлено, что в 18,8% случаев первым клиническим проявлением эпилепсии были фебрильные судороги. Значительно реже, по нашим данным, это могут быть также ночные страхи, ночные кошмары, респираторные аффективные припадки и конвульсивные обмороки. Нами разработаны критерии риска возникновения эпилепсии при данных пароксизмах.
2. Выбор антиконвульсантов
К препаратам первого выбора мы относим и фенобарбитал для лечения судорог у новорожденных и детей раннего возраста, реже - в более старшем возрастном периоде. В связи с широким использованием вальпроаты и иминостильбены производятся различными фармацевтическими фирмами под разными торговыми названиями. В настоящее время в Беларуси из вальпроатов имеются в основном конвульсофин, депакин и орфирил, а из иминостильбенов - карбамазепин, финлепсин, тимонил, зептол.
Наиболее широкий спектр действия у вальпроатов. Они могут назначаться при любом проявлении эпилепсии. То же касается и производных карбамазепина, за исключением абсансов и миоклонических припадков. В практической работе вальпроаты более широко используются при генерализованных, а карбамазепины - при парциальных припадках. В то же время, например, при парциальных судорожных припадках с одинаковым успехом могут быть назначены как вальпроаты, так и карбамазепины. Выбор конкретного антиконвульсанта, как пишет A. Arzimanoglou, - привычка врача, которая нами рассматривается как образ действий, основанный на личном опыте.
В настоящее время опубликован ряд работ о лечении всех разновидностей эпилепсии лишь одним препаратом. Мы полагаем, что такой подход научно не обоснован. Несомненно, что у разных врачей существует привычка использовать определенный препарат из одной химической группы, что обосновывается личным опытом. Мы, например, из иминостильбенов чаще назначаем финлепсин, а из вальпроатов - конвульсофин, используя и другие их аналоги. Это согласуется с мнением и других авторов. Главные требования к любому медикаменту - высокая эффективность, минимум побочных действий и доступная цена.
Последний социальный фактор играет существенную роль, в этом плане следует более широко использовать препараты отечественного производства. В случае побочных действий от антиконвульсантов первого выбора, их непереносимости, неэффективности или противопоказаний к использованию можно назначить препараты второго выбора, главным образом бензонал (бензобарбитал), сукцинимиды (суксилеп), клоназепам (антелепсин, ривотрил) и, значительно реже, дифенин и триметин.
В настоящее время в Беларуси зарегистрированы и используются топамакс и ламиктал. Приводим краткую характеристику этих медикаментов.
Топамакс по химической структуре является сульфамат-замещенным моносахаридом, по механизму действия - блокатором натриевых и кальциевых вольтажных каналов. Потенцирует эффекты ГАМК на ГАМК-эргические рецепторы, ингибирует карбоангидразу. При приеме внутрь быстро всасывается. С белками плазмы связывается 13-17% препарата. Выводится почками. Период полураспада препарата составляет 21-23 ч, что обуславливает возможность одно- или двукратного приема в течение суток. Стабилизация концентрации составляет 5-8 дней.
Является эффективным препаратом для лечения различных клинических проявлений эпилепсии, прежде всего локализованной формы. Используется в виде моно- и политерапии при терапевтически резистентных формах заболевания, при этом его эффективность составляет 10-20%. Может применяться для первичного лечения локализованной и генерализованной эпилепсии, особенно в начальных периодах болезни. Имеются указания об эффективности при таких труднокурабельных формах эпилепсии, как синдром Уэста и Леннокса-Гасто. По нашим данным, урежение частоты припадков на 50-60% при терапевтически резистентных формах эпилепсии наступило у половины больных. Эффективность лечения, вплоть до исчезновения припадков, повышалась при одновременном приеме пиридоксина.
Препарат с успехом используется при головной боли напряжения.
Из побочных эффектов в начале лечения могут быть общая слабость, утомляемость, головные боли, временное затруднение мышления, что лишь в единственном случае потребовало отмены препарата. Указанные нарушения обычно проходили в процессе лечения. При длительном приеме топамакса в дозировке 150-200 мг/сут наступало небольшое уменьшение массы тела.
Начальная доза - 1 мг/кг в день, поддерживающая - 5-9 мг/кг в день.
Ламиктал - одно из первых новых противоэпилептических средств. Механизм его действия связан с блокадой потенциалзависимых натриевых каналов пресинаптической мембраны нейронов в фазе медленной инактивации. Это приводит к снижению высвобождения возбуждающих медиаторов, главным образом глутамата, а также аспартата в синаптическую щель. При пероральном приеме препарат быстро всасывается. Пик концентрации в плазме крови наступает через 2-2,5 ч. Период полувы-деления составляет около 30 ч, а при одновременном приеме с вальпроатами - 60 ч. Используется для лечения детей с различными типами локализованной эпилепсии, а также при генерализованных судорожных припадках и абсансах, особенно атипичных и с атоническим компонентом. Назначается также при трудно поддающихся лечению инфантильных спазмах. Не оказывает влияния на рост и массу тела. Сохраняет и улучшает когнитивные функции. Используется при лечении синдрома Уэста. Наши данные также указывают на достаточную эффективность при терапевтически резистентных формах эпилепсии.
Из побочных действий возникает сонливость, головная боль, тошнота, тремор, атаксия, но они встречаются редко. Более серьезным осложнением является кожная сыпь, обычно макулопапулезного типа, что требует отмены препарата. Выпускается в таблетках по 50, 100, 200 мг.
Начальная доза при монотерапии - 0,6 мг/кг в день, а в сочетании с вальпроатами - 0,15 мг/кг в день, поддерживающие дозы соответственно 5-15 и 1-5 мг/кг в день.
Основные принципы лечения эпилепсии в детском возрасте можно сформулировать следующим образом:
- Монотерапия - лечение одним препаратом в зависимости от характера припадков и соматического состояния организма. В случае недостаточной эффективности дозировка медикамента повышается до максимальной суточной. В случае отсутствия эффекта данный препарат постепенно заменяется другим из другой химической группы, а при недостаточном эффекте добавляется еще один препарат.
- Непрерывность и длительность - не менее 2-4 (и даже 5 лет) после последнего припадка.
- Преемственность в амбулаторном и стационарном лечении в плане конкретных препаратов и дозировок.
- Тщательный контроль состояния ребенка во время лечения с целью выявления побочных действий препарата.
- Раннее выявление и лечение сопутствующих заболеваний.
- Возрастная корректировка - повышение дозировки с возрастом ребенка.
- Участие родителей в проведении лечения - понимание целей и задач, создание соответствующего режима.
Весьма актуально изучение терапевтически резистентных форм эпилепсии, когда последовательное использование двух антиконвульсантов не дает терапевтического эффекта. Причины такого состояния носят как субъективный (врачебные ошибки), так и объективный характер. К субъективным факторам относятся следующие:
- Несоответствие антиконвульсанта форме эпилепсии вследствие неправильной диагностики.
- Нерациональная полипрагмазия.
- Частая замена антиконвульсантов.
- Недоучет соматического состояния больного (заболевания печени, почек, крови и др.).
- Необоснованная и неправильная попытка лечения всех форм эпилепсии одним препаратом.
- Нарушение режима лечения вследствие неправильного понимания родителями сущности эпилепсии.
К объективным причинам относятся так называемые катастрофические формы эпилепсии в виде ранних детских энцефалопатий: синдромы Айкарди, Отахары, Уэста, Леннокса-Гасто, а также другие формы эпилепсии - синдромы Кожевникова и Расмуссена, Ландау-Клеффнера, симптоматические эпилепсии при мальформациях, факоматозах, нарушениях обмена.
В подобных случаях больные нередко годами принимают по 3 и даже 4 антиконвульсанта, которые не уменьшают частоту припадков. В таких случаях следует принимать решение об устранении избыточного лечения, что имеет как благоприятные стороны, так и определенный риск.
Общая эффективность лечения эпилепсии оставляет желать лучшего. В настоящее время эффективность лечения в виде устранения припадков или уменьшения их частоты более чем на 50% составляет 80%. Большое количество новых противоэпилептических препаратов существенно не повысило эффективность проводимой терапии.
В этой связи рано говорить о курабельности эпилепсии и возможности вылечить данную болезнь. В то же время современная тактика лечения эпилепсии позволяет существенно улучшить качество жизни больного.
- Вторичная профилактика эпилепсии в виде раннего назначения антиконвульсантов при угрозе ее возникновения может уменьшить частоту данной болезни.
- Препаратами первого выбора для лечения различных клинических форм эпилепсии у детей являются вальпроаты и иминостильбены (аналоги карбамазепина).
- Новые противоэпилептические средства (топирамат и ламиктал) являются препаратами второго выбора и могут использоваться в виде моно- и политерапии. Они являются достаточно эффективными при лечении терапевтически резистентных форм эпилепсии в детском возрасте.
- В комплексном лечении эпилепсии у детей могут применяться церебро- и гепатопротекторы при выраженных когнитивных расстройствах, прогрессирующей атрофии головного мозга и нарушении функции печени.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
С позиций стратегии лечения эпилепсии современная эпилептология постулирует ряд положений:
2. ЭП запускает или поддерживает механизмы функциональной и морфологической перестройки нейронных сетей и синапсов [12], нейротрансмиттерного обеспечения, которые составляют основу для формирования эпилептической системы и углубления процессов эпилептогенеза [4].
3. Чем раньше назначена адекватная терапия, тем лучше медицинский и социальный прогноз для пациента [29].
4. Наиболее эффективной и прогностически значимой является стартовая терапия [24]. Каждая последующая терапия дает меньший прирост эффективности [10].
5. Главными предикторами фармакорезистентности при эпилепсии являются количество перенесенных приступов до начала терапии и ответ на первую терапию [23].
- доброкачественные приступы новорожденных;
- фебрильные приступы;
- рефлекторные приступы;
- приступы, связанные с отменой алкоголя;
- приступы, вызванные лекарственными препаратами или другими химическими агентами;
- приступы, возникающие сразу после или в раннем периоде черепно-мозговой травмы (ЧМТ) / инсульта;
- единичные приступы или единичные серии приступов;
- редко повторяющиеся приступы (олигоэпилепсия).
После установления эпилептической природы пароксизмального события, формы эпилепсии и типа приступов необходимо определиться, следует ли начать противосудорожную терапию и если следует, то какой противоэпилептический препарат (ПЭП) выбрать для достижения оптимального результата.
Терапия может не назначаться при стимулсенситивных ЭП, проявляющихся исключительно провоцируемыми приступами (фотосенситивная, аудиогенная, музыкогенная и др.). Назначение ПЭП целесообразно лишь при комбинации рефлекторных и спонтанных приступов [18].
Какой препарат выбрать? Выбор ПЭП осуществляется дифференцированно в соответствии со спектром его эффективности, специфичности и потенциала аггравации приступов (табл. 1).
Следует учитывать, что оптимально успешным будет ПЭП, выбранный не только в зависимости от спектра его эффективности при разных типах приступов, но и на основе тщательной синдромологической диагностики [4, 5].
При назначении стартовой терапии обязательно учитывается возможность применения данного ПЭП в монотерапии. Принцип стартовой монотерапии – один из основополагающих в лечении эпилепсии; ограничиваются риски побочных эффектов и лекарственного взаимодействия. Соответствующие рекомендации по выбору ПЭП разработаны МПЭЛ на основе анализа всех исследований эффективности и переносимости различных ПЭП и степени доказательности этих исследований [19, 20]. Российские рекомендации с учетом национальной специфики (применение при различных формах эпилепсии, доступность на рынке) представлены в таблице 2.
Следует помнить, что выбор стартового ПЭП у пациента с впервые диагностированными или нелеченными ранее ЭП требует учета не только результатов исследований эффективности и переносимости ПЭП, но и множества факторов, касающихся конкретных ПЭП и пациента, включая национальные особенности (табл. 3) [20].
Рациональная терапия эпилепсии предполагает многолетний или пожизненный прием потенциально токсичных препаратов, нежелательные эффекты которых могут быть предсказуемыми в каждом конкретном случае, должны учитываться с самого начала лечения и контролироваться в его процессе.
Тактика стартового лечения эпилепсии базируется на общих принципах, основу которых составляют достижение максимального эффекта (ремиссия приступов) и оптимального качества жизни, удержание достигнутого эффекта. С практической точки зрения следующим этапом после выбора ПЭП являются создание оптимальной плазменной концентрации (ПК) ПЭП и удержание ее на постоянном уровне. Следует помнить, что эффективность ПЭП – показатель индивидуальный и дозозависимый. При подборе индивидуальной оптимальной дозы ПЭП должен применяться принцип титрования в соответствии с рекомендациями по применению данного ПЭП (табл. 4).
Титрование позволяет подобрать оптимальную эффективную дозировку и существенным образом уменьшить риск возникновения дозозависимых побочных эффектов. Наращивание дозы осуществляется до достижения клинического эффекта или появления побочных эффектов. Критериями достаточности дозы являются клиническая эффективность, оцениваемая по дневнику пациента, и оптимальная переносимость ПЭП. Показатели лекарственного мониторинга ПК при этом имеют вспомогательное значение.
Долгосрочная эффективность лечения обеспечивается стабильностью терапевтической ПК ПЭП, для поддержания которой следует соблюдать ряд условий:
- строго придерживаться установленного режима дозирования ПЭП. Оптимально подобранный ПЭП должен применяться постоянно, непрерывно под контролем эффективности и переносимости;
- отдавать предпочтение формам ПЭП с замедленным высвобождением активного вещества (ретардные формы вальпроатов и карбамазепина) или ПЭП с линейной фармакокинетикой (все ПЭП нового поколения);
- исключить фармакокинетическое взаимодействие ПЭП между собой (при приеме в режиме политерапии) [8] и с препаратами других групп (при лечении коморбидных расстройств) [17];
- избегать не обоснованных медицинскими показаниями переключений с одного ПЭП на другой, в т. ч. в рамках синонимических замен.
Кроме того, стабильность эффекта зависит от ряда факторов, которым следует уделять должное внимание:
1. Для ПЭП с возможными субклиническими побочными эффектами (гепатотоксичность, гематотоксичность) в процессе лечения необходим регулярный контроль клинических и биохимических анализов крови. Это положение прежде всего касается ПЭП, влияющих на активность печеночных трансаминаз: ингибиторов (вальпроаты) и индукторов (карбамазепин, фенобарбитал, фенитоин) [16].
2. При недостаточной эффективности или плохой переносимости стартовой монотерапии в зависимости от ситуации возможно применение различной тактики [14]:
- при отсутствии контроля приступов на фоне хорошей переносимости лечения следует повысить дозу ПЭП;
- если доза повышена до максимальной, но эффект не достигнут, показано добавление второго ПЭП, при достижении эффекта комбинации – снижение дозы первого ПЭП до полной отмены;
- при появлении неприемлемых побочных эффектов необходима быстрая смена ПЭП на другой ПЭП из линейки препаратов первой очереди выбора для данной формы эпилепсии;
- при появлении реакций идиосинкразии проводится немедленная смена ПЭП на другой ПЭП из линейки препаратов первой очереди выбора.
3. Переход к лечению в режиме политерапии осуществляется строго по показаниям, после неудачи монотерапии. Тактика политерапии никогда не должна использоваться для стартовой терапии эпилепсии [4].
4. Следует избегать воздействий, которые могут стать провокаторами приступов. Среди наиболее часто встречающихся провоцирующих факторов представлены: недосыпание, психоэмоциональные стрессы, перегревание и гипертермия, гиперинсоляция, злоупотребление продуктами с психостимулирующим действием (крепкий чай, кофе, энергетические напитки), алкоголь, курение, специфические провокаторы при рефлекторных приступах, перелеты в другие часовые пояса и др. Особая категория факторов риска – прием лекарственных средств с возможным проэпилептогенным воздействием: антигистаминные, нейролептики, антагонисты и агонисты дофамина, нестероидные противовоспалительные препараты, местные анестетики, симпатомиметики, ноотропы (пирацетам, экстракт листьев двулопастного гинкго и др.), виростатики и цитостатики, антибиотики (пенициллин в высоких дозах, фторхинолоны), теофиллин и его производные, пиперазина адипат, эстрогены, кетамин для наркоза. Целесообразность применения таких средств должна основываться на взвешенном соотношении возможного риска провокации приступов и потенциальной пользы [6].
- Вольф П. Фармакорезистентность и эпилепсия // Международный неврологический журнал. 2006. № 4(8) .
- Гуляева Н.В. Эпилепсия, гибель нейронов и нейрогенез / В кн.: Эпилептология в медицине XXI века / под ред. Е.И. Гусева, А.Б. Гехт. М., 2009. С. 119–131.
- Зенков Л.Р. Утяжеление эпилепсии вследствие противосудорожной фармакотерапии // Неврологический журнал. 2005. № 4. С. 4–9.
- Карлов В.А. Эпилепсия у детей и взрослых женщин и мужчин: руководство для врачей. М., 2010. С. 631–669.
- Мухин К.Ю., Миронов М.Б., Петрухин А.С. Эпилептические синдромы. Диагностика и терапия. Руководство для врачей. М.: Системные решения. 2014. 376 с.
- Рудакова И.Г, Белова Ю.А., Котов А.С. Фармакорезистентная эпилепсия поддается лечению // Вестник эпилептологии. 2013. № 1. С. 3–7.
- Рудакова И.Г. Современная стратегия и тактика терапии эпилепсии у взрослых. Учебное пособие. М.: МОНИКИ. 2013. 34 с.
- Федин А.И. Лекарственные взаимодействия при эпилепсии. В кн.: Эпилепсия / под ред. Н.Г. Незнанова. СПб.: 2010. С. 750–796.
- Brodie M.J., Schachter S.C., Kwan P. Fast facts: Epilepsy. Health Press Limited, Oxford, 2005. 127 p.
- Brodie M.J. Medical therapy of epilepsy:When to initiate treatment and when to combine? // J Neurol. 2005. Vol. 252. Р. 125–130.
- Commission on Classification of the ILAE. Proposal for revised classification of epilepsies and epileptic syndromes // Epilepsia. 1989. Vol. 30. Р. 389–399.
- Danzer S.C. Postnatal and adult neurogenesis in the development human disease // Neurosci. 2008. Vol. 14. Р. 446–458.
- Engel J.Jr. A proposed diagnostic scheme for people with epileptic seizures and with epilepsy: Report of the ILAE Task Force on Classification and Terminology // Epilepsia. 2001. Vol. 42 (6). Р. 796–803.
- Faught E. Monotherapy in adalts and elderly epilepsy persons // Neurology. 2007. Vol. 69. Р. 3–9.
- Fisher R.S., VanEmde Boas W., Blume W., Elger C., Genton P., Lee P., Engel J. Jr. Epileptic seizure and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE) // Epilepsia. 2005. Vol. 46. Р. 470–472.
- French J.A., Kanner A.M., Bautista J. et al. Efficacy and tolerability of the new antiepileptic drugs I: Treatment of new onset epilepsy // Neurology. 2004. Vol. 62. Р. 1252–1260.
- French J.A., Gidal B.E. Antiepileptic drug interactions // Epilepsia. 2000. Vol. 41 (supl 8). Р. 30–36.
- Gastaut H. Synopsis and conclusions of the International Colloquium on reflex seizures and epilepsies, Geneva 1988. In: Beaumanoir A., Gastaut H., Naquet R., eds. Reflex Seizures and Reflex Epilepsies. Geneve: Editions Medecine & Hygiene, 1989. Р. 497–507.
- Glauser T., Ben-Menachem E., Bourgeois B., Cnaan A., Chadwick D., Guerreiro C., Kalvainen R., Mattson R., Perucca E., Tomson T. ILAE treatment guidelines: evidens-based analysis of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes // Epilepsia. 2006. Vol. 47. Р. 1094–1120.
- Glauser T., Ben-Menachem E., Bourgeois B., Cnaan A., Guerreiro C., Kalvainen R., Mattson R., French J.A., Perucca E., Tomson T. Updated ILAE evidence review of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes // Epilepsia. 2013. Vol. 54 (3). Р. 551–563.
- ILAE Commission on Epidemiology; Subcommission on Definitions of Acute Symptomatic Seizures // Epilepsia. 2010. Vol. 51 (4). Р. 671–675.
- Kim L.G. et al. Prediction of risk of seizures recurrence after a sngle seizure and early epilepsy: Furthe from the MEES trial // Lancet Neurol. 2006. Vol. 5 (4). Р. 317–322.
- Kwan P., Brodie M.J. Early identification of refractory epilepsy // N Engl J Med. 2000. Vol. 341. Р. 314–319.
- Kwan P., Brodie M.J. Effectiveness of first antiepileptic drug // Epilepsia. 2001. Vol. 42. Р. 1255—1260.
- Nilsson L., Farahmand B.Y., Persson P.G., Thiblin I., Tomson T. et al. Risk factors for sudden unexpected death in epilepsy: a case control study // Lancet. 1999. Vol. 353. Р. 888–893.
- O'Donoghue M.F., Sander J.W.A.S. The mortality associated with epilepsy, with particular reference to sudden unexpected death // Epilepsia. 1997. Vol. 38. Р. 15–19.
- Panayiotopolos C.P. The epilepsies: seizures, syndromes and management // Bladon Medical Publishing, London. 2005. 540 p.
- Patsalos P.N., Perucca E. Clinically important drug interactions in epilepsy: interactions between antiepileptic drugs and other drugs // Lancet Neurol. 2003. Vol. 2. Р. 473–481.
- Schiller Y., Najjar Y. Quantifying the response to antiepileptic drugs: effect of past treatment history // Neurology. 2008. Vol. 70. Р. 54–65.
Только для зарегистрированных пользователей
Читайте также:


