Ацетилхолин и болезнь паркинсона
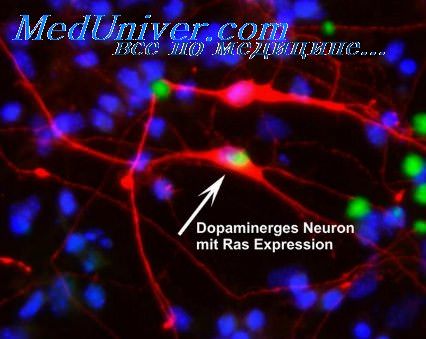
Характеристика дофаминергических нейронов черного вещества будет неполной, если не подчеркнуть основные особенности его влияния на хвостатое ядро. Хотя многие исследователи считают, что дофамин тормозит активность нейронов хвостатого ядра, ряду авторов при электрической стимуляции удавалось неоднократно наблюдать моносинаптические возбуждающие постсинаптические потенциалы в нейронах неостриатума.
В последующие годы было показано, что дофамин оказывает возбуждающее действие лишь на некоторые интракаудатные нейроны, которые, получая прямые возбуждающие влияния от черной субстанции, оказывают, в свою очередь, тормозной эффект по отношению к соседним популяциям нейронов хвостатого ядра. Поэтому в генерации тормозных постсинаптических потенциалов, по мнению некоторых исследователей, основное значение имеют интернейроны хвостатого ядра. Допускается также, что специфический эффект (облегчающий или тормозной) дофамина зависит от специфики воспринимающих рецепторов хвостатого ядра.
Вопрос о значении холинергических систем мозга в патогенезе паркинсонизма стал предметом научного исследования уже в начале этого века и не потерял своей актуальности до сих пор. Гениальная интуиция Шарко привела его к мысли о целесообразности применения при этом заболевании гиосциамина (алкалоида с холинолитическими свойствами, используемого в настоящее время для производства атропина). С тех пор холинолитические препараты традиционно использовались во всем мире в качестве основного антипаркинсонического средства. Широкая представленность разнообразных парасимпатических феноменов в клинической картине вегетативных нарушений при этом заболевании оправдывала применение этих средств и постоянно привлекала внимание исследователей к холинергическим механизмам в генезе паркинсонизма. Хотя эффективность холинолитиков оставляла желать лучшего, все остальные препараты, до появления 1-дофа, практически не помогали этим больным. Применение же холиномиметиков обычно обостряет симптомы паркинсонизма.
Надо сказать, что значение ацетилхолина, которое придается ему современными исследователями в генезе паркинсонизма, довольно точно соответствует той мере эффективности, которой обладают препараты холинолитического ряда при лечении этого заболевания.
Изучение распределения ацетилхолина в разных структурах головного мозга показало, что наибольшая его концентрация характерна для хвостатого ядра. Здесь же обнаружено большое количество ферментов, принимающих участие в процессах синтеза и распада ацетилхолина (холин-О-ацетилтрансфераза, ацетилхолинэстераза). Таким образом, хвостатое ядро представляет собой структуру, в которой сконцентрировано максимальное количество мозгового дофамина и ацетилхолина.
Однако если дофамин хвостатого ядра имеет, как было показано выше, нигральное происхождение, то этого нельзя сказать в отношении ацетилхолина. Поиски афферентных холинергических синапсов в неостриатуме привели практически к отрицательному результату. Поэтому предполагается, что ацетилхолин является собственным медиатором вставочных нейронов, чрезвычайно распространенных в хвостатом ядре.
Если дофамин тормозит активность хвостатого ядра, то ацетилхолин выполняет функцию возбуждения каудатных нейронов. Ацетилхолин повышает частоту разрядов каудатных нейронов почти в 10 раз чаще, чем тормозит их. Этот эффект ацетилхолина блокируется атропином, что свидетельствует о наличии М-холинореактивных систем в хвостатом ядре.
Паркинсонизм (по имени английского врача Паркинсона) — медленно прогрессирующий неврологический синдром, характеризующийся повышением тонуса мышц, дрожательным гиперкинезом, гипокинезией и акинезией, впервые был описан в 1817 г.
Синдром болезни удалось воспроизвести в экспериментах на животных, вводя им 6-оксидофамин, аналог дофамина. Проникая в везикулы нервных окончаний, он конкурирует с катехоламинами за включение в везикулы и в конечном счете подавляет катехоламин-ергическую передачу. Этот процесс иногда называют химической десимпатизацией.
Патогенез паркинсонизма связывают с выпадением функции черной субстанции ствола мозга и контроля базальных ядер за двигательными функциями. В мозге больных отмечается недостаточность черного пигмента — нейромеланина в телах нейронов черной субстанции, подвергающихся дегенеративным изменениям. Он обнаружен только у приматов и человека, и только у них развивается синдром паркинсонизма. Однако роль нейромеланина еще недостаточно выяснена.
Дофаминергические нейроны черной субстанции образуют ниг-ростриатный тракт, поэтому у больных паркинсонизмом отмечается снижение дофамина в стриатуме (скорлупе и хвостатом ядре), модулирующем через паллидарную систему активность таламокортикаль-ных путей и двигательную активность. Исследования с помощью по-зитронно-эмиссионной томографии показали, что болезнь Паркинсона прогрессирует до появления первых симптомов в течение пяти лет, к этому времени содержание дофамина в стриатуме у больных составляет 50% от нормы. Посмертные обследования мозга больных выявили, что концентрация дофамина в стриатуме у них снижается до 10-20% от нормы.
Дофаминергические пути имеют относительно ограниченное распределение в мозге, поэтому терапия болезни Паркинсона основана на повышении активности дофаминергической системы: а) введением предшественника дофамина — левоподы (L-ДОФА) и содержащих ее препаратов; б) введением ингибиторов ДОФА-декарбоксилазы, уменьшающих недостаток дофамина в стриатуме; в) использованием агонистов дофаминовых рецепторов. Тем не менее усиление дофаминергической передачи не только контролирует экстрапирамидные функции, но и воспроизводит другие центральные эффекты дофамина: рвотный рефлекс, уменьшение секреции пролактина, а также некоторые психотические проявления. При длительном лечении ДОФА-содержащими средствами у больных мо1ут отмечаться различные дискинезии.
Имеются данные о роли в патогенезе паркинсонизма ацетилхолина. Ацетилхолин в стриатуме высвобождается из холинергических интернейронов. Дофамин тормозит активность холинергических нейронов и высвобождение ацетилхолина через Г)2-рецепторы. Ацетилхолин — возбуждающий нейромедиатор для нейронов нео-стриатума, дофамин — тормозный. При паркинсонизме недостаток дофамина приводит к нарушению баланса активности холинергических и дофаминергических медиаторных систем в стриатуме. Поэтому использование М-холинолитиков, подавляющих повышенную холинергическую активность, улучшает состояние больных.
Кроме дофамина многие нейромедиаторы, такие как глутамат, ГАМК, аденозин, нейропептиды — метэнкефалин, динорфин и субстанция Р — вовлечены в функции стриатума. Так, основной медиатор нейронов стриатума — ГАМК, высвобождение которой модулируется нейропептидами. Активация А2А-аденозиновых рецепторов увеличивает высвобождение ацетилхолина и уменьшает высвобождение ГАМК нейронами стриатума, а глутамат, основной медиатор кортикальных и таламических волокон, также регулирует его активность. Однако широкое распространение этих нейромедиаторов в ЦНС создает определенные трудности и ограничения для использования при системном введении препаратов, манипулирующих их активностью в стриатуме.

Общий бал: 5 
Проголосовало: 5

Нигматуллина Лейла, терапевт, кардиолог, переводчик.
Башкирский государственный медицинский университет. Факультет: Лечебный, Январь 1999 — Январь 2005
"Мой супруг — офицер, человек очень уравновешенный. Он всю жизнь работал, ни на что не жаловался, я никогда не слышала от него про усталость. Но приблизительно шесть лет назад он стал слишком тихим, мало разговаривал — просто сидел и смотрел в одну точку. Мне даже в голову не пришло, что он болен. Наоборот, ругала, что раньше времени постарел. Примерно тогда же к нам приехала двоюродная сестра из Англии — она работает в больнице — и сразу сказала, что у Рафика все очень плохо, нужно завтра же вести его к врачу. Так мы узнали о болезни Паркинсона", — вспоминает Седа из Еревана.
Что такое болезнь Паркинсона
Паркинсон — одна из самых страшных фамилий, что можно услышать в кабинете у невролога. Ее носил английский врач, который в 1817 году подробно описал шесть случаев загадочной болезни. День рождения Джеймса Паркинсона, 11 апреля, и выбран памятной датой Всемирной организацией здравоохранения. Из-за основных симптомов Паркинсон называл недуг дрожательным параличом: движения больных замедляются, становятся скованными, мышцы сильно напрягаются, а руки, ноги, подбородок или все тело бесконтрольно трясутся. Впрочем, в четверти случаев дрожания — самого известного признака болезни — нет.
Все это напоминает обыкновенную старость. Двигательные симптомы — собирательно их называют паркинсонизмом — встречаются у многих здоровых стариков. Но болезнь Паркинсона этим не исчерпывается. На поздних стадиях человек легко теряет равновесие, то и дело застывает на месте во время ходьбы, ему трудно говорить, глотать, спать, появляются тревога, депрессия и апатия, мучают запоры, падает кровяное давление, слабеет память, а под конец часто развивается слабоумие. Самое печальное — вылечить болезнь Паркинсона пока невозможно.
В начале XX века российский невропатолог Константин Третьяков выяснил, что при болезни Паркинсона гибнут клетки черной субстанции, области мозга, которая частично отвечает за движения, мотивацию, обучение. Что вызывает смерть нейронов, неизвестно. Возможно, дело в сбоях внутри клеток, но еще замечено, что внутри них скапливается вредный белок. Оба процесса наверняка как-то связаны, но ученые не знают, как именно.
В 2013 году физиолог Сьюзан Гринфилд из Оксфордского университета представила новую модель развития нейродегенеративных заболеваний, в том числе болезней Паркинсона и Альцгеймера. Гринфилд предположила, что при повреждении мозга, например, от сильного удара выделяется особое вещество. У маленьких детей из-за него растут новые клетки, а на взрослых оно, судя всему, действует противоположным образом, дальше повреждая клетки. После этого следует еще больший выброс вещества, и цепная реакция постепенно разрушает мозг. По злой иронии взрослые впадают в младенчество из-за фермента, необходимого младенцам.

Впрочем, догадка Гринфилд объясняет не все. Болезнь Паркинсона связана с наследственностью: близкий родственник с таким же диагнозом или тремором другой природы — главный фактор риска. На втором месте — запоры: иногда их вызывают изменения в мозге, когда еще не появились двигательные симптомы. Также риск растет, если человек никогда не курил, живет за городом, пьет колодезную воду, но при этом сталкивался с пестицидами, а снижается — у любителей кофе, алкоголя и гипертоников. В чем тут секрет, непонятно, как непонятно, почему болезнь Паркинсона обычно начинается в старости: если на пятом десятке лет болеет примерно один из 2500 человек, то на девятом — уже один из 53.
Новую зацепку дала свежая работа ученых из Университета Томаса Джефферсона: возможно, болезнь Паркинсона связана с иммунной системой. Исследователи взяли мышей с мутантным геном, который часто встречается у больных, и ввели им безвредные остатки бактерий. Из-за этого у зверьков началось воспаление, затронувшее и мозг, причем иммунных клеток было в 3–5 раз больше, чем у обычных мышей. Из-за этого в мозге мутантов начались процессы, губительные для нейронов черной субстанции. Как и в модели Гринфилд, процессы эти оказались циклическими: воспаление в мозге может остаться даже после того, как тело справилось с инфекцией. Впрочем, сами авторы исследования признаются, что в этом механизме еще многое не ясно.
Каково живется больным и их близким
В России болезнь Паркинсона есть примерно у 210–220 тыс. человек. Но эти данные рассчитаны по косвенным показателям, а единого реестра не существует. Анастасия Обухова, кандидат медицинских наук с кафедры нервных болезней Сеченовского университета и специалист по болезни Паркинсона, считает эту статистику заниженной. "Многие больные впервые приходят уже на развернутых стадиях болезни. При расспросе удается выяснить, что признаки появились еще несколько лет назад. У большинства наших людей действует принцип "Пока гром не грянет, мужик не перекрестится": они читают в интернете, спрашивают соседок, а к врачу не обращаются. Это в Москве, а в маленьких городках и поселках к врачу идут только если совсем помирают", — объясняет Обухова.
Вдобавок попасть на прием не так-то просто. Для этого сначала нужно сходить к терапевту, чтобы тот направил к неврологу. Но и тогда нет гарантии, что человеку поставят правильный диагноз и назначат нужное лечение. "Врач в поликлинике не может разбираться во всем, поэтому должен послать больного к узкому специалисту. А окружных паркинсонологов, по-моему, убрали. Во всяком случае, пациенты на это жаловались", — рассказывает Обухова. Правда, если больной все-таки попал к нужному доктору, лечить его будут на мировом уровне. Оттого в Россию с болезнью Паркинсона прилетают даже из других стран.
Одиссею по кабинетам приходится часто повторять, потому что болезнь прогрессирует — терапию нужно подстраивать. Лечение обходится дорого: месячный запас некоторых лекарств стоит по 3–5 тыс. рублей, а на поздних стадиях назначают сразу несколько препаратов. "В районных поликлиниках лекарства иногда дают бесплатно, но только дешевые дженерики. Комментировать их качество не буду. Иногда нужных лекарств нет. Тогда их заменяют чем-то другим. Пациентам от этого плохо", — объясняет Обухова.
- Видео дня
- Функция допамина
- Допамин Лекарства
- Функции ацетилхолина
- Ацетилхолин Лекарства

Болезнь Паркинсона - дегенеративное расстройство центральной нервной системы. Самые ранние симптомы связаны с движением, включая тремор, жесткость, медленные движения и трудности ходьбы. Позднее симптомы могут включать мышление, сон, эмоциональные и поведенческие проблемы, включая слабоумие. Точная причина неизвестна, но как генетические, так и экологические факторы, по-видимому, играют определенную роль. Эти факторы приводят к гибели дофаминсодержащих нервов в части среднего мозга, называемой компактией Substia nigra pars. Допамин и ацетилхолин имеют роли в этой области мозга. Важно проконсультироваться с врачом для диагностики и лечения болезни Паркинсона.
Видео дня
Функция допамина
Допамин выделяется во многих областях мозга; однако есть четыре основных пути. Мезолимбический путь вовлечен в награду и подкрепление. Мезокортикальный путь помогает регулировать эмоциональный отклик и мотивацию. Тубоуронефундибулярный путь помогает регулировать гормональный пролактин. Нигростриальный путь помогает произвести движение и является основным путем, затронутым болезнью Паркинсона. После потери 80% или более нервных клеток в основной нигре, симптомы болезни Паркинсона будут развиваться. Механизм, лежащий в основе потери этих допаминовых клеток, неизвестен.
Допамин Лекарства
Наиболее распространенным лекарством, используемым для лечения болезни Паркинсона, является леводопа. В отличие от допамина, леводопа способен преодолевать барьер между кровью и мозгом. Он превращается в дофамин ферментом, называемым допа-декарбоксилазой в головном мозге, и может заменить часть потерянного дофамина. Он предоставляется с лекарственным карбидопом, который ингибирует допа-декарбоксилазу вне мозга, уменьшая превращение леводопы в дофамин в организме и тем самым уменьшая побочные эффекты. Агонисты допамина, такие как бромокриптин, связываются с нервными клетками и имитируют действия дофамина. Ингибиторы МАО-В уменьшают метаболизм дофамина.
Функции ацетилхолина
В центральной нервной системе ацетилхолин помогает с вниманием, возбуждением, наградой и ощущением среди других функций. В нормальном среднем мозге наблюдается баланс между дофамином и ацетилхолином. Потеря допамина снижает баланс в сторону слишком большого количества ацетилхолина, что также способствует двигательным симптомам.
Ацетилхолин Лекарства
Ацетилхолиновые препараты для болезни Паркинсона называются антихолинергическими средствами. Они блокируют сигнализацию ацетилхолина, чтобы помочь восстановить баланс допамина в ацетилхолине. Эти препараты чаще используются у молодых людей и помогают больше с такими симптомами, как тремор, а не замедление движения.Общие побочные эффекты могут включать сухость во рту, расстройство желудочно-кишечного тракта, расплывчатое зрение, сонливость и увеличение частоты сердечных сокращений.
ЧАСТЬ 2 Лечение
Цели лечения
К сожалению, излечиться от БП невозможно. Лечение является симптоматическим, в большой степени индивидуальным и направлено на борьбу с отдельными симптомами заболевания.
Основной целью терапии является восстановление подвижности и уменьшение выраженности основных клинических симптомов паркинсонизма. На ранней стадии БП ее проявления могут быть столь мягкими, что не требуют лечения. В этом случае больному советуют вновь обратиться к врачу лишь тогда, когда он почувствует, что его нормальная повседневная деятельность нарушилась.
Возможности терапии
При выборе терапевтического подхода следует иметь в виду следующие задачи:
1.Подавление нейротрансмиттерной активности ацетилхолина, что позволяет восстановить баланс между дофамином и ацетилхолином.
2.Повышение уровня дофамина почти до нормального, что опять-таки восстанавливает баланс дофамин/ацетилхолин.
1. Антихолинергические препараты
Механизм их действия состоит в блокировании активности ацетилхолина. К этой группе относятся, например, проциклидин и циклодол. Обладая недостаточным контролем над симптомами БП, эти препараты имеют явные побочные действия, такие как:
расстройство сознания;
в двоение в глазах;
сухость во рту.
Для пожилых больных эти побочные действия оказываются крайне утомительными, в связи с чем антихолинергические препараты, в целом, редко применяются у этой группы больных. Тем не менее у больных с более ранним началом БП лечение может быть начато именно с этих препаратов, т.к. молодые пациенты легче справляются с вышеуказанными побочными действиями.
Следует помнить, что антихолинергические препараты противопоказаны при глаукоме и гипертрофии предстательной железы; у больных с деменцией их используют с особой осторожностью.
2. Восстановление уровня дофамина — наиболее частый подход при симптоматическом лечении БП.
Применяются следующие классы препаратов:
Амантадин
Исходно разработанный для лечения вирусной инфекции, амантадин обладает умеренным действием и при БП.
Механизм его действия состоит в высвобождении дофамина из пузырьков (везикул) в пресинаптическом нейроне. Побочные действия включают:
расстройство сознания;
периферические отеки;
мраморность кожи.
В настоящее время амантадин редко применяется для лечения БП.
Селегилин
Селегилин принадлежит к классу ингибиторов МАО-В, которая способствует разрушению дофамина. Селегилин препятствует этому процессу.
Селегилин применялся как в качестве монотерапии до возникновения необходимости в приеме леводопы, так и дополнения к леводопе для усиления ее клинического действия.
Побочные действия селегилина:
расстройство сознания;
ортостатическая гипотония.
В продолжительном исследовании, проведенном Исследовательской группой болезни Паркинсона (Великобритания) и опубликованном в Британском медицинском журнале в 1995 году, выявлена повышенная смертность, связанная с сочетанным применением селегилина и леводопы. Клиницисты назначают селегилин с большой осторожностью, особенно не леченным ранее больным, а также контролируют пациентов, продолжающих получать селегилин.
Леводопа
Леводопа восстанавливает резерв дофамина в головном мозге и рассматривается как базовая терапия БП.
В отличие от дофамина, леводопа проникает через гематоэнцефали-ческий барьер (ГЭБ), где превращается в нейротрансмиттердофамин.
Чтобы облегчить поступление леводопы в ткани мозга, ее вводят в комбинации с ингибитором декарбоксилазы (ИДК). Без ИДК в периферическом кровотоке леводопа разрушается с образованием дофамина с помощью фермента допадекарбоксилазы (ДДК). Дофамин, образующийся на периферии, вызывает различные побочные действия, например тошноту. Следовательно, для уменьшения периферического образования дофамина целесообразно применять леводопу в комбинации с ИДК.
В состав Мадопара входит ИДК бенсеразид, при оптимальном соотношении леводопа: бенсеразид = 4:1.
В начале применения препаратов леводопы у больных отмечается выраженное клиническое улучшение. Уже спустя 3-5 лет от начала лечения эффективность леводопы снижается, что обусловлено дальнейшим прогрессированием заболевания. При этом у 50% больных возникает феномен истощения действия дозы или феномен флуктуации симптомов паркинсонизма. Флуктуации клинически проявляются аки-незией конца дозы и часто сочетаются с дискинезиями.
Дискинезии
Непроизвольные движения туловища и конечностей могут возникать на пике дозы леводопы, т. е. при достижении максимального уровня леводопы в плазме (самый частый вариант дискинезии "On" периода), либо в конце действия дозы (дискинезии "Off" периода).
Акинезии конца дозы
С течением заболевания и углублением дегенерации нейронов время действия каждой дозы леводопы укорачивается, что проявляется быстрым переходом больного в стадию "выключения" ("Off").
С течением времени у пациентов наблюдается сужение терапевтического диапазона, что отражает уменьшение способности поврежденных нейронов вырабатывать и, в особенности, накапливать дофамин. В начале заболевания этот процесс может быть частично компенсирован дробным приемом леводопы (т.е. частым приемом малых доз), который позволяет поддерживать постоянный уровень препарата в пределах терапевтического диапазона. Разработка новых лекарственных форм с контролируемым высвобождением леводопы дала возможность поддерживать еще более стабильный уровень препарата в терапевтическом диапазоне. Применение таких форм позволяет улучшить контроль над симптомами паркинсонизма и помогает избежать диски-нетических эффектов пика дозы.
Широкий терапевтический диапазон на ранних стадиях БП

По мере прогрессирования заболевания терапевтический диапазон сужается
Прямые агонисты дофамина
Препараты этого класса, аналоги дофамина, реализуют свой эффект, напрямую связываясь с постсинаптическими рецепторами, тем самым снижая потребность в дофамине и замедляя дегенерацию дофаминергических нейронов.
Тем не менее, широкое использование агонистов дофамина ограничено в связи с трудностью подбора доз и побочными действиями, такими как, например, галлюцинации и ортостатическая гипотония.
К этому классу препаратов относятся перголид и ропинирол. Один из прямых агонистов дофамина, апоморфин, может с успехом применяться подкожно на поздней стадии БП.
Ингибиторы КОМТ
В 1997 году впервые был применен новый класс противопаркинсонических препаратов, действие которых заключается в блокировании фермента катехол-0-метил-трансферазы в периферическом кровотоке. Тем самым улучшается обеспечение нейронов головного мозга леводопой, достигается ее стабильный уровень и нивелируются эффекты пика дозы.
Наиболее известны ингибиторы КОМТ толкапон (Тасмар, "Ф. Хофф-манн-Ля Рош Лтд.") и энтакапон.
ацетилхолин является специфическим нейротрансмиттером в системах соматической нервной системы и в ганглиозных синапсах вегетативной нервной системы.
Это химическое вещество, которое позволяет работать большому количеству нейронов и в то же время позволяет выполнять различные виды деятельности мозга..
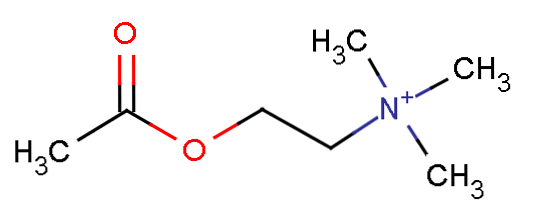
Ацетилхолин был описан фармакологически Генри Халле Дельтом в 1914 году и впоследствии подтвержден Отто Лоуи как нейротрансмиттер.
Основная активность ацетилхолина заключается в холинергической системе, той системе, которая отвечает за выработку и синтез ацетилхолина..
Что касается его наиболее важных эффектов, он подчеркивает сокращение мышц, движение, пищеварительные и нейроэндокринные процессы, а также активацию когнитивных процессов, таких как внимание и возбуждение.
Как работает ацетилхолин?
Как мы уже видели, в мозге млекопитающих информация между нейронами передается через химическое вещество под названием нейротрансмиттер.
Это вещество высвобождается в синапсе в ответ на определенный стимул и после высвобождения передает определенную информацию следующему нейрону.
Таким образом, секретируемый нейромедиатор действует в специализированных и высокоселективных рецепторных сайтах, поскольку существуют разные типы нейротрансмиттеров, каждый из которых действует в определенных системах..
Таким образом, холинергический нейрон может продуцировать ацетилхолин (но не другие типы нейротрансмиттеров), аналогично, холинергический нейрон может продуцировать специфические рецепторы для ацетилхолина, но не для других типов нейротрансмиттеров.
Таким образом, обмен информацией, осуществляемый ацетилхолином, происходит в нейронах и определенных системах и называется холинергическим..
Для действия ацетилхолина требуется передающий нейрон, который продуцирует это вещество, и рецепторный нейрон, который продуцирует холинергический рецептор, который способен транспортировать ацетилхолин, когда он высвобождается из первого нейрона..
Как синтезируется ацетилхолин?
Ацетилхолин синтезируется из холина, основного питательного вещества, которое организм вырабатывает.
Холин накапливается в холинергических нейронах в результате реакции с актил-КоА и под ферментативным воздействием холинацетилтрансферазы..
Эти три элемента находятся в определенных областях головного мозга, где будет производиться ацетилхолин, поэтому ацетилхолин делает нейротрансмиттер, принадлежащий к определенной системе, холинергической системе..
Когда в нейроне мы находим эти три вещества, которые мы только что прокомментировали, мы знаем, что он состоит из холинергического нейрона и что он будет продуцировать ацетилхолин посредством взаимодействия холина и принадлежащих ему ферментных элементов..
Синтез ацетилхолина осуществляется внутри нейрона, особенно в ядре клетки.
После синтеза ацетилхолин покидает ядро нейрона и проходит через аксон и дендриты, то есть те части нейрона, которые отвечают за связь и связь с другими нейронами..
Выпуск ацетилхолина
До сих пор мы видели, что это такое, как это работает и как ацетилхолин вырабатывается в мозге человека..
Таким образом, мы уже знаем, что функция этого вещества состоит в том, чтобы связывать и связывать определенные нейроны (холинергические) с другими специфическими нейронами (холинергическими).
Чтобы выполнить этот процесс, ацетилхолин, который находится внутри нейрона, должен быть освобожден, чтобы попасть в принимающий нейрон..
Для высвобождения ацетилхолина необходимо наличие стимула, который мотивирует его выход из нейрона.
Таким образом, если другой нейрон не реализует потенциал действия, ацетилхолин не сможет выйти.
И то, что для высвобождения ацетилхолина потенциал действия должен достигать нервного окончания, в котором расположен нейротрансмиттер.
Когда это происходит, тот же потенциал действия генерирует мембранный потенциал, факт, который мотивирует активацию кальциевых каналов.
Из-за электрохимического градиента генерируется приток ионов кальция, которые позволяют открывать мембранные барьеры и высвобождать ацетилхолин.
Как мы видим, высвобождение ацетилхолина реагирует на химические механизмы мозга, в которых участвуют многие вещества и различные молекулярные действия.
Рецепторы ацетилхолина
После выделения ацетилхолин остается на ничейной земле, то есть находится вне нейронов и находится в межсинаптическом пространстве..
Таким образом, для того, чтобы синапс мог быть выполнен, и ацетилхолин выполнил свою миссию общения с последовательным нейроном, необходимо присутствие веществ, известных как рецепторы..
Рецепторы - это химические вещества, основной функцией которых является преобразование сигналов, излучаемых нейротрансмиттером..
Как мы видели ранее, этот процесс осуществляется выборочно, поэтому не все получатели реагируют на ацетилхолин.
Например, рецепторы другого нейротрансмиттера, такого как серотонин, не будут захватывать сигналы ацетилхолина, так что он может работать, чтобы быть связанным с рядом специфических рецепторов.
В общем, рецепторы, которые реагируют на ацетилхолин, называются холинергическими рецепторами..
Мы можем найти 4 основных типа холинергических рецепторов: мускариновые агонистические рецепторы, никотиновые агонистические рецепторы, мускариновые антагонистические рецепторы и антагонисты никотиновых рецепторов..
Функции ацетилхолина
Ацетилхолин имеет много функций как физически, так и психологически или церебрально.
Таким образом, этот нейротрансмиттер отвечает за основные действия, такие как движение или пищеварение, и в то же время участвует в более сложных мозговых процессах, таких как познание или память..
Ниже мы рассмотрим основные функции этого важного нейромедиатора.
Это, пожалуй, самая важная активность ацетилхолина.
Этот нейротрансмиттер отвечает за сокращение мышц, контроль потенциала покоя кишечной мышцы, увеличение производства шипов и модулирование кровяного давления..
Действует мягко как сосудорасширяющее средство в кровеносных сосудах и содержит определенный расслабляющий фактор.
Другая фундаментальная функция ацетилхолина заключается в повышении секреции вазопрессина путем стимуляции задней доли гипофиза..
Вазопрессин является пептидным гормоном, который контролирует реабсорбцию молекул воды, поэтому его производство жизненно важно для нейроэндокринного функционирования и развития.
Кроме того, ацетилхолин уменьшает секрецию пролактина в задней части гипофиза.
Ацетилхолин играет важную роль в приеме пищи и в функционировании пищеварительной системы..
Этот нейротрансмиттер отвечает за увеличение кровотока в желудочно-кишечном тракте, повышает тонус желудочно-кишечных мышц, увеличивает желудочно-кишечные эндокринные выделения и уменьшает частоту сердечных сокращений.
Холинергические нейроны являются частью большой восходящей системы, поэтому они также участвуют в сенсорных процессах.
Эта система начинается в стволе головного мозга и иннервирует большие области коры головного мозга, где обнаружен ацетилхолин.
Основные сенсорные функции, связанные с этим нейротрансмиттером, заключаются в поддержании сознания, передаче визуальной информации и восприятии боли..
Было продемонстрировано, как ацетилхолин играет решающую роль в формировании воспоминаний, способности концентрироваться и развитии внимания и логических рассуждений..
Этот нейротрансмиттер обеспечивает защитные преимущества и может ограничивать появление когнитивных нарушений.
На самом деле было показано, что ацетилхолин является основным веществом, пораженным болезнью Альцгеймера..
Сопутствующие заболевания
Как мы уже видели, ацетилхолин участвует в различных функциях мозга, поэтому дефицит этих веществ может отражаться в ухудшении некоторых видов деятельности, обсуждавшихся выше..
Клинически, ацетилхолин был связан с двумя основными заболеваниями, болезнью Альцгеймера и болезнью Паркинсона.
Что касается болезни Альцгеймера, то в 1976 году было установлено, что в разных областях мозга пациентов с этим заболеванием уровни фермента холинацетилтрансферазы были на 90% ниже нормы.
Как мы уже видели, этот фермент жизненно важен для производства ацетилхолина, поэтому постулируется, что болезнь Альцгеймера может быть вызвана дефицитом этого вещества в мозге..
В настоящее время этот фактор является основной подсказкой, указывающей на причину болезни Альцгеймера, и охватывает большую часть научного внимания и исследований, проводимых как по заболеванию, так и по подготовке возможных способов лечения..
Что касается болезни Паркинсона, связь между причиной заболевания и ацетилхолином представлена менее четко..
Паркинсонизм - это болезнь, которая в основном влияет на движение, поэтому ацетилхолин может играть важную роль в его возникновении..
Однако причина заболевания сегодня неизвестна, и, кроме того, другой нейротрансмиттер, такой как дофамин, кажется, играет более важную роль, и большинство лекарств для этого состояния фокусируются на функции этого нейротрансмиттера..
Тем не менее, тесная связь между дофамином и ацетилхолином предполагает, что последний также является важным нейротрансмиттером при заболевании..
Что такое нейротрансмиттер?
Нейротрансмиттеры - это биомолекулы, которые передают информацию от одного нейрона к другому последовательному нейрону..
Мозг полон нейронов, которые позволяют мозговой деятельности, однако, они должны быть в состоянии общаться друг с другом, чтобы выполнять свои функции.
Таким образом, нейротрансмиттеры являются ключевыми веществами мозга, которые обеспечивают их активность и функциональность..
Передача информации между одним нейроном и другим осуществляется через синапс, то есть через передачу информации между передающим нейроном и принимающим нейроном (или клеткой)..
Поэтому синапс создается нейротрансмиттерами, поскольку именно эти вещества обеспечивают обмен информацией..
Как работает нейромедиатор?
Когда происходит синапс, нейротрансмиттер высвобождается везикулами на конце пресинаптического нейрона (тот, который излучает информацию).
Таким образом, нейротрансмиттеры находятся внутри нейрона, и когда они хотят общаться с другим, они освобождаются.
После высвобождения нейротрансмиттер пересекает синаптическое пространство и действует, изменяя потенциал действия в следующем нейроне, то есть он изменяет электрические ударные волны нейрона, с которыми он хочет связаться.
Следовательно, с помощью волны, которая высвобождает нейротрансмиттер, когда он находится за пределами нейрона, можно возбуждать или ингибировать (в зависимости от типа нейротрансмиттера) следующий нейрон.
Читайте также:



