Базальные ганглии при болезни паркинсона
Болезнь Паркинсона представляет собой нейродегенеративное заболевание. Касается пожилых людей – около 2/3 больных старше 65 лет, хотя бывают также случаи заболевания до 50 лет. Эта болезнь, медленно и коварно прогрессирующая, неизбежно приводит к постепенному уменьшению физических возможностей, а также интеллектуальных способностей.
Из-за общего старения населения мира, болезнь Паркинсона из года в год становится все более серьезной проблемой, тем более, что современная медицина не знает эффективного лекарства.
Причины болезни Паркинсона
В основе этого заболевания лежит дегенеративный процесс ограниченной группы нейронов (нервных клеток), расположенных среднем мозге, так называемые базальные ганглии, которые играют важную роль в контроле двигательной функции.
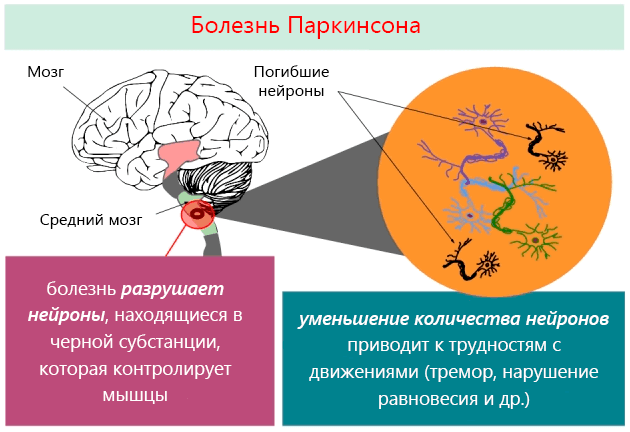
Один из этих ядер, называемое черной субстанцией, вырабатывает и выделяет очень важное вещество – допамин, который играет ключевую роль в контроле процессов движения. При болезни Паркинсона количество клеток черной субстанции снижается, что проявляется прогрессирующим снижением концентрации допамина в базальных ганглиях, что, в свою очередь, ведет к развитию болезни.
Из-за очень больших компенсаторных способностей мозга, симптомы болезни Паркинсона появляются только тогда, когда умрет около 80% клеток. Несмотря на то, что болезнь Паркинсона известна уже много лет, до сих пор не известно, что является причиной, ведущей к дегенерации клеток черной субстанции.
Иногда паркинсонизм может быть связан с использованием препаратов из группы нейролептиков. Это называется медикаментозный паркинсонизм.
Симптомы болезни Паркинсона
Центральная нервная система пациентов с паркинсонизмом нестабильна и её состояние ухудшается с течением времени. Болезнь Паркинсона обычно поражает людей в возрасте старше 60 лет.
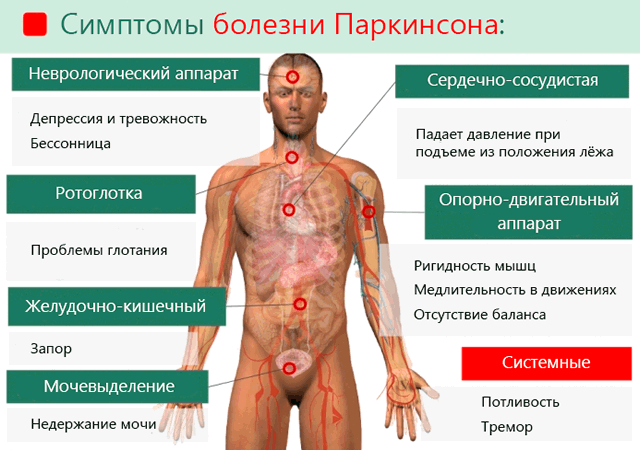
У каждого больного паркинсонизм проявляется немного по-разному. Темпы развития заболевания также индивидуальны. Симптомы болезни делятся на две группы: основные и вторичные.
Жесткие мышцы – это еще один симптом болезни Паркинсона. Часто возникает боль в мышцах, особенно при движении. Жесткое лицо из-за исчезновения мимики, невнятная речь, мелкий и неразборчивый почерк, трудности при глотании.
Болезнь Паркинсона, в целом, затрудняет перемещение, в том числе ходьбу, поэтому трудно начать идти. Часто человек, страдающий от паркинсонизма, останавливается во время движения из-за отказа мышц выполнять команды.
К вторичным симптомам паркинсонизма можно отнести частые запоры связанные с отсутствием контроля над кишечником и мочевым пузырем. Больные испытывают также проблемы с глотанием пищи и слюны.
Нарушается восприятие мира, что приводит к развитию тревоги и депрессии. Ограничивается также моторика, что проявляется шептанием при разговоре, сложностями с письмом и замедленной реакцией на заданный вопрос.
Болезнь Паркинсона вызывает чрезмерное слюноотделение и потоотделение, а также сухость кожи на лице и голове.
Болезнь развивается медленно, вызывая все больше и больше отклонений. Больные умирают, как правило, из-за осложнений, вызванных неподвижностью, таких, как воспаление легких или легочной артерии.
Лечение болезни Паркинсона
Не существует действенного лечения этой болезни. Однако, современная медицина предлагает лекарственные средства, которые позволяют отсрочить на несколько лет появление ярко выраженных симптомов заболевания, увеличивают продолжительность жизни больных почти на время жизни населения в целом и значительно улучшает качество жизни пациента.
К ним относятся:
- Леводопа – препарат, являющийся предшественника допамина;
- Агонисты дофамина (например, бромокриптин, прамипексол) – лекарства, которые имитируют действие допамина;
- Селегилин – препарат, блокирующий моноаминоксидазу типа-B – фермент, который разрушает дофамин.
Для симптоматического лечения важны такие элементы поведения, как:
- диета: должна быть подобрана индивидуально, чтобы не допустить изменения массы тела, содержать правильные пропорции жидкости и клетчатки; кроме того, пациенты, принимающие леводопа должны принимать меньшее количество белка;
- правильный режим жизни;
- упражнения, препятствующие развитию дегенеративных изменений и болевых синдромов;
- интенсивное лечение сопутствующих расстройств, таких, как запор или депрессия.
Пациентов, которые не реагируют на стандартные лекарства, особенно в случае сильного тремора, можно попытаться вылечить, используя один из новых хирургических методов:
- таламотомия – процедура, при которой хирург уничтожает небольшую область структуры мозга, называемой таламус, что приводит к снижению дрожи у 80-90% больных;
- пересадка стволовых клеток – экспериментальная техника, вызывающая много споров, хотя некоторое количество пациентов демонстрирует значительное улучшение, а у некоторых из улучшения настолько велики, что они могут играть в теннис, кататься на лыжах и управлять автомобилем.
Церебральный паркинсонизм также лечат с помощью лекарственных препаратов из группы холинолитиков, которые уменьшают количество ацетилхолина, а точнее, выравнивают зависимость уровня адреналин – ацетилхолина.
Рисунок демонстрирует взаимодействие нескольких известных специфических нейромедиаторов, функционирующих в пределах базальных ганглиев. На рисунке показаны: (1) дофаминовые пути от черной субстанции к хвостатому ядру и скорлупе; (2) пути гамма-аминомасляной кислоты от хвостатого ядра и скорлупы к бледному шару и черной субстанции; (3) ацетилхолиновые пути от коры к хвостатому ядру и скорлупе; (4) множество общих путей от ствола мозга, секретирующих норадреналин, серотонин, энкефалин и некоторые другие нейромедиаторы в базальных ганглиях и других частях большого мозга.
В дополнение к ним имеются множественные глутаматные пути (на рисунке не показаны), обеспечивающие основную часть возбуждающих сигналов, которые уравновешивают большое количество тормозных сигналов, передаваемых главным образом такими тормозными медиаторами, как дофамин, ГАМК и серотонин. О некоторых из этих медиаторов и гормональных системах будет сказано подробнее в следующих разделах при обсуждении поражений базальных ганглиев, а также в главах при обсуждении проблем поведения, сна и бодрствования и функций автономной нервной системы.
В данный момент следует вспомнить, что нейромедиатор ГАМК всегда функционирует как тормозной агент. Следовательно, ГАМК-нейроны в петлях обратной связи от коры через базальные ядра и затем назад к коре делают практически все эти петли петлями не положительной, а отрицательной обратной связи, таким образом придавая стабильность системам двигательного контроля. Дофамин в большинстве частей мозга является тормозным нейромедиатором; кроме того, при определенных условиях он функционирует как стабилизатор.
Помимо атетоза и гемибаллизма, которые уже упоминались в связи с поражениями бледного шара и субталамуса, две другие болезни развиваются при поражении базальных ганглиев: болезнь Паркинсона и болезнь Гентингтона.
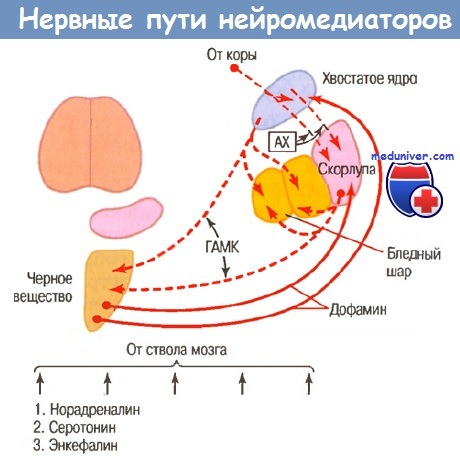
Нервные пути, секретирующие различные типы нейромедиаторов в базальных ганглиях.
AX - ацетилхолин; ГАМК - гамма- аминомасляная кислота
Болезнь Паркинсона. Болезнь Паркинсона, известная также как дрожательный паралич, является результатом широко распространенного разрушения той части черного вещества (компактная часть), которая посылает нервные волокна, секретирующие дофамин, к хвостатому ядру и скорлупе. Эта болезнь характеризуется: (1) ригидностью многих мышц тела; (2) непроизвольным тремором вовлеченных областей, развивающимся даже в покое, с постоянной частотой 3-6 циклов в секунду; (3) серьезными трудностями в инициации движений, что называют акинезией.
Причины этих двигательных нарушений неизвестны. Однако дофамин, секретируемый в хвостатом ядре и скорлупе, является тормозным медиатором; следовательно, разрушение дофа-минергических нейронов в черном веществе больного паркинсонизмом теоретически может привести к гиперактивности хвостатого ядра и скорлупы. Это, возможно, сопровождается наличием постоянных возбуждающих сигналов, передаваемых к кортикоспинальной системе двигательного контроля. Вследствие возникающего в результате избыточного возбуждения многих или всех мышц тела развивается их ригидность.
После потери торможения в контурах обратной связи возбуждение в некоторых из этих контуров может легко осциллировать, что ведет к тремору, характерному для болезни Паркинсона. Этот тремор принципиально отличается от мозжечкового, поскольку наблюдается постоянно в состоянии бодрствования, следовательно, является непроизвольным тремором. Мозжечковый тремор, наоборот, появляется лишь при выполнении человеком произвольных движений, и поэтому его называют интенционным тремором.
Акинезия при болезни Паркинсона доставляет больному гораздо большие неудобства, чем симптомы мышечной ригидности и тремор, поскольку для выполнения даже самого простого движения при выраженном паркинсонизме человек должен проявить высочайшую степень концентрации. Психическое напряжение, необходимое для выполнения желаемого движения, часто находится на грани волевых возможностей больного. Движения, если они все же осуществляются, обычно неуклюжие и прерывистые вместо плавных. Причина этой акинезии все еще спекулятивна.
Однако секреция дофамина в лимбической системе, особенно в прилежащем ядре (nucleus accumbens), часто уменьшена наряду с ее снижением в базальных ганглиях. Существует предположение, что это может угнетать психическое побуждение к моторной активности столь сильно, что в результате возникает акинезия.

Двигательные расстройства возникают в результате дисфункции базальных ганглиев - таламокортикальных моторных сетей нейронов и включают в себя большой спектр двигательных нарушений, от гипокинетических расстройств , например, болезни Паркинсона ( Parkinson) , до гиперкинетических расстройств - болезнь Гентингтона ( Huntington) , а также дистония и гемибаллизм. Патологические изменения в специфических областях базальных ганглиев значительно влияют на активность нейронов , распространяющуюся через все базально ганглионарные - таламокортикальные сети и активности нисходящих проекций на ствол мозга. Наиболее серьезные и грубые двигательные расстройства развиваются в результате дисфункции полосатого тела и субталамических ядер. Напротив, прерывание основных выходящих волокон из нейронов базальных ядер , внутреннего сегмента бледного шара , имеет небольшое значение или не отражается на двигательной активности. До сих пор причина столь разных нарушений двигательной активности остается сегодня неизвестной. вероятно, клиническая картина специфических двигательных расстройств определяется от комбинации изменений т степени нагрузки и паттернов , синхронизирующих необходимую для нее активность и в определенной степени зависит от индивидуальных особенностей моторных субнейронных сетей. Гипокинетические расстройства характеризуются нарушением инициации двигательной активности ( акинезия) , редукцией амплитуды и скорости свободных движений ( брадикинезия) , мышечной ригидностью ( усиливающейся резистентностью или сопротивлением при пассивных движениях ) и 4-6 Гц тремором покоя, а также согнутым положением тела. Гиперкинетические расстройства, напротив характеризуются насильственными движениями , такими как хорея ( случайные фрагментарные движения отдельных частей тела) , баллизмом ( движениями большой амплитуды , особенно в проксимальных отделах конченостей ), а также дистонией ( замедленные скручивающие движения и сохранением аномальной позы).
В основе паркинсонизма лежит дефицит дофамина в базальных ганглиях. Болезнь Паркинсона , впервые описанная в 1817 году поражает свыше миллиона людей в Северной Америке. В дополнение к основным симптомам - акинезии, брадикинезии , мышечной ригидности и тремору , другие моторные нарушения включают в себя: нарушение походки, согнутую позу, редцированную экспрессию лицевых мышц , редкое мигание , небольшие нарушение письма. Другая клиническая особенность паркинсонизма - уменьшение автоматической двигательной активности. Этиология болезни Паркинсона остается до конца неясной, но, вероятно, она связана с комбинацией наследственной предрасположенности и влиянием факторов внешней среды. Хроническая интоксикация пестицидами , проживание в сельской местности и потребление больших объемов воды способствуют возникновению данной болезни. Вероятно, митохондриальные токсины могут отрицательно влиять на активность дофаминергических нейронов нарушая их энергетический метаболизм. К факторам препятствующим развитию болезни Паркинсона следует отнести курение и частое потребление коффеина. Простые генетические мутации могут также предрасполагать к возникновению паркинсонизма.
Нарушения немоторных базально ганглионарн- таламо - кортикальных нейронных сетей могут обусловливать развитие когнитивных и бихевиоральных нарушений, сопровождающих двигательные расстройства , а также такого психического расстройства как обсессивно - компульсивное, синдрома Туретта и депрессии. В экспериментальных исследованиях на животных введение микроинъекций антагонистов GABA рецепторов ( бикукуллин ) в моторные, лимбические и ассоциативные волокна внешнего паллидарного сегмента у приматов способствует развитию у приматов различных нейроповеденческих синдромов , возникающих вследствидисфункции базально ганглионарных - таламокортикальных циклов. Инъекции в лимбическую часть внешнего сегмента бледного шара индуцирует стереотипные движения , в то время , как инъекции в ассоциативную часть индуцируют гиперактивность. Аномальные движения появляются только в случае введения бикукуллина в моторную область. Результаты этих исследований говорят о наличии в базальных ганглиях доменов связанных с поведением пациентов и роли этих структур в аномальной моторной и не моторной активности.
Поражение дорсолатерального префронтального кортекса или субкортикальной части префронтальных нейронных сетей сопровождается нарушениями когнитивного функционирования или исполнительного функционирования , в частности, в то время как повреждение латеральной орбитофронтальной нейронной сети ( круга) асоциируется с отсутствием эмпатии , эмоциональной лабильностью , раздражительностью и слабым ответом на социальные стимулы. Одним из хорошо изученных психических расстройств, возникновение которого связано с патологией не моторных нейронных кругов является обсессивно - компульсивное расстройство. Стереотипное поведение ( ригидные бихевиоральные паттерны) и компульсии являются характерными проявлениями этой психической болезни, вероятно, в генезе которой принимает участие дисфункция процедурального обучения ( procedural learning). Функциональное нейровизуализационное исследование пациентов с обсессивно - компульсивным расстройством демонстрирует нарушение активности в базальныг ганглиях - таламокортикальных лимбических нейронных связях , которые направляют свои волокна в орбиофронтальный и передний цингулярный ( поясной) кортекс. Наиболее значительные изменения в вентральном стриатуме , особенно в прилежащих ядрах и вентромедиальном хвостатом ядре и среднем мозге здесь играют активную роль. Позитивные результаты нейрохирургического лечения , направленные на лимбические нейронные связи , такие как разрез или стимуляция переднего лимба внутренней капсулы и вентрального стриатума или перерезка волокон , выходящих из орбитофронтального или переднего цингулярного кортекса , вероятно, обяъсняет роль этих структур в генезе обсессивно - компульсивного расстройства. Синдром Туретта , при котором обсессивно - компульсивные расстройства связаны с тиками и вокализмами также характеризуется отклонениями в лимбических нейронных связях ( кругах). Препараты, блокирующие рецепторы дофамина подавляют тики вызванные нарушением базальных ганглиев. Дополнительные изменения в активности некоторых областей коры мозга, связанными с особенно моторным кортексом и с моторными функциями и добавочными моторными областями также влияют на двигательные расстройства. Хроническая стимуляция моторных и лимбических связей между нейронами на паллидарном и таламическом уровнях сегодня применяется для лечения резистетных к терапии вариантов синдрома Туретта.
Дофамин. Нервные клетки, которые передают импульсы с помощью дофамина, сосредоточены преимущественно в трёх областях: в гипоталамусе, в чёрной субстанции и в вентральной покрышке. Нейромедиатором он работает только тут.
Итак, гипоталамус. Те нервные клетки, которые пользуются дофамином, чтобы общаться между собой, в этой области довольно замкнуты друг на друга: далеко свои аксоны не тянут, предпочитают свой тесный внутренний круг. Но при этом рулят довольно важными системными функциями: могут отдать команду на выработку ряда гормонов или тормознуть её, могут также, к примеру, понизить мотивацию на предмет чего-нибудь пожрать, могут усилить агрессивность или повысить либидо. Раз — и вектор человеческого поведения заметно поменялся.
Ну с гипоталамусом учёным ещё долго разбираться, там уж очень тесно и сложно намешано нервного и гормонального, а вот в чёрном веществе и в вентральной покрышке дофаминовые нервные клетки изучены подробнее. Не в последнюю очередь из-за паркинсонизма, шизофрении и наркотиков.
Если дофамина в чёрном веществе дофига, и чёрная субстанция активна, то такие люди — как правило, живчики. То есть, с удовольствием двигаются, танцуют, занимаются спортом и вообще получают кайф от движения. Те, кто победнее дофамином в своей чёрной субстанции — внешне кажутся более ленивыми, зато умеют получать удовольствие от чего-то иного: еды, например, новизны как таковой, созерцания.
Отростки нервных клеток из этой чёрной субстанции не только между собой соединены: в отличие от тех, что в гипоталамуса, у них более длинные лапки. И много таких отростков идут вверх, к большим полушариям головного мозга. И в частности — к скоплениям нервных клеток, которые названы базальными ганглиями. 80% этих ганглиев отвечают за движения.
На оставшиеся 20% идут отростки от другого образования —вентральной покрышки - на них-то как раз во многом завязана система, которая отвечает за формирование потребностей и мотиваций, которая тесно связана с эмоциями.
Соответственно, и нарушение работы в этой связке тоже не проходит для человека бесследно. Если в силу ряда (в том числе генетических) причин покрышка работает слабо — человек недополучает положительные эмоции от новизны. И в ряде случаев это оказывается стержнем будущей депрессии. Если дофамина в покрышке слишком много — получите скачку идей и неспособность долго сосредоточиться на одной мысли, как при выраженной мании. В отдельных же случаях система срабатывает вхолостую: вроде бы и нет входящего стимула, а отклик в покрышке почему-то возник.
Среди тех базальных ганглиев, к которым идут отростки от покрышки, есть такое образование — прилежащее ядро, или nucleus accumbens - центр, генерирующий положительные эмоции.
Именно на связь покрышки с прилежащим ядром и действуют наркотики амфетамин и кокаин, разгоняя, усиливая действие дофамина в ней. Именно это действие и даёт тот фейерверк положительных эмоций, тот прилив бодрости и сил, а также ощущение предельной собранности и кристальной ясности мышления вкупе с его быстротой.
![]()
Уж если в заголовок вынес болезнь Паркинсона, то как-то надо поподробнее про неё. И не понятно за каким ты в конце наркоту приплел ко всему. Начал за здравие, а кончил за упокой
Наркота, типа феназепама, вызывает синдром паркинсонизма
Внутри шизофрении. Часть 1.
Заболевание, которое можно счесть за шизофрению, было известно с древних времен, возможно, даже доисторических. Отчетливые упоминания есть в Библии (помните, как царь Навухудоносор кушал траву с луга?), ими сквозит Античность и так далее. Однако утверждать на 100% ничего невозможно: существуют психозы и помимо шизофрении, а также есть, например, паразиты, поражающие нервную систему и способные вызвать галлюцинации. К тому же, не надо забывать о сифилисе, который с человеком живет уж точно не меньше, чем шизофрения.

В историю шизофрении я не собираюсь сильно вдаваться, поскольку об этом много сказано. Все написанное выше я упоминаю только с одной целью: чтобы показать, насколько сложный и ускользающий смысл вкладывается в этот термин.
Здесь нужно сделать небольшую оговорку: нам с вами, с раннего детства давящимися плодами науки, которые созревали в течение столетий, люди прошлого могут казаться очень недалекими. Ну как тут было не отличить, скажем, расстройства настроения и психозы? Ну вот больного глючит, как скотину, а вот он просто грустный сидит. Очевидно же, что это разные заболевания! На самом деле, нет. Главная боль всей медицины состоит в том, что одна болезнь в большинстве случаев не мешает развиваться другой. И расстройства настроения (аффективные расстройства) не только не мешают психозам, а зачастую сочетаются.
(Вот и сам Крепелин):

Надо сказать, что в те годы содержимое черепа было настоящим черным ящиком для науки. Оно и сейчас в значительной мере остается черным ящиком, но тогда мы даже представить не могли, КАКАЯ херня там творится. Все эти нервные связи, нейромедиаторы, нейронные сети, колонки, контуры… Едва ли хоть кто-то догадывался, что все может быть устроено так странно. Сама идея о том, что электрическая активность мозга большей частью опосредуется химическими веществами – дикость какая-то. Поэтому все, что оставалось психиатрам тех лет – наблюдать и накапливать знания, надеясь на психиатров будущего.
Для того, чтобы хоть немного приоткрыть завесу тайны над заболеванием, нужны были очень крупные открытия в нейробиологии и нейрофизиологии, которые в те времена были невозможны просто технологически. Первый толчкок, который помог предположить истинные причины шизофрении, был со стороны фармакологии. Это открытие аминазина. Цитата с одного ресурса:
В 1950 году французский нейрохирург Генри Лабори предположил, что чрезмерные переживания его пациентов перед операцией вызывают выброс избыточного количества гистамина. Гистамин — небольшая молекула, которая регулирует сотни процессов в организме: от выделения желудочного сока до температуры. Лабори считал, что именно чрезмерный выброс гистамина из-за тревоги пациентов может вызывать осложнения анестезии и даже внезапную смерть.
Лабори методом проб и ошибок пытался подобрать подходящий антигистаминный препарат. Совершенно случайно он обнаружил, что не самое популярное лекарство — хлорпромазин — действительно успокаивает пациентов. Более того, хлорпромазин усиливал действие анестезии.
Предположение довольно типичное для тех времен, хотя и неверное. Тем не менее, ошибочное предположение привело к великому открытию – открытию первого на свете нейролептика. А сочетание нейролептиков с анестетиками используется до сих пор (нейролептанальгезия). Нейролептики (они же антипсихотики) – препараты, (относительно) избирательно действующие на симптомы психоза – бред и галлюцинации. Это открытие, в конечном счете, и помогло составить современные представления о причинах и патогенезе (т.е развитии болезни) шизофрении. Последовавшие исследования позволили открыть различные рецепторы в головном мозге, в том числе рецептора домафина. Именно тогда и оказалось, что основным эффектом нейролептиков является блокада эффектов дофамина, а дальше все заверте…
Вот мы и подошли к тому, чтобы описать сегодняшние представления о патогенезе шизофрении. Только представьте, какую дикую работу пришлось проделать, чтобы подойти к примерному представлению о том, как развивается эта психическая болезнь. Я буду идти в своем рассказе по такому принципу: от самых элементарных представлений на уровне молекул и клеток до нарушений в работе мозга в целом, а затем до нарушений психики.

Возможно, у вас уже возник вопрос: а почему тогда не использовать методы типа позитронно-эмисионной томографии или ф-МРТ и не выявить, какие отделы мозга работают неправильно? Да, заманчивая идея, и это, конечно же, пытались сделать, и даже есть результаты. Однако результаты эти породили больше вопросов, чем ответов. Действительно, удалось найти нарушения в работе мозга при шизофрении на ПЭТ и ф-МРТ, и касаются они преимущественно работы височных и лобных долей мозга, а также лимбической системы и их взаимодействия. Однако они встречаются не только при шизофрении, и не у всех шизофреников идентичны, чтобы можно было вбить в программу шаблон, который бы автоматически определял подобные изменения. Идея не нова, и в свое время изучали шизофрению с помощью рентгена, эхоэнцефалографии/скопии и других методик, однако результат всегда был похожим: да, что-то есть, но данных, однозначно указывающих на шизофрению, нет.

Как видно, даже здесь шизофрения дает прикурить. Очень мозаичное и скользкое заболевание, не дающее нам никакой нити, за которую можно было бы уцепиться и распустить весь клубок. Таким же оно предстает перед психиатрами – королева масок.
Как нетрудно догадаться, эти анатомические изменения порождают нейрохимические изменения, и тут, боюсь, придется вкратце напомнить основы нейрохимии мозга.
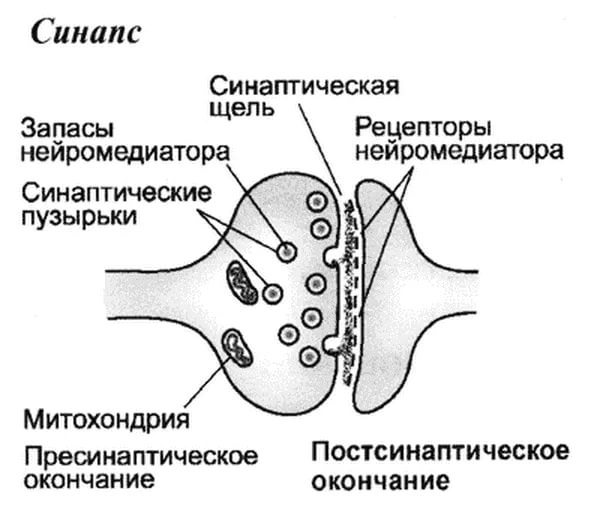
В нашем мозге постоянно осуществляется напряженная работа, которая проявляется в передаче электрических импульсов между нейронами. Соединение между двумя нейронами осуществляется с помощью специальной структуры – синапса. Примерно так он выглядит:
Что такое болезнь Гентингтона (или болезнь Хантингтона). Функции базальных ганглиев и их нарушения
Болезнь Гентингтона (вариант — болезнь Хантингтона, БГ, БХ) — генетическое заболевание, вызывающее прогрессирующее разрушение нервных клеток мозга (нейронов). Опасность заболевания состоит в том, что на сегодняшний день эффективной схемы лечения не разработано. Со временем БГ приводит к угнетению умственных способностей и снижению физической выносливости даже у людей трудоспособного возраста.
Болезнь Гентингтона является наиболее часто передаваемым генетическим расстройством. Любой из детей, рожденных от родителя с дефектным геном, имеет 50% вероятность развития заболевания. В настоящее время только в США проживает порядка 30 тысяч больных.

Рисунок 1. Мозг и болезнь Гентингтона
Болезнь Гентингтона (далее — БГ) влияет на весь мозг, но некоторые участки мозга более уязвимы, чем другие. На изображении выше показаны базальные ганглии — группа нейронов клеточных кластеров, называемых ядрами. Эти ядра играют ключевую роль в движении и контроле поведения. Данные участки мозга наиболее часто страдают при развитии БГ.
К базальным ганглиям или ядрам относятся:
- полосатое тело (хвостатое тело и базальное ядро);
- бледный шар;
- гипоталамическое ядро;
- черное вещество (черная субстанция).
Черная субстанция отвечает за двигательную способность мышц, их тонус, а также статическую и динамическую функцию.
В целом базальные ганглии весьма важны для нормального функционирования организма. Они регулируют высшую нервную деятельность, а нарушения их работы выражаются в двигательной дисфункции, потере равновесия, треморе (дрожании конечностей), непроизвольных движениях и прочих симптомах. Нарушение функции базальных ганглиев имеет место, например, при болезни Паркинсона.
В процессе развития болезни Гентингтона клетки мозга постепенно отмирают, в частности, речь идет о смерти клеток в хвостатом теле и базальном ядре, а также скорлупе полосатого тела. По мере отмирания нейронов больной становится всё менее способным контролировать собственные движения, а также вспоминать события из давнего или недавнего прошлого, принимать решения и контролировать свои эмоции. БГ приводит к появлению нетрудоспособности и, в конечном итоге, к смерти из-за ряда осложнений, возникающих в результате основной причины.
Основная масса больных начинает испытывать первые симптомы БГ в возрасте от 30 до 50 лет, однако начало болезни не исключено и в детском, и в пожилом возрасте.
Причины и симптомы болезни Гентингтона при различных видах нарушений
Единственная причина болезни Гентингтона — это унаследованный дефект. БГ — это аутосомно-доминантное заболевание. Данная формулировка означает, что для развития заболевания человеку достаточно иметь в ДНК лишь одну копию дефектного гена.
За исключением генов половых хромосом, человек наследует две копии гена, по одному от каждого родителя. Родитель с дефектным геном может передать ребенку либо здоровый ген, либо больной. Вот почему риск рождения больного ребенка у родителей-носителей составляет 50%.
Болезнь Гентингтона обычно вызывает двигательные нарушения, а также нарушения когнитивной и психической функции. Симптомы, которые проявляются первыми, обычно отличаются у разных пациентов. Некоторые расстройства преобладают над остальными, определенные функциональные особенности нарушаются больше.
Двигательные нарушения:
- непроизвольные подергивания;
- судороги;
- жесткость мышц;
- дистония;
- медленные, аномальные движения глазных яблок;
- нарушение походки;
- нарушение равновесия;
- искривление осанки;
- проблемы с балансом, ориентацией в пространстве;
- непроизвольные движения (тремор).
Чем дольше существует заболевание, тем хуже со временем становится тремор. Он мешает больному работать, выполнять обыденные процедуры, например, гигиенические, а также исключает возможность обслуживать себя самостоятельно.
Когнитивные нарушения:
- сложность восприятия;
- отсутствие возможности сосредоточиться на одной мысли;
- сосредоточенность (без необходимости) на одном и том же движении или действии;
- вспышки гнева;
- приступы сексуальной невоздержанности;
- отсутствие осознания собственного поведения, действий;
- замедленная реакция на требование найти что-либо;
- сложность в усвоении новой информации.
Депрессия при болезни Гентингтона не является обычным следствием тяжелого состояния. Она является логическим итогом нарушения функции тканей головного мозга. Вслед за физиологическим нарушением происходят психологические, появляются такие симптомы:
- раздражительность;
- апатия;
- печаль;
- бессонница;
- усталость;
- снижение остроты зрения;
- частые мысли о смерти.
Другие распространенные психические симптомы это:
- обсессивно-компульсивное расстройство;
- навязчивые мысли;
- повторяющиеся состояния и движения;
- развитие различных маний;
- гиперактивность;
- завышенная самооценка;
- биполярное расстройство;
- чувство нервного возбуждения без повода.
Болезнь Гентингтона может развиваться и в юном возрасте, в таком случае она называется ювенильной формой. Механизм возникновения и развития недуга у юных пациентов может отличаться от классического сценария развития БГ у пожилых людей. На ранних стадиях у детей или подростков может наблюдаться несколько ключевых форм отклонений, среди них особо выражены:
- поведенческие нарушения;
- физические нарушения.
Поведенческие нарушения при болезни Гентигтона у молодых пациентов следующие:
- потеря ранее усвоенных знаний;
- отсутствие способности осознать свое поведение (плохо/хорошо);
- неуправляемость;
- неконтролируемая активность;
- раздражительность;
- возбудимость;
- агрессия;
- немотивированная грусть и печаль;
- мысли о суициде.
Физические нарушения следующие:
- изменение походки из-за жесткости мышц;
- спазмы;
- судороги;
- изменение моторных навыков, например, почерка;
- непроизвольные движения головой, руками или ногами;
- приступы эпилепсии.
Симптомы можно разделить также на ранние и поздние.
К ранним относятся:
- легкая потеря контроля над движениями;
- неуклюжесть;
- спотыкание;
- безэмоциональность в ситуациях, на которые ранее была определенная реакция;
- недостаточность внимания, невозможность решить простую задачу;
- антисоциальное поведение.
Поздние симптомы:
- двигательные нарушения;
- дезориентация;
- невозможность самостоятельного выполнения обычных гигиенических и бытовых манипуляций;
- необходимость передвигаться при помощи инвалидной коляски или ходунков.
Лечение болезни Гентингтона, меры профилактики
В настоящее время официального метода лечения болезни Гентингтона не существует. В 2011 году канадские врачи предприняли попытку экспериментального лечения мышей. В лабораторных условиях ученым удалось обратить вспять симптомы физического проявления БГ. Данное исследование всё еще находится на стадии продолжения, изучение экспериментальной модели лечения продолжается.
В настоящее время не существует лекарственного средства или медицинской манипуляции, которые могли бы замедлить развитие болезни Гентингтона. Некоторые из существующих препаратов могут уменьшить проявления симптомов, например, частично устранить депрессию, тревожность, непроизвольные движения. Однако большинство этих препаратов обладает побочными эффектами, поэтому не все больные их применяют.
Профилактика болезни Гентингтона
Каковы основные методы профилактики болезни Гентингтона? Прежде всего, это генетическое тестирование. На ранних сроках беременности выявление у плода подобной патологии стало возможным сравнительно недавно. Кроме того, при диагностических центрах любой страны работают специалисты по генетическому консультированию. Родители могут принять решение о целесообразности прерывания или сохранения беременности, учитывая все варианты развития заболевания у будущего ребенка.
Развитие болезни Гентингтона происходит более стремительно, если не соблюдаются элементарные меры:
- отсутствие стрессов;
- хорошие условия жизни;
- своевременное лечение сопутствующих заболеваний;
- игнорирование неврологических симптомов.
Переболевшие коронавирусом не могут избавиться от сильного потоотделения
Читайте также:


