Билирубиновая энцефалопатия клинические рекомендации
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Клинические протоколы МЗ РК - 2014
Общая информация
Гемолитическая болезнь плода и новорожденного (ГБН) – изоиммунная гемолитическая анемия, возникающая в случаях несовместимости крови матери и плода по эритроцитарным антигенам, при этом антигены локализуются на эритроцитах плода, а антитела на них вырабатываются в организме матери. [1,2]
Название протокола: Гемолитическая болезнь плода и новорожденного
Код протокола:
Код(ы) МКБ-10:
Р55 Гемолитическая болезнь плода и новорожденного
Р 55.0 Резус – изоиммунизация плода и новорожденного
Р 55.1 АВО - изоиммунизация плода и новорожденного
Р 55.8 Другие формы гемолитической болезни плода и новорожденного
Р 55.9 Гемолитическая болезнь плода и новорожденного неуточненная
Р 56 Водянка плода, обусловленная гемолитической болезнью.
Р56.0 Водянка плода, обусловленная изоиммунизацией
Р56.9 Водянка плода, обусловленная другой и неуточненной гемолитической болезнью
Р 57 Ядерная желтуха
Р 57.0 Ядерная желтуха, обусловленная изоиммунизацией
Р 57.8 Другие уточненные формы ядерной желтухи
Р 57.9 Ядерная желтуха неуточненная.
Сокращения, используемые в протоколе:
Аг – антиген
Ат – антитело
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
ВИЧ – вирус иммунодефицита человека
Ht – гематокрит
ГБН – гемолитическая болезнь новорожденного
Г6ФДГ – глюкозо-6-фосфат-дегидрогеназа
ГГТ – гаммаглутамилтрансфераза
ДВС – диссеминированное внутрисосудистое свертывание
Жкт – желудочно-кишечный тракт
Ig – иммуноглобулин
КТГ – кардиотокография плода
НБ – непрямой билирубин
ОБС – общий билирубин сыворотки
ОЗПК – операция заменого переливания крови
ОЦК – объем циркулирующей крови
ОПН – отделение патологии новорожденных
ПБ – прямой билирубин
СЗП – свежезамороженная плазма
ТКБ – транскутанная билирубин метрия
ЩФ – щелочная фосфатаза
ЭМ – эритроцитарная масса
Дата разработки протокола: 2014 год.
Категория пациентов: новорожденные.
Пользователи протокола: неонатологии, анестезиологи-реаниматологи (детский), гематологи, трансфузиологии, педиатры, врачи общей практики, врачи скорой и неотложной медицинской помощи.
Примечание: в данном протоколе используются следующие классы рекомендаций и уровни доказательств
Классы рекомендаций
Класс I - польза и эффективность диагностического метода или лечебного воздействия доказана и/или общепризнаны
Класс II - противоречивые данные и/или расхождение мнений по поводу пользы/эффективности лечения
Класс II а – имеющиеся данные свидетельствуют о пользе/эффективности лечебного воздействия
Класс II б – польза-эффективность менее убедительны
Класс III - имеющиеся данные или общее мнение свидетельствуют о том, что лечение неполезно/неэффективно и, в некоторых случаях может быть вредным
Уровни доказательства эффективности:
А – результаты многочисленных рандомизированных клинических исследований или мета-анализа
В - результаты одного рандомизированного клинического исследования или крупных нерандомизированных исследований
С – общее мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
![]()
Желтуха новорожденных представляет собой изменение окраски кожных покровов и склер новорожденного на желтую, что вызвано повышением уровня билирубина в крови. Новорожденным считается ребенок в течение первых 28 дней жизни.
Эта тема посвящена распознаванию и лечению ранней неонатальной желтухи, которая чаще всего вызвана неконъюгированной гипербилирубинемией. В этот период также может возникать затяжная желтуха с конъюгированной гипербилирубинемией, лечение которой будет зависеть от патологической причины, однако последние подробно не рассматриваются в представленном материале.
-
Повышенная нагрузка билирубином на фоне увеличенного объема эритроцитов, укороченного жизненного цикла эритроцитов или усиленной энтерогепатической циркуляции. Сниженного захвата печенью в связи со снижением количества лигандинов или связью лигандинов с другими анионами Сниженная конъюгация в печени в связи со сниженной активностью уридиндифосфоглюкуронилтрансферазы (УДФГК ТФ) Полиморфизмы Gly71Arg и промотора TATA гена UGT1A1, которые уменьшают ферментативную активность УДФГК ТФ, считаются значительными факторами риска гипербилирубинемии новорожденных Сниженная экскреция в желчь.
-
Гемолитические анемии: они вызывают усиленную деструкцию эритроцитов, что приводит к повышенному образованию гема, который преобразуется в избыточное количество неконъюгированного билирубина; незрелая печень не в состоянии выносить чрезмерную нагрузку. Они могут возникать вследствие несовместимости групп крови (Rh, ABO), дефектов ферментов эритроцитов (недостаточность Г6ФДГ; недостаточность пируваткиназы); дефектов мембраны эритроцитов (например, наследственный сфероцитоз, детский пикноцитоз), талассемии могут быть медикаментозно индуцированными (витамином К, сульфонамидами, нитрофурантоином, противомалярийными средствами, пенициллином) или возникать в результате сепсиса Экстравазация крови: секвестрация крови в полостях приводит к повышенной нагрузке билирубином. Например, кефалогематома; внутричерепное, легочное или желудочнокишечное кровотечение; большие гемангиомы; обширные экхимозы; или петехии Полицитемии: повышенное количество эритроцитов приводит к повышенной продукции билирубина Усиление энтерогепатической циркуляции: замедление пассажа пищи по желудочно-кишечному тракту повышает уровень билирубина. Например атрезия/стеноз кишечника, пилорический стеноз, болезнь Гиршпрунга, мекониальный илеус/синдром мекониальной блокады Дефекты конъюгации: врожденные виды недостаточности фермента УДФГК ТФ – синдром Криглера–Найяра; угнетение фермента УДФГК ТФ может быть результатом воздействия лекарственных препаратов (например, новобиоцина) или семейной не гемолитической желтухи новорожденных Метаболических состояний (галактоземия, гипотиреоз, тирозиноз, гиперметионинемия, диабет у матери) Грудного вскармливания (в том числе невозможности обеспечить лактацию) Сниженное связывание билирубина с альбумином из-за повышенной способности свободного (не конъюгированного) билирубина проникать через гематоэнцефалический барьер. Это может быть вызвано лекарственными препаратами (сульфонамидами, пенициллином, гентамицином), ацидозом, асфиксией, гипотермией, повышенной осмоляльностью или гипогликемией.
-
Гепатоцеллюлярное заболевание:
-
Метаболические или генетические дефекты. Например, дефицит aльфa1-антитрипсина, муковисцидоз, синдром Зеллвегера, синдром Дубина–Джонсона (отсутствие в канальцах мембран гепатоцитов протеина 2, связанного со множественной лекарственной резистентностью), синдром Ротора (отсутствует органический анионтранспортировочный 1B1 полипептид [OATP] и OATP1B3 на синусоидальных мембранах гепатоцитов), а также галактоземия Инфекции. Например: краснуха, цитомегаловирус, герпес, сифилис, гепатит A и B, токсоплазмоз и инфекции мочевыводящих путей, вызванные Escherichia coli Полное парентеральное питание (ППП) Генетический гемохроматоз Идиопатический неонатальный гепатит
Билирубин – это конечный продукт катаболизма гема, основным источником которого является гемоглобин. Распад гемоглобина эритроцитов приводит к образованию гема (источник 75% билирубина). Гем также может быть производным (источник 25% билирубина) распада других белков, таких как миоглобин, цитохромы и синтазы оксида азота. Далее в ретикулоэндотелиальной системе гем подвергается катаболизму под воздействием гемоксигеназы (стадия, лимитирующая скорость реакции образования билирубина) до биливердина. Это происходит под воздействием биливердин-редуктазы с образованием билирубина.
Потом билирубин связывается с альбумином сыворотки в плазме и транспортируется в печень. Билирубин отделяется от альбумина, и с помощью белков-переносчиков, таких как лигандины, захватывается гепатоцитами. Далее в гепатоцитах происходит конъюгация билирубина с помощью фермента уридиндифосфоглюкуронилтрансферазы (УДФГК ТФ).
Билирубин-глюкуронид попадает в кишечник через желчный пузырь и общий желчный проток. В кишечнике новорожденного большая часть билирубин-глюкуронида становится несвязанной под воздействием бета-глюкуронидазы. Часть этого неконъюгированного билирубина реабсорбируется и включается в энтерогепатическую циркуляцию. Остаток конъюгированного билирубина попадает в толстый кишечник, где бактерии расщепляют его на уробилиноген, который затем экскретируется почками. Если этот нормальный процесс образования билирубина и его экскреции нарушается, возникает гипербилирубинемия.
Физиологическую желтуху обычно отмечают на 2-й день после рождения с пиком на 3–5-й день, а потом ее выраженность снижается. У доношенных новорожденных уровень сывороточного билирубина до 205,2 мкмоль/л (12 мг/дл) считается физиологическим.
Какая-либо желтуха, развившаяся в первые 24 часа жизни расценивается как патологическая. Уровень билирубина, превышающий 95-й процентиль согласно номограмме, является патологическим.
Желтуху обычно отмечают невооруженным глазом при изменении окраса кожных покровов и склер в желтый. Однако визуальное оценивание степени желтухи может привести к ошибкам, особенно у новорожденных с темной пигментацией кожных покровов. Следовательно, у каждого новорожденного с желтухой необходимо проводить чрескожное измерение уровня билирубина. Желтуха является физиологической, если она возникает на 2-й день после рождения и разрешается на первой неделе жизни, а показатели чрескожного измерения в норме. Всем новорожденным с желтухой, возникшей в первые 24 часа жизни и тем, у кого определяется повышенный уровень билирубина при чреcкожным измерении через 24 часа, требуется дальнейшая оценка.
Если возраст ребенка меньше 24 часов или уровень билирубина при чрескожном измерении составляет 205,2 мкмоль/л (12 мг/дл), тогда следует измерять общий билирубин сыворотки. Если уровень общего билирубина сыворотки составляет >205,2 мкмоль/л (12 мг/дл) или >95- го процентиля для данного возраста (в часах) согласно номограмме, следует провести пробу Кумбса. Если проба Кумбса положительна, следует проверить группы крови матери и новорожденного по системам ABO и Rh. При отсутствии несовместимости (несовместимость возникает, если у матери группа крови О, а у новорожденного А или В, или если мать является резусотрицательной, а новорожденный – резус-положительным), следует исключить несовместимость по второстепенным антигенам групп крови. Если результат отрицательный, следует проверить уровень прямого билирубина сыворотки.
Если уровень прямого билирубина >34,2 мкмоль/л (2 мг/дл), необходимо исключить различные причины конъюгированной гипербилирубинемии, такие, как гепатоцеллюлярное заболевание вследствие инфекций/метаболических или генетических причин, а также заболевание внепеченочных желчевыводящих путей. Исследования включают ФПП, бакпосев крови, определение редуцирующих веществ в моче, аминокислот плазмы, аминокислот в моче, бакпосев мочи, УЗИ органов брюшной полости и чрескожную биопсию печени.
Если уровень прямого билирубина 65%, необходимо исключить полицитемию, определив уровень гематокрита (в образце венозной или артериальной крови). Если гематокрит в норме или снижен, определяют уровень ретикулоцитов в мазке периферической крови. Если уровень ретикулоцитов повышен, необходимо рассмотреть причины гемолитической анемии (несовместимость групп крови, недостаточность ферментов эритроцитов). Анализы включают определение группы крови и скрининг на глюкозо-6-фосфатдегидрогеназу (Г6ФДГ). Если мазок периферической крови с отклонениями от нормы, необходимо искать специфические дефекты мембраны эритроцитов (их проверяют с помощью анализа на осмотическую стойкость эритроцитов).
Билирубиновая энцефалопатия (именуемая также ядерной желтухой) - состояние, характеризующееся гибелью мозговых клеток вследствие токсического влияния на них высокой концентрации билирубина (непрямой фракции). Подобное состояние наиболее часто встречается у новорожденных и требует немедленного лечения, в противном случае может привести к инвалидизации и даже гибели пациента.
Этиология болезни
Возможные причины билирубиновой энцефалопатии у новорожденных следующие:
- гемолитическая болезнь (резус- либо групповая несовместимость мамы и малыша);
- сахарный диабет у матери;
- сепсис новорожденного;
- травматизация ребенка при родах с формированием обширных гематом;
- токсоплазмоз (внутриутробное заражение);
- желтуха у недоношенных деток.
Под влиянием какого-либо из перечисленных процессов непрямой билирубин (то есть непереработанный гепатоцитами) в большом количестве выбрасывается в кровь, оказывая нейротоксическое воздействие на мозговые ткани.
Патоморфологические признаки
Поверхность головного мозга имеет бледно-желтый оттенок. Срез препарата выявляет характерную желтую окраску мозговых структур (мозжечка, гиппокампа, таламуса, ствола и других). Однако непрокрашенные области также претерпевают патологические изменения.
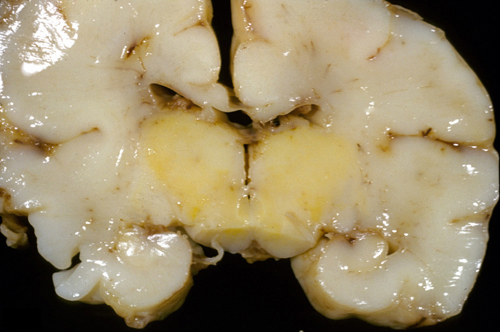
В пораженных областях вследствие гибели нейронов формируется глиоз и происходит атрофия нервной ткани. При этом патоморфологическая картина сходна с таковой при гипоксическом поражении, а значит, с большой долей вероятности можно предполагать, что несвязанный билирубин, повреждая клеточные мембраны, приводит к нарушениям утилизации кислорода в мозговых тканях. А гипоксическое повреждение приводит к еще большему увеличению чувствительности нейронов к токсическим эффектам билирубина.
То есть, ядерная желтуха (билирубиновая энцефалопатия) - это не только изменение окраски мозговых структур под действием билирубина. Это также целый ряд патологических специфических процессов, происходящих на уровне клетки.
Билирубиновая энцефалопатия у взрослых
Причины поражения мозговых структур билирубином у взрослых кроются в тяжелых декомпенсированных патологиях печени (циррозы, гепатиты).
Недуг у взрослых развивается постепенно и сопровождается нарастанием неврологической симптоматики. При этом на первый план выходят нарушения психики и двигательной активности, проявляющиеся бессонницей, когнитивными изменениями, понижением активности и так далее.
Клинические проявления
Чаще всего первые признаки патологии возникают у доношенных деток на 2-5 сутки, а у недоношенных - на 7 сутки. Но присутствие гипербилирубинемии может приводить к развитию недуга в течение всего времени новорожденности (до 28 суток).
Ранние симптомы такой энцефалопатии неспецифичны и могут совпадать с таковыми при гипогликемии, сепсисе, внутричерепных кровоизлияниях, гипоксии и других патологических острых состояниях новорожденного.
Как правило, первыми признаками начинающегося поражения мозга становятся снижение сосательного рефлекса, сонливость, пропадание рефлекса Моро. По мере ухудшения (прогрессирования) болезни пропадают сухожильные рефлексы, нарушается дыхание, возникает опистотонус, большой родничок напряжен, лицевые мускулы и мышцы конечностей судорожно подергиваются, ребенок пронзительно кричит.
Затем появляются судороги, сопровождающиеся резким разгибанием ручек и поворотом кистей, сжатых в кулачки, вовнутрь.
Дальнейшая активность процесса часто приводит к гибели, в другом случае состояние ребенка улучшается, и развитие соответствует норме. Однако к году вновь возникает ригидность мускулов, опистотонус и гиперкинезы. Ко второму году жизни судороги и опистотонус исчезают, однако непроизвольные беспорядочные движения, сочетающиеся с гипотонией либо ригидностью мускулов сохраняются и приобретают устойчивый характер.
В трехлетнем возрасте билирубиновая энцефалопатия у детей обретает стойкий и четкий характер, что проявляется тугоухостью на звуки с высокой частотой, хореоатетозом, судорогами, дизартрией, косоглазием, олигофренией, экстрапирамидными нарушениями. Иногда встречается атаксия, гипотония и пирамидные расстройства.
При легком течении билирубиновой энцефалопатии последствия могут проявляться в виде тугоухости, умеренных либо легких нарушений двигательной координации, синдрома гиперактивности в сочетании с нарушенным вниманием (минимальная мозговая дисфункция). Такие симптомы могут сочетаться либо присутствовать по отдельности. При этом энцефалопатия может быть не диагностирована вплоть до поступления в школу.
Стадийность процесса
Патология имеет четыре стадии развития:
- Симптомы билирубиновой энцефалопатии неспецифичны: присутствует слабость, рвота, монотонный безэмоциональный крик. Тонус мышц и аппетит снижены.
- Появляются симптомы энцефалопатии, конечности малыша согнуты, разогнуть их при этом невозможно, подбородок приведен к груди, ребенок неестественно вскрикивает. В некоторых случаях возможна гипертермия и эпизоды апноэ.
- Состояние больного (чаще 10-12 сутки жизни малыша) заметно улучшается, однако явление это не связано с выздоровлением, напротив - процесс прогрессирует. Скованность мышц отступает, отсутствуют судороги.
- Развивается на 2 месяце жизни малыша. Симптоматика нарастает. Присутствуют признаки, сходные с таковыми при церебральном параличе. Ребенок значительно отстает в психоэмоциональном и физическом развитии.
Диагностические мероприятия
Гипербилирубинемия может расцениваться как физиологическая только в случаях исключения абсолютно всех патологических факторов ее появления. Беря во внимание тот факт, что гипербилирубинемия наиболее часто является следствием гемолитических либо физиологических причин, обследование пациента должно включать следующие анализы:
- исследование крови (общее) с обязательным вычислением количества ретикулоцитов и микроскопией кровяного мазка;
- проба Кумбса (непрямая и прямая);
- выяснение групповой и резус-принадлежности крови матери и малыша;
- определение количества непрямого и прямого билирубина;
Увеличение содержания в пуповинной крови билирубина, наличие симптомов желтухи в первые сутки жизни, если уровень неконъюгированной фракции более 34 мкмоль/л указывают на присутствие патологической желтухи.
В некоторых случаях могут назначаться при билирубиновой энцефалопатии МРТ, УЗИ и КТ.
Терапия состояния
Терапией ядерной желтухи у малышей (вне зависимости от ее стадии) занимается детский невропатолог. Как правило, таких деток госпитализируют.
Лечение недуга у взрослого также проводится в условиях стационара под постоянным контролем врача.
Лечение заболевания заключается в ликвидации причин гипербилирубинемии и восстановлении нормальной концентрации билирубина в крови. В качестве лечения при этом используется фототерапия.
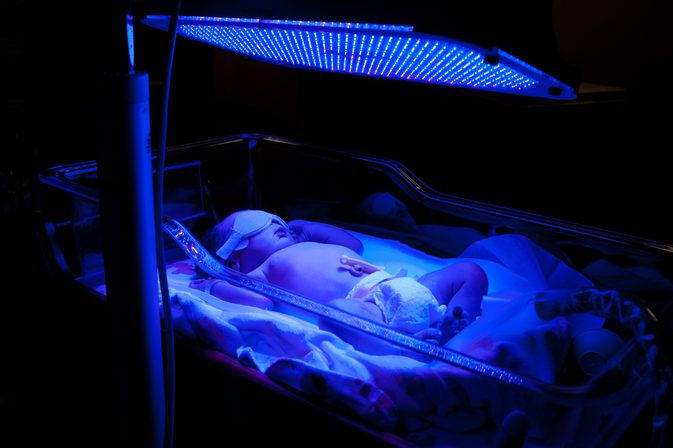
Под влиянием излучения токсичный непрямой билирубин трансформируется в особый изомер, который легко выводится почками и печенью и при этом не связывается с кровяными альбуминами. В случаях, когда концентрация билирубина под влиянием фототерапии не понижается, назначается переливание плазмы.
Если предыдущие методики оказались неэффективными, либо симптоматика стремительно нарастает, пациенту назначаются прямые переливания крови.
Применяемые препараты
Если по каким-то причинам прямое переливание невозможно, назначаются лекарства, влияющие на синтез и трансформацию билирубина ("Протопорфирин").
Вследствие того, что ядерная желтуха - результат токсического воздействия билирубина на нейроны, в лечении ее всегда применяются нейропротекторы.
При наличии показаний назначается противосудорожное лечение.
В случае гемолитической болезни с наличием прямой положительной реакции Кумбса эффективны внутривенные вливания иммуноглобулина.
Частота возникновения, последствия и прогнозы
Согласно данным аутопсии, ядерная желтуха возникает у новорожденных в любом гестационном возрасте при отсутствии адекватной терапии гемолитической болезни и концентрации билирубина свыше 25-30 мг.
Частота возникновения недуга у недоношенных деток с гипербилирубинемией варьируется от 2 до 16 %. Более точные цифры определить невозможно вследствие большого разнообразия симптомов болезни.
Присутствие выраженного неврологического симптомокомплекса является неблагоприятным прогностическим признаком. Так, летальность при этом доходит до 75 %, а 80 % выживших пациентов имеют двусторонний хореоатетоз, сопровождающийся мышечными непроизвольными сокращениями. Кроме того, достаточно часто встречаются осложнения в виде глухоты, олигофрении и спастической тетраплегии.
Детки с гипербилирубинемией в анамнезе должны быть обязательно обследованы на предмет глухоты.
Несмотря на улучшение диагностики, ядерная желтуха все же имеет место. Встречается информация о возникновении ее на фоне гипербилирубинемии без наличия каких-либо причин. А потому специалисты рекомендуют проводить обязательный контроль билирубина на 1-2 день жизни всем новорожденным, дабы выявить пациентов с высокой вероятностью развития тяжелой гипербилирубинемии и, как следствие, энцефалопатии.
Профилактические меры
Важно обязательное исследование концентрации билирубина в случае возникновения желтухи в первый день жизни, а при наличии гипербилирубинемии - исключение развития гемолитической болезни.
Обязателен контроль состояния младенца в течение 3 суток после выписки, особенно это касается недоношенных (до 38 недель) деток, которые были выписаны из родильного отделения до наступления 2 суток жизни.
Частота наблюдения обуславливается возрастом, при котором малыш был выписан, и присутствием факторов риска. Некоторых деток наблюдают в течение суток. Спрогнозировать риски можно, оценив уровень почасового прироста билирубина.

- Факторы развития заболевания
- Классификация и виды
- Тяжесть болезни
- По этиологическому фактору
- Перинатальная форма
- Приобретенная форма
- Клинические особенности и диагностика
- Лечебная тактика
- Профилактические меры
- Последствия и клинический прогноз
Факторы развития заболевания

Энцефалопатия у детей в 45–50% развивается при осложненных родах
В основе развития детской энцефалопатии лежит поражение тканей мозга из-за кислородной недостаточности и повышенной их чувствительности к токсинам. При кратковременной острой или длительной хронической гипоксии происходит необратимая гибель клеток, что приводит к нарушениям функции мозга различной тяжести. Спровоцировать тяжелую патологию у детей могут следующие факторы:
- ранняя или поздняя беременность матери;
- наследственная предрасположенность (тяжелое поражение ЦНС у близких родственников);
- перенесенные инфекции на любом сроке гестации;
- сложные роды, травмы ребенка во время родовспоможения;
- глубокая недоношенность.
Частым фактором появления энцефалопатии у детей являются длительное воздействие на плод тератогенных факторов (курение и алкоголизм, длительное медикаментозное лечение) и родовые травмы.
Возникновение энцефалопатии возможно в позднем детском возрасте. В таком случае спровоцировать заболевание могут различные токсические факторы, тяжелые инфекции, травмы, некоторые прививки, в частности отечественные АКДС. Зная основные причины развития энцефалопатии, можно вовремя среагировать на изменения в состоянии ребенка и начать своевременное лечение.
Классификация и виды
Учитывая, что понятие энцефалопатии собирательное и означает целую группу заболеваний головного мозга с поражением нейронов, клиницисты используют классификацию по тяжести течения, природе и характеру возникновения.

Эпилептическая энцефалопатия проявляется очень рано характерными эпизодами судорог
Тяжесть болезни
Тяжесть поражения нейронов исследуется только после рождения ребенка и делится на три стадии:
- 0–I степень – характеризуется незначительными морфологическими изменениями по результатам инструментального исследования;
- II степень – внешние признаки отсутствуют или проявляются незначительно, структурные изменения слабо выраженные;
- III степень – клинические признаки явные, преимущественно неврологического характера, структурные изменения существенные.
Стадия определяет и тяжесть патологии, при отсутствии лечения может легко переходить из одной в другую. Ранняя диагностика у новорожденного ребенка затруднена из-за отсутствия видимых нарушений в функции головного мозга. Подозревать энцефалопатию можно по характеру родов, оценке новорожденного по шкале Апгар, обвитию пуповиной.
По этиологическому фактору
Существует два основных типа заболевания, которые соответствуют механизму и течению патологии: перинатальная и приобретенная энцефалопатия.
Перинатальная форма
Перинатальная энцефалопатия – распространенная этиологическая форма патологического процесса, обозначающая внутриутробное церебральное поражение нервной системы плода по ряду причин. Понятие введено еще в 1976 году. Она развивается с III триместра беременности до 7–10-го дня жизни. Перинатальная форма диагностируется в первые месяцы жизни малыша. Выделяют следующие ее виды:
- билирубиновая – основная причина заключается в отравлении нервных клеток билирубином из-за застоя желчи;
- резидуальная энцефалопатия, когда истинную причину выяснить затруднительно, а первые симптомы проявляются намного позже, уже по мере гибели нервных клеток;
- постгипоксическая ишемическая – возникает из-за закупорки сосудов и гипоксии;
- эпилептическая – возникает при высокой судорожной активности;
- транзиторная – эпизодическое нарушение мозгового кровообращения;
- неуточненная форма – причины поражения остаются невыясненными, иногда это целый ряд различных негативных факторов.
При возникновении патологии у новорожденных повышается риск развития судорожного синдрома в позднем возрасте. Резидуальная форма болезни требует особого внимания из-за скрытого течения и начала.
Приобретенная форма
Приобретенная, или вторичная, форма возникает на фоне тяжелых травм, отравлений, хронических метаболических процессов любой природы. Приобретенная форма чаще встречается у взрослых и пожилых людей. Классифицируется на посттравматическую, сосудистую, метаболическую, токсикогенную, дисциркуляторную. Выделяют энцефалопатию Вернике – опасное состояние, которое происходит при затяжном остром течении патологии.
Все энцефалопатии вне зависимости от формы и возникновения диффузные, когда в патологический процесс вовлекаются все церебральные структуры. Приобретенная энцефалопатия может протекать в хронической или острой форме.

Резидуальная энцефалопатия сопровождается активным прогрессирующим отмиранием клеток головного мозга без явных первоначальных признаков
Клинические особенности и диагностика
Первые симптомы проявляются еще с рождения ребенка, выражаются в нарушении аппетита, сна, чрезмерной плаксивости. Нередко у таких малышей до года развивается гидроцефалия – увеличение объема головы за счет скопления ликвора. Симптомы энцефалопатии при этом состоянии всегда яркие. У детей постарше наблюдаются различные фобии, нарушения памяти, бессонница, головные боли, артериальная гипертензия. Эпилептическая форма болезни рано проявляется характерными эпилептоидными приступами, особенно на фоне повышенной температуры, лечения цефалоспоринами.
Диагностика заболевания основана на инструментальных методах исследования: МРТ, энцефалографии, компьютерной томографии. Огромное значение имеет клинический и жизненный анамнез, данные осмотра невропатолога, общеклинические исследования.
Лечебная тактика
В основе лечения детских энцефалопатий лежит устранение причин, приводящих к разрушению нейронов, а также восстановление структуры клеток. Схема консервативной терапии включает в себя следующие препараты:
- нейропротекторы на синтетической или натуральной основе - препараты предупреждают дальнейшее разрушение, снижают агрессивное воздействие повреждающих факторов;
- витамины группы B для улучшения метаболизма в нейронах, соединительной ткани и мозговых структурах;
- средства для улучшения мозгового кровообращения, насыщения клеток кислородом;
- седативные средства, транквилизаторы.
На фоне медикаментозной терапии важно контролировать то, как головной мозг реагирует на лекарственные препараты. Огромное значение в успехе лечения играет охранительный режим, регулярные прогулки на свежем воздухе, организация оптимального режима питания, сна и бодрствования ребенка. Пациентам с энцефалопатией рекомендованы регулярные курсы массажа для улучшения кровотока, физиотерапия и лечебная гимнастика.
Профилактические меры
Предупредить развитие заболевания намного проще, чем лечить уже сформировавшееся поражение ЦНС и мозга. Профилактика энцефалопатий начинается еще с беременности женщины и заключается в следующих мероприятиях:
- грамотное планирование предстоящей беременности;
- контроль над состоянием здоровья, питанием во время беременности;
- организация родового процесса, следование рекомендациям врачей во время родоразрешения.
Для предупреждения энцефалопатии и дальнейшего ее развития при манифестной форме создается адекватная психоэмоциональная атмосфера в семье, детском коллективе, снижаются стрессовые факторы. Одновременно обращают внимание на качество питания детей до года и старше, организацию образа жизни, возрастного режима сна и бодрствования.
Последствия и клинический прогноз

Симптомы заболевания без адекватного лечения постоянно усугубляются, приводя к необратимым изменениям в структуре головного мозга
Последствия могут быть ранними или поздними. Среди частых осложнений патологического процесса выделяют:
- выраженную задержку психического, умственного, двигательного и речевого развития;
- гидроцефалию в стадии компенсации;
- мигренеподобные боли;
- вегетососудистую дистонию.
Наиболее серьезными осложнениями являются детский церебральный паралич, вегетативные пароксизмы, стойкие выраженные психоэмоциональные расстройства с тенденцией к развитию шизофрении, эпилепсия, тяжелая умственная отсталость.
При ранней диагностике и длительном лечении на фоне умеренного поражения нейронов наблюдаются значительные улучшения в состоянии ребенка. Положительная динамика сомнительна при отсутствии лечения, при невозможности устранения агрессивного фактора, а также при существенном поражении клеток мозга.
Прогноз перинатальной энцефалопатии зависит от объема и распространения патологического процесса. При остром течении развиваются необратимые изменения в головном мозге, вплоть до глубокой инвалидизации и гибели больного.
Читайте также:


