Гипокинезия при болезни паркинсона
Развитию гипокинезии может также способствовать нарушение координации нейронов стриосом и матрикса в стриатуме, которое в норме обеспечивается фазическими разрядами холинергических вставочных нейронов. Разряд этих нейронов может быть сигналом для начала движения, а его отсутствие (при дефиците дофамина) — способствовать гипокинезии. Важным фактором в патогенезе гипокинезии может быть и нарушение избирательности импульсации, направляющейся избазальных ганглиев в различные области коры вследствие недостаточности их фокусирующей функции.
Выбор и содержание моторных профамм в коре у больных с паркинсонизмом, вероятно, остаются сохранными, однако нарушение взаимодействия между базальными ганглиями и премоторными зонами коры (прежде всего ДМ К) может нарушать реализацию разработанного плана — извлечение профамм из моторной памяти, инициацию движений, переключение и завершение профамм при выполнении многоэтапных автоматизированных действий, особенно имеющих сложную внутреннюю временную и пространственную организацию и выполняемых без опоры на внешние ориентиры.
Это приводит к нарушению кинетической мелодии, при этом двигательный дефект обычно нарастает с увеличением сложности задачи. Именно в момент переключения с одной профаммы на другую возможны застывания (Weiss P. et al., 1997).

Свойственная гипокинезии дезавтоматизация движений сопровождается усилением зависимости от произвольной регуляции и сенсорного контроля, главным образом зрительного, что объясняется компенсаторным вовлечением альтернативных путей регуляции движений, замыкающихся через латеральную ПреМК. Вследствие этого повышается зависимость от внешних сигналов, которые могут облегчать инициацию движений, выбор реакции, реализацию многоэтапных заданий, выработку двигательных навыков. Из-за нарушения взаимодействия моторных профамм больной не в состоянии одновременно выполнить два действия.
При различной степени их автоматизированности, в наибольшей степени страдают более автоматизированные движения, требующие меньшего участия сознания. Это согласуется с данными ПЭТ и SPECT, выявляющими при БП компенсаторное повышение активности латеральной ПреМК, теменной и затылочной коры, а также мозжечка, через которые реализуются движения, запускаемые и контролируемые внешними стимулами. Однако эффективность этой адаптивной стратегии остается неясной, так как дополнительное поражение церебелло-таламо-кортикальных путей не оказывает значительного отрицательного действия на двигательную активность больных с Bn.
Повышенная зависимость выполнения движений от зрительных ориентиров может быть связана и с дефектностью процессов переработки проприоцептивной информации, что снижает точность и увеличивает время выполнения движений.
По некоторым данным, базальные ганглии могут участвовать в сравнении эфферентных копий корковых моторных команд с проприоцептивной импульсацией, следующей от периферии и выполняющей функцию обратной связи. Это сопоставление может своевременно выявлять отклонения от правильного выполнения движения и делает возможным своевременную коррекцию активности корковых нейронов и самого движения. При паркинсонизме усиленная импульсация от базальных ганглиев может приводить к нарушению интерпретации проприоцептивной импульсации и ошибочно распознаваться регулирующими системами как результат избыточных или излишне быстрых движений, что компенсаторно приводит к замедлению или приостановке движения.
Избыточная импульсация БШв/ЧСр, направляемая в ППЯ и вызывающая торможение этого ядра, тоже может вносить вклад в развитие гипокинезии. О роли ППЯ в патогенезе паркинсонизма свидетельствует положительное влияние ее низкочастотной стимуляции на гипокинезию и застывания. На важность нисходящих паллидо(нигро)стволовых проекций в патогенезе гипокинезии указывает более высокая эффективность паллидотомии (в сравнении с таламотомией) в устранении этого синдрома. В то же время паллидотомия не позволяет устранить все симптомы паркинсонизма и даже снизить дозу леводопу — это свидетельствует о важной роли в патогенезе симптомов паркинсонизма ответвления моторного круга, следующего через ЧСр к стволовым структурам.
Гипокинезия может быть связана не только с поражением нифостриарных нейронов ЧСк и ослаблением дофаминергических влияний в стриатуме, как при БП, но и с иными механизмами:
— блокадой дофаминергических рецепторов в стриатуме (при нейролептическом паркинсонизме);
— повреждением стриарных клеток (например, при мультисистемной атрофии, акинетико-ригидной форме болезни Гентингтона или гепатолентикулярной дегенерации);
— поражением БШ (например, при прогрессирующем надъядерном параличе, прогрессирующих паллидарныхдегенерациях, болезни Галлерворде-на—Шпатца, гипоксической и некоторых токсических энцефалопатиях);
— поражением лобных долей (особенно при вовлечении ДМК и передней поясной коры), а также их связей с базальными ганглиями в белом веществе больших полушарий (например, при болезни Бинсвангера).
В этих случаях соотношение активности различных звеньев моторного круга, изменения паллидо (нигро)таламической и паллидо (нигро)стволовой афферентации могут иметь иной характер, чем при БП, что предопределяет клиническое своеобразие паркинсонического синдрома при различных заболеваниях.
Во всем мире от болезни Паркинсона (БП) страдает более 1% населения старше 65 лет. Основная причина болезни Паркинсона — гибель нигростриарных нейронов с последующим снижением количества дофамина в полосатом теле. [ 18 F]флюородопа — вещество с умеренной радиоактивностью, которое после внутривенного введения способно к связыванию с дофаминовыми рецепторами полосатого тела. У пациентов с симптомами БП при ПЭТ определяют выраженное снижение связывания [ 18 F]флюородопы с дофаминовыми рецепторами (и, соответственно, снижение числа самих рецепторов).
[Иофлупан-I-123 — это радиофармпрепарат, представляющий собой аналог кокаина, который поглощают нейроны полосатого тела. Его захват можно оценить при помощи однофотонной эмиссионной компьютерной томографии (БРЕСТ) головного мозга; подобный метод исследования помогает обследовать пациентов с подозрением на болезнь Паркинсона]. В результате у пациентов повышается активность полосатого тела, а прямой двигательный путь начинает преобладать над непрямым.
Для появления первых признаков заболевания необходима гибель около 60% нейронов верной субстанции. Задержка в развитии симптомов связана с (а) повышением продукции дофамина оставшимися нейронами; (б) повышением экспрессии дофаминовых рецепторов нейронами полосатого тела (положительная регуляция).
Для болезни Паркинсона (БП) характерны следующие симптомы/признаки: тремор, брадикинезия, ригидность и нарушение постуральных рефлексов. Однако все симптомы одновременно проявляются не у всех пациентов.
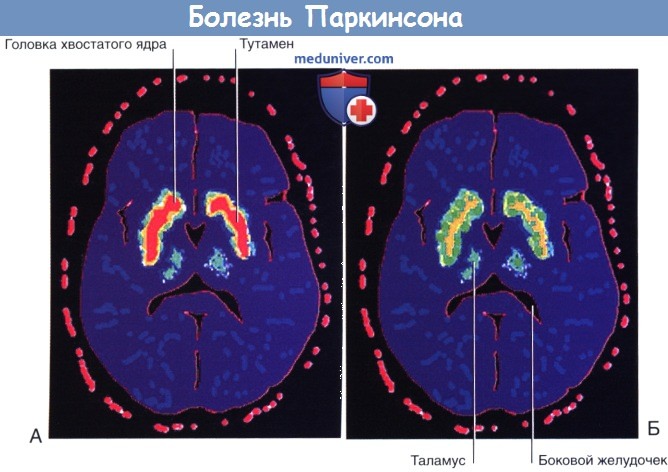
Результаты сканирования головного мозга после внутривенного введения [ 18 F]флюородопы.
Интенсивность поглощения отображена красным (максимальная), желтым, зеленым и синим (минимальная) цветами.
(А) Здоровый человек. (Б) Болезнь Паркинсона.
а) Тремор. Тремор, имеющий частоту 3—6 Гц в одной конечности, — первый симптом болезни у двух третей пациентов. Выраженность тремора не коррелирует с другими двигательными симптомами БП; также тремор не прогрессирует с той же скоростью, что и брадикинезия, ригидность или нарушения походки. Чаще всего тремор сначала появляется в одной из рук, затем в течение 1 года начинает страдать нога с этой же стороны, затем в течение еще трех лет тремор появляется на противоположной стороне. Отчетливо определяют тремор губ и языка, постоянные пронацию и супинацию предплечий, сгибание и разгибание пальцев.
Тремор связан с ритмичным возбуждением нейронов всех пяти клеточных групп прямого пути двигательной петли и нейронов переднего рога спинного мозга. Ниже будет описано, как нарушение аутогенного торможения приводит к проявлению тремора покоя и ригидности.
Небольшой тремор действия обычно можно наблюдать у пациентов с выраженным тремором покоя; как правило, он более выражен на той же стороне, где сильнее проявляется тремор покоя. Сильнее всего тремор действия проявляется в пальцах кисти при полностью вытянутых руках. Одно из его проявлений—нарушение почерка. Следует отметить, что при отсутствии тремора покоя наличие небольшого тремора действия свидетельствует о доброкачественном эссенциаль-ном треморе (см. далее).
Ранее для устранения ригидности прибегали к хирургическому пересечению задних нервных корешков. Это доказывает, что ригидность имеет периферическое чувствительное происхождение. Ригидность также можно устранить путем хирургического разрушения бледного шара или ВЛЯ таламуса. Поскольку при болезни Паркинсона не происходит усиления сгибательных рефлексов, внимание исследователей сосредоточено на афферентных волокнах сухожильного органа Гольджи, отвечающего за аутогенное торможение. Эти афферентные волокна образуют синапсы с тормозными вставочными нейронами 1b, которые активируются во время мышечного сокращения и подавляют активность мотонейронов, иннервирующих эту же мышцу и все гомонимные мышцы (т. е. нервный импульс, возникший в сухожильном органе двуглавой мышцы плеча, будет тормозить нейроны самого бицепса и плечевой мышцы).
У пациентов с болезнью Паркинсона (БП) эндогенное торможение снижено, оно замедляется до такой степени, что начинает смешиваться со стимулами, нисходящими от головного мозга, в результате чего усугубляется тремор. Нарушение торможения также способствует и развитию ригидности, поскольку при болезни Паркинсона во время движения может происходить одновременное сокращение основной мышцы и ее антагониста.
В норме волокна корково-спинномозгового и ретикуло-спинномозгового путей постоянно активируют тормозные вставочные нейроны 1b. При болезни Паркинсона активация первичной двигательной коры за счет ДМО снижена и происходит неравномерно, поэтому и появляются характерные симптомы со стороны руки и кисти. Нарушение работы ретикуло-спинномозгового пути, вероятно, сильнее влияет на состояние мышц нижних конечностей.
От нейронов скорлупы проекции отходят не только к бледному шару, но и к ГАМК-ергическим нейронам, в первую очередь, нейронам СЧЧС. Компактная часть черной субстанции также отдает волокна к сетчатой части. Последняя, в свою очередь, имеет связи с локомоторным центром ствола мозга. Один из ожидаемых вторичных эффектов повышенной активности скорлупы при болезни Паркинсона — торможение нервных импульсов, идущих от локомоторного центра к волокнам ретикуло-спинномозгового пути моста и продолговатого мозга.
Один из ранних симптомов болезни Паркинсона — сложности при письме. Отдельные буквы становятся мелкими и неровными. Нарушение письма, вероятно, связано с одновременным сокращением сгибателей и разгибателей кисти, которое возникает из-за выраженного нарушения супраспинальной активации вставочных нейронов 1а, образующих синапсы с мотонейронами мышц-антагонистов.
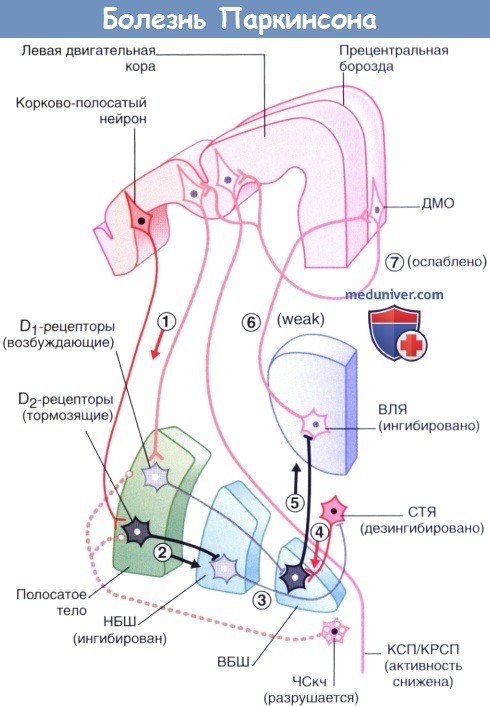
Последствия разрушения пути от компактной части черной субстанции (ЧСкч) до полосатого тела (П) при болезни Паркинсона.
Клинические проявления болезни становятся следствием нарушения тонического возбуждения шипиковых нейронов полосатого тела, экспрессирующих D1-рецепторы, а также следствием нарушения тонического ингибирования нейронов, экспрессирующих D2-рецепторы.
Целостность прямого пути нарушена, активным по умолчанию становится непрямой путь.
(1) Корково-полосатый нейрон активирует ГАМК-ергические нейроны (2) полосатого тела, которые образуют синапсы с нейронами (3) наружного сегмента бледного шара (НБШ).
В результате такого двойного эффекта происходит дезингибирование субталамического ядра (СТЯ).
Нейроны СТЯ влияют на (4) ГАМК-ергические нейроны внутреннего сегмента бледного шара (ВБШ), которые затем воздействуют на (5) вентральное латеральное ядро (ВЛЯ) таламуса, в результате чего снижается передача нервного импульса таламо-корковых волокон, (6) идущих к дополнительной моторной области (ДМО).
Сигналы (7) от ДМО к волокнам корково-спинномозгового и корково-ретикуло-спинномозгового путей (КСП/КРСП) становятся все слабее, в результате чего у пациента появляются сложности с началом движений и их выполнением.
в) Брадикинезия. Под брадикинезией понимают замедление движений. Пациенты жалуются на то, что повседневные действия, например открывание двери, начинают требовать тщательного планирования и сознательного контроля. При электромиографии мышц конечностей определяют снижение начальной электрической активности мышц-агонистов, которая в норме возникает при первом сокращении соответствующих мышц. В норме базальные ганглии начинают контролировать двигательный акт через миллисекунды после того, как премоторная кора и мозжечок подняли частоту генерации потенциала действия нейронами двигательной коры до уровня, необходимого для активации нижних мотонейронов спинного мозга. При болезни Паркинсона нервные импульсы, идущие к мотонейронам спинного мозга, становятся слабее из-за сниженного влияния ДМО.
1. Доброкачественный эссенциапьный тремор, который очень часто принимают за БП, встречают в два раза чаще БП. Сначала это заболевание проявляется лишь небольшим тремором, который лучше всего заметен при полностью вытянутых руках. Позднее появляются дрожание головы (не характерное для болезни Паркинсона) и ортостатический (проявляющийся в положении стоя) тремор туловища. Из-за тремора диафрагмы может развиться вокальный тремор. Иногда доброкачественный эссенциальный тремор называют семейным, поскольку его наследуют по аутосомно-доминантному механизму; чаще всего он проявляется на пятом десятилетии жизни. Эссенциальный тремор, наблюдаемый у пожилых, раньше называли сенильным.
Причина заболевания неизвестна. Леводопа (L-допа, см. далее) неэффективна, хотя у больных с болезнью Паркинсона она облегчает оба вида тремора.
В руководствах по клинической неврологии описаны и другие заболевания со схожей клинической картиной, например прогрессирующий надъядерный паралич и корково-базальная дегенерация.
е) Лечение болезни Паркинсона:
1. Консервативное. Наиболее эффективный метод лечения болезни Паркинсона — прием L-допы. Этот препарат проникает через гематоэнцефалический барьер и затем выжившими нейронами черной субстанции метаболизируется в дофамин. Назначение L-допы эффективно примерно у 75% пациентов, выраженность симптомов снижается на 50% и более. Спустя несколько лет приема у пациентов могут развиваться побочные эффекты терапии, в том числе спонтанные хореиформные движения, вызванные чрезмерной активацией полосатого тела. Спустя год и более, по мере прогрессирующей гибели нейронов черной субстанции, эффективность L-допы начинает снижаться. В этом случае для стимуляции постсинаптических дофаминовых рецепторов полосатого тела можно использовать агонисты дофамина (иногда их применяют в качестве терапии первой линии в надежде уменьшить выраженность или замедлить появление побочных эффектов L-допы).
Антихолинергические препараты снижают активность холинергических вставочных нейронов полосатого тела. Они способны снижать выраженность обоих видов тремора, но необходимые для этого дозы могут вызывать побочные реакции со стороны вегетативной нервной системы.
2. Хирургическое лечение болезни Паркинсона. В настоящее время оптимальным методом хирургического лечения болезни Паркинсона считают высокочастотную (133 Гц) стимуляцию СТЯ посредством имплантируемых электродов. Однако механизм(ы) действия этого способа лечения полностью не установлены. При помощи высокочастотной стимуляции удается уменьшить проявления тремора, брадикинезии и ригидности у пациентов с болезнью Паркинсона. Часто стимуляцию необходимо проводить с двух сторон. Посредством введения электродов в СТЯ можно судить о его когнитивных и поведенческих функциях. Подобные изменения, не относящиеся к двигательной сфере, наблюдают при установке электродов в вентральные отделы СТЯ.
Следовательно, в пределах СТЯ имеются различные функциональные отделы. Другой возможный участок стимуляции при болезни Паркинсона — ножкомостовое ядро. Стимуляцию ВБШ в последнее время используют редко.
К другим методам лечения, эффективность которых только определяют, относят использование черной субстанции плода в качестве трансплантата, введение в полосатое тело факторов роста, генотерапию.
Редактор: Искандер Милевски. Дата публикации: 23.11.2018

Болезнь Паркинсона (синонимы: идиопатический синдром паркинсонизма, дрожательный паралич) — медленно прогрессирующее хроническое неврологическое заболевание, характерное для лиц старшей возрастной группы. Относится к дегенеративным заболеваниям экстрапирамидной моторной системы. Вызвано прогрессирующим разрушением и гибелью нейронов, вырабатывающих нейромедиатор дофамин, — прежде всего в чёрной субстанции, а также и в других отделах центральной нервной системы. Недостаточная выработка дофамина ведет к активирующему влиянию базальных ганглиев на кору головного мозга.
Ведущими симптомами (иначе: основные или кардинальные симптомы) являются:
Современная медицина пока не может излечить заболевание или замедлить его прогрессирование (этиологическая или патогенетическая терапия), однако существующие методы консервативного и оперативного лечения позволяют значительно улучшить качество жизни больных.
Болезнь Паркинсона составляет 70—80 % случаев синдрома паркинсонизма. Она является наиболее частым нейродегенеративным заболеванием после болезни Альцгеймера. Заболевание встречается повсеместно. Его частота колеблется от 60 до 140 человек на 100 тысяч населения, число больных значительно увеличивается среди представителей старшей возрастной группы. Удельный вес людей с болезнью Паркинсона в возрастной группе старше 60 лет составляет 1 %, а старше 85 лет — от 2,6 % до 4 %. Чаще всего первые симптомы заболевания появляются в 55—60 лет. Однако в ряде случаев болезнь может развиться и в возрасте до 40 (болезнь Паркинсона с ранним началом) или до 20 лет (ювенильная форма заболевания).
Мужчины болеют несколько чаще, чем женщины . Существенных расовых различий в структуре заболеваемости не выявлено.
Этиология болезни Паркинсона на вторую половину 2011 года окончательно не выяснена. Этиологическими факторами риска считаются старение, генетическая предрасположенность, воздействие факторов окружающей среды. Патоморфологически нормальное старение сопровождается уменьшением числа нейронов чёрной субстанции и наличием в них телец Леви. Старению также сопутствуют нейрохимические изменения в стриатуме — снижение содержания дофамина и фермента тирозингидроксилазы, а также уменьшение числа дофаминовых рецепторов. С помощью позитронно-эмиссионной томографии доказано, что темпы дегенерации нейронов чёрной субстанции при болезни Паркинсона намного выше, чем при нормальном старении.
Около 15 % людей с болезнью Паркинсона имеют семейный анамнез данного заболевания. Однако гены, ответственные за развитие болезни Паркинсона, не идентифицированы.
Причинами паркинсоноподобных проявлений также могут быть воздействие факторов окружающей среды (пестициды, гербициды, соли тяжёлых металлов), хроническая цереброваскулярная недостаточность или употребление лекарств, вызывающих экстрапирамидные побочные эффекты.
Установлено, что после инъекции вещества 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП) развивается паркинсонизм. МФТП проникает через ГЭБ и под действием МАО-B окисляется до 1-метил-4-фенилпиридина (МФП+). МФП+ проникает в митохондрии и ингибирует комплекс I дыхательной цепи. Сходство химического строения МФТП и некоторых пестицидов (например, ротенон, паракват) и гербицидов (например, Агент Оранж) позволило предположить, что МФТП-подобные токсины окружающей среды способствуют развитию болезни Паркинсона. К факторам риска относят также проживание в сельской местности и близость промышленных предприятий и карьеров.
Риск развития болезни Паркинсона у курильщиков в 3 раза ниже, чем у некурильщиков. Предполагают, что это связано с дофамин-стимулирующим эффектом никотина. Кроме того, это можно объяснить наличием в дыме табака соединений, действие которых подобно ингибиторам МАО. От развития болезни Паркинсона защищает также употребление кофеина.
Окислительная гипотеза предполагает, что свободные радикалы, образующиеся при окислительном метаболизме дофамина, играют важную роль в развитии и прогрессировании болезни Паркинсона. Содержание веществ, которые могут служить донором электронов, в чёрном веществе увеличивается, что способствует образованию свободных радикалов[2]. Кроме того, при окислении дофамина под действием МАО образуется пероксид водорода. Если пероксид водорода не связывается с глутатионом, то происходит накопление весьма реактивных гидроксильных радикалов, которые вступают в реакцию с липидами клеточных мембран, вызывая перекисное окисление липидов и гибель клеток.
При болезни Паркинсона поражаются структуры экстрапирамидной системы — базальные ядра и чёрное вещество, голубое пятно и другие. Наиболее выраженные изменения отмечают в передних отделах чёрной субстанции. Характерные для болезни Паркинсона симптомы возникают при гибели 60—80 % нейронов данного анатомического образования.
Макроскопические изменения характеризуются депигментацией содержащих меланин областей чёрного вещества и голубого пятна. При микроскопическом исследовании поражённых областей выявляют уменьшение числа нервных клеток. В них определяется наличие телец Леви. Также происходит гибель астроцитов (разновидности глиальных клеток) и активация микроглии. Тельца Леви образуются вследствие скопления в цитоплазме белка ?-синуклеина. Наличие телец Леви — один из признаков болезни Паркинсона.
Тесная взаимосвязь между составляющими экстрапирамидной системы — паллидумом и стриатумом — обеспечивается многочисленными пучками нервных волокон. Благодаря связям между таламусом и стриопаллидарной системой образуются рефлекторные дуги, обеспечивающие выполнение многочисленных стереотипных и автоматизированных движений (например, ходьба, бег, плаванье, езда на велосипеде и др.). Тесная связь стриопаллидарной системы с ядрами гипоталамуса определяет её роль в механизмах эмоциональных реакций. В норме экстрапирамидная система посылает импульсы к периферическим двигательным нейронам. Эти сигналы играют важную роль в обеспечении миостатики путём готовности мышц к произвольным движениям. От деятельности данного отдела центральной нервной системы зависит способность человека принимать оптимальную для намеченного действия позу, достигается необходимое соотношение тонуса мышц-агонистов и мышц-антагонистов, а также плавность и соразмерность произвольных движений во времени и пространстве.
Открытие роли нейромедиаторов позволило объяснить функции экстрапирамидной системы, а также причины возникновения клинических проявлений болезни Паркинсона и паркинсонизма. В мозге существует несколько дофаминергических систем. Одна из них начинается в нейронах чёрной субстанции, аксоны которых через ножку мозга, внутреннюю капсулу, бледный шар доходят до полосатого тела (лат. corpus striatum). Терминальные отделы этих аксонов содержат большое количество дофамина и его производных. Дегенерация данного нигростриарного дофаминергического пути является основным причинным фактором развития болезни Паркинсона. Вторая восходящая дофаминергическая система — мезолимбический путь. Он начинается от клеток интерпедункулярного ядра среднего мозга и заканчивается в гипоталамусе и лобных долях головного мозга. Этот путь принимает участие в контроле настроения, поведении и контролирует начало двигательного акта и движений аффективной реакции (движений, которые сопровождают эмоции).
Почерк при болезни Паркинсона .

На рисунке видны рваные движения там, где предполагаются плавные линии
Гипокинезия — снижение спонтанной двигательной активности. Больной может застывать, часами сохраняя неподвижность. Характерна общая скованность. Активные движения возникают после некоторого промедления, темп их замедлен — брадикинезия. Больной ходит мелкими шагами, ступни при этом располагаются параллельно друг другу — кукольная походка. Лицо маскообразное (амимия), взгляд застывший, мигания редкие. Улыбка, гримаса плача возникают с запозданием и так же медленно исчезают.
Речь лишена выразительности, монотонна и имеет тенденцию к затуханию. В результате характерного для болезни Паркинсона уменьшения амплитуды движений почерк становится мелким — микрография.
Одним из проявлений олигокинезии (уменьшение количества движений) является отсутствие физиологических синкинезий (содружественных движений). При ходьбе руки не совершают обычных размашистых движений, они остаются прижатыми к туловищу (ахейрокинез). При взгляде вверх не отмечается наморщивания лба. Сжатие пальцев в кулак не сопровождается разгибанием кисти. Больной не может выполнять несколько целенаправленных движений одновременно. Все действия напоминают автоматические.
Вегетативные и психические расстройства.
Кроме нарушений двигательной сферы, при болезни Паркинсона отмечаются вегетативные расстройства, а также нарушения обмена веществ. Следствием может быть либо истощение (кахексия), либо ожирение. Секреторные расстройства проявляются сальностью кожных покровов, особенно лица, повышенным слюноотделением, избыточной потливостью.
Психические расстройства при болезни Паркинсона могут быть обусловлены как самим заболеванием, так и антипаркинсоническими препаратами. Начальные признаки психоза (страх, растерянность, бессонница, галлюцинаторно-параноидное состояние с нарушением ориентировки) отмечают у 20 % амбулаторных и двух третей больных с тяжёлой формой паркинсонизма. Слабоумие выражено слабее, чем при сенильной деменции. У 47 % наблюдают депрессии, у 40 % — расстройства сна и патологическую утомляемость. Больные безынициативны, вялы, а также назойливы, склонны к повторению одних и тех же вопросов.
Различают несколько клинических форм заболевания — ригидно-брадикинетическую, дрожательно-ригидную и дрожательную:
Наиболее часто применяемой в медицине является классификация стадий паркинсонизма по Хён и Яру. Впервые она была опубликована в 1967 году в журнале Neurology Маргарет Хён (англ. Hoehn) и Мелвином Яром (англ. Yahr). Изначально она описывала 5 стадий прогрессирования болезни Паркинсона (1 — 5). Впоследствии шкалу модифицировали, дополнив её стадиями 0, 1,5 и 2,5.
- Стадия 0 — нет признаков заболевания.
- Стадия 1 — симптомы проявляются на одной из конечностей.
- Стадия 1,5 — симптоматика проявляется на одной из конечностей и туловище.
- Стадия 2 — двусторонние проявления без постуральной неустойчивости.
- Стадия 2,5 — двусторонние проявления с постуральной неустойчивостью. Больной способен преодолевать инерцию движения, вызванную толчком.
- Стадия 3 — двусторонние проявления. Постуральная неустойчивость. Больной способен к самообслуживанию.
- Стадия 4 — обездвиженность, потребность в посторонней помощи. При этом больной способен ходить и/или стоять без поддержки.
- Стадия 5 — больной прикован к креслу или кровати. Тяжёлая инвалидизация.

Консервативное лечение.
В настоящее время болезнь Паркинсона является неизлечимой, все существующие методы лечения направлены на облегчение её симптомов (симптоматическое лечение).
Основные препараты, устраняющие двигательные нарушения: леводопа (чаще в комбинации с периферическими ингибиторами ДОФА-декарбоксилазы или реже с ингибиторами КОМТ), агонисты дофаминовых рецепторов[en] и ингибиторы МАО-Б.
Дофаминергические препараты.
Диоксифенилаланин (сокращённо допа, или дофа) — биогенное вещество, которое образуется в организме из тирозина и является предшественником дофамина, в свою очередь являющегося предшественником норадреналина. В связи с тем, что при болезни Паркинсона содержание дофамина в головном мозге значительно снижено, для лечения заболевания целесообразно применение веществ, повышающих его содержание в ЦНС. Сам дофамин не может быть использован для этой цели, так как он плохо проникает через гемато-энцефалический барьер.
Леводопа.
В качестве лекарственного препарата широко применяют синтетический левовращающий изомер диоксифенилаланина (сокращённо L-дофа), который значительно активнее правовращающего. Леводопа хорошо всасывается при приёме внутрь. Бо?льшая часть препарата попадает в печень и превращается в дофамин, который не проникает через гемато-энцефалический барьер. Для уменьшения декарбоксилирования препарат рекомендуют применять с ингибиторами дофа-декарбоксилазы (бенсеразидом, карбидопой).
Препарат эффективен при болезни Паркинсона и паркинсонизме. Он уменьшает гипокинезию и ригидность. При треморе, дисфагии и слюнотечении лечебный эффект достигается у 50—60 %.
Препарат можно назначать с центральными холиноблокаторами и не следует применять с необратимыми ингибиторами моноаминоксидазы (МАО).
При применении возможны побочные эффекты: диспепсические явления (тошнота, рвота, потеря аппетита), гипотензия, аритмии, гиперкинезы и др.
У пациентов младше 60—70 лет назначение леводопы из-за развития побочных явлений и снижения эффективности при длительной терапии стараются отложить и применяют другие лекарственные средства. Лечение пациентов старше 70 лет даже в начальных стадиях рекомендуют начинать с леводопы, что объясняют меньшей эффективностью препаратов других групп и более частыми соматическими и психическими побочными эффектами в этом возрасте.
Агонисты дофамина.
В качестве основного лечения также используются агонисты дофаминовых рецепторов (бромокриптин, перголид, прамипексол, ропинирол, каберголин, апоморфин, лизурид). Препараты данной группы являются специфическими центральными агонистами дофаминовых рецепторов. Имитируя действие дофамина, они вызывают те же фармакологические эффекты, что и леводопа.
По сравнению с леводопой они реже вызывают дискинезии и другие двигательные расстройства, но чаще оказывают иные побочные эффекты: отёки, сонливость, запоры, головокружение, галлюцинации, тошноту. Ингибиторы МАО типа Б и катехол-О-метилтрансферазы.
Данная группа препаратов избирательно подавляет активность ферментов, которые расщепляют дофамин: моноаминоксидаза (МАО типа Б) и катехол-О-метилтрансфераза (КОМТ). ингибиторы МАО-Б (например, селегилин, разагилин] и ингибиторы КОМТ (например, энтакапон и толкапон) замедляют неуклонное прогрессирование болезни Паркинсона. Фармакологические эффекты аналогичны леводопе, хотя их выраженность значительно меньше. Они позволяют усилить эффекты леводопы, не повышая и даже снижая её суммарную дозу.
Ингибиторы обратного нейронального захвата дофамина
Непрямые дофаминомиметики (амантадин, глудантан) повышают чувствительность рецепторов к соответствующему медиатору. Данные препараты усиливают выделение дофамина из пресинаптических окончаний и тормозят его обратный нейрональный захват. Лекарственные средства данной группы вызывают те же фармакологические эффекты, что и леводопа, то есть они преимущественно подавляют гипокинезию и мышечную ригидность, значительно меньше влияя на тремор.
Центральные холиноблокаторы
Тригексифенидил — основной препарат группы центральных холиноблокаторов, применяемых для лечения болезни Паркинсона
Применяемые ранее препараты белладонны действуют преимущественно на периферические ацетилхолиновые рецепторы и меньше — на холинорецепторы мозга. В связи с этим терапевтическое действие данных препаратов относительно невелико. Вместе с этим они вызывают ряд побочных явлений: сухость во рту, нарушение аккомодации, задержку мочи, общую слабость, головокружение и др. Современные синтетические противопаркинсонические центральные холиноблокаторы характеризуются более избирательным действием. Они широко применяются при лечении экстрапирамидных заболеваний, а также неврологических осложнений, вызываемых нейролептиками. Отличительным свойством центральных холиноблокаторов является то, что они в большей степени воздействуют на тремор; в меньшей мере влияют на ригидность и брадикинезию. В связи с периферическим действием уменьшается слюнотечение, в меньшей степени потоотделение и сальность кожи.
Хирургические методы лечения можно разделить на два типа : деструктивные операции и стимуляцию глубинных мозговых структур.
Деструктивные операции
К деструктивным операциям, применяемым при болезни Паркинсона, относятся таломо- и паллидотомия.
Таламотомия показана лишь в тех случаях, когда основным симптомом заболевания является тремор. Для получения положительного результата от операции больные должны соответствовать нескольким критериям: болезнь Паркинсона проявляется односторонним тремором, консервативное лечение неэффективно. Показано, что разрушение вентрального промежуточного ядра таламуса (лат. nucleus ventralis intramedius) приводит к снижению тремора у больных паркинсонизмом. Согласно литературным данным, эффективность операции по устранению тремора при болезни Паркинсона достигает 96 %. При этом те же авторы отмечают высокий риск осложнений (до 1/6 - стойких и примерно 1/2 - преходящих).
К осложнениям, возникающим после таламотомии, относят дизартрию, абулию, дисфазию, диспраксию.
Паллидотомия может быть показана больным с преобладанием двигательных расстройств, для которых консервативное лечение неэффективно. Процедура заключается во введении иглы в бледный шар (лат. globus pallidus) с последующим его частичным разрушением.
Паллидотомия является относительно безопасной процедурой. При анализе 85 статей, посвящённых паллидотомии, и соответственно результатов лечения 1510 больных выделены такие осложнения данной операции: Эффективность паллидотомии при болезни Паркинсона достаточно высока. Гипокинезия в противоположных стороне операции конечностях снижается в 82 % случаев.

С развитием радиохирургии появилась новая возможность производить разрушение соответствующих нервных структур без травматизации окружающих структур и тканей.
Для получения информации о записи на прием к специалистам просим обращаться по телефонам:
8 499 324-93-39; 8 499 324-44-97, +7 906 749-98-00
или по электронной почте Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript. / Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Читайте также:


