Лечение паркинсонизма при шизофрении
Депрессия и тревога характеризуются противоположной динамикой функционирования arousal-системы с повышением его уровня при тревоге и ажитированных формах депрессий и снижением — при астенических депрессивных состояниях.
Таким образом, несмотря на известную клинико-патогенетическую неоднородность, паркинсонические и депрессивные синдромы имеют и целый ряд общих черт, касающихся особенностей психомоторного поведения, с одной стороны, и состояния интегративных функций мозга — с другой. В основе указанной клинико-патогенетической общности этих синдромов лежит биохимический дефект в катехоламиновом ряду дофамин—норарденалин с вторичным нарушением и в других звеньях медиаторно-гормональной системы организма.
Из вышеизложенного видно, что успехи паркинсонологии последних лет в немалой степени способствовали привлечению внимания исследователей к изучению биохимической природы депрессивных состояний и в меньшей степени — к исследованию психофизиологических механизмов, лежащих в их основе. Дальнейшие перспективы в разработке вопросов патогенеза паркинсонизма и депрессивных синдромов будут зависеть не только от совершенствования существующих методических подходов, но и от интеграции нейрофизиологических, биохимических и психофизиологических исследований.

За последние годы получены новые клинические и экспериментальные факты, позволяющие обсуждать участие дофаминергических систем мозга в патогенезе шизофренического процесса.
В связи с этими наблюдениями было высказано предположение, согласно которому возникновение лекарственного паркинсонизма считалось необходимым условием антипсихотического эффекта найролептиков. По-видимому, одним из наиболее характерных клинических эффектов нейролептиков является их способность ослаблять или полностью устранять бред и галлюцинации у больных психозами и в то же время вызывать лекарственный паркинсонизм. Указанные клинические закономерности во взаимоотношениях между шизофренией и паркинсонизмом в последние годы превратились в объект интенсивных клинических, патоморфологических, биохимических и психофизиологических исследований.
Так, у 60% больных паркинсонизмом, которые получали 1-дофа в течение 6 лет, отмечена тенденция к учащению состояний ажитированной спутанности. Отмена 1-дофа приводила к купированию этих нарушений.
Подобные клинические наблюдения отражают, по-видимому, определенную взаимосвязь между дофаминергической гиперактивностью и некоторыми психопатологическими состояниями. Применение 1-дофа или других препаратов, стимулирующих дофаминергические рецепторы, больным шизофренией может служить причиной экзацербации психотической симптоматики. Кроме того, известно, что амфетамин и (реже) 1-дофа могут индуцировать психоз у здоровых лиц, ранее не имевших психопатологических нарушений. В экспериментах на животных амфетамин вызывает нарушения поведения в виде стереотипии и компульсивных автоматизмов, которые исчезают после введения фенотиазинов.

Первоначальное описание болезни Джеймса Паркинсона, которая теперь носит его имя, было сфокусировано на моторных признаках ( двигательных нарушениях ) . Тем не менее, 200 лет с тех пор, как это описание впервые появилось, показали, что другая симптоматика также важна при болезни Паркинсона (PD).
Первым этапом лечения психоза при болезни Паркинсона является диагностика. Сначала нужно исключить другие причины психоза. Соответствующая история ( анамнез ) болезни обычно может довольно легко исключить шизофрению и психотические расстройства настроения ( биполярное аффективное расстройство). Распространенные причины делирия ( помрачение сознания ) включают инфекции, недавно добавленные лекарства и нарушения электролитного обмена , но диагноз ставится по клиническому синдрому; нельзя всегда определить конкретную единственную причину. Анамнеза, психического статуса и физического осмотра часто достаточно для диагностики делирия, дополняемых по мере необходимости лабораторными исследованиями . Как только -психоз при болезни Паркинсона диагностирован, следующим шагом является сокращение списка противопаркинсонических препаратов. Обычно их удаляют в следующей последовательности: антихолинергические средства, амантадин, а затем агонисты дофамина. Некоторые врачи также прекращают прием ингибиторов моноаминоксидазы и ингибиторов катехол- О- метилтрансферазы (СОМТ). . Симптомы Паркинсона часто усиливаются в результате этих изменений лекарств, требующих увеличения дозировки леводопы. Если после сокращения препаратов для антипаркинсонического лечения психоз сохраняется, дозу леводопы можно уменьшить, если это возможно, но часто пациенты уже находятся на минимальной дозе, приемлемой для реализации двигательной функции. На этом этапе добавление лекарства для лечения психоза обычно необходимо. Конечно, как и во всех решениях в медицине, необходимо взвесить риски и выгоды.
В 1999 году два исследования независимо показали, что клозапин превосходит плацебо при психозе , развившимся на фоне болезни Паркинсона. В одних исследованиях сообщалось о незначительном ухудшении паркинсонизма с клозапином, но в других - обнаружилось улучшение двигательных навыков. Одно исследование даже предположило, что клозапин может снизить смертность. Однако наряду с различными побочными эффектами, связанными с дозой, клозапин несет риск тяжелой нейтропении примерно у 0,3–1,0% пациентов, независимо от дозы. Этот риск снижается за счет еженедельных и ежемесячных анализов крови, но для многих пациентов затруднена частая венепункция и координация действий врача, лаборатории и аптеки. В этой группе больных клозапин обычно начинается в 6.25 перед сном. Мониторинг количества нейтрофилов должен выполняться в соответствии с принятыми рекомендациями. Конечная общая суточная доза клозапина при психозе на фоне PD обычно колеблется от 12,5 до 100 мг.
Недавно пимавансерин - обратный агонист рецептора серотонина 2А, был одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения психоза при болезни Паркинсона ( пимавансерин в дозе 34 мг ежедневно уменьшал психотические симптомы значительно больше, чем плацебо ). Снижение психотических симптомов было очевидным через 2 недели, но отделено от плацебо только на 4-недельном контрольном визите с дальнейшим улучшением через 6 недель. Поэтому для разумного испытания пимавансерина требуется 4–6 недель при полной дозе. Важно отметить, что пимавансерин не ухудшал двигательную функцию.
Форум больных и не больных F20 шизофренией, МДП (БАР), ОКР и другими психиатрическими диагнозами. Группы взаимопомощи. Психотерапия и социальная реабилитация. Как жить после психушки
Нейролептики → Синдром Паркинсона → Деменция
![]()
Механизм лекарства от паркинсона.
Паркинсонисты так же лечатся и циклодолом от паркинсона.
Особенно выраженные симптомы деменции при синдроме Паркинсона.
Нейролептики вызывают синдром Паркинсона своим механизмом
Синдром Паркинсона имеет 40-80% развития деменции
И не важно каким образом ты прикрыл синдром Паркинсона, пусть хоть циклодолом.
![]()
![]()
Получение практически полной идентичности паркинсонизма с помощью дофаминоблокаторов ведёт к тем же результатам спустя лет десять, ведь это очевидно.
Галоперидол десять лет это считай паркинсонизм десять лет.
И очевидно, что деменция у них развивается из-за особенностей работы мозга.
Ты получаешь такую же работу мозга, и, следовательно, все последствия.
![]()
![]()
![]()
Просто приём блокаторов дофаминовых рецепторов это смена шизофрении на паркинсон. Особенно, если принимаются корректоры, то ты прямо уже как все паркинсонисты принимаешь холинолитики. Тут я привожу пример, что раз препараты от шизофрении развивают состояние паркинсонизма, то и последствия могут быть такие же как уже при этой болезни.
Паркинсонисты тоже могут свою болезнь почти не замечать принимая холинолитики. Так что отсутствие проявлений ни о чём не говорит, статистика по деменции у них 40-80%.
![]()
![]()
No_Game_No_Life писал(а): Просто приём блокаторов дофаминовых рецепторов это смена шизофрении на паркинсон. Особенно, если принимаются корректоры, то ты прямо уже как все паркинсонисты принимаешь холинолитики. Тут я привожу пример, что раз препараты от шизофрении развивают состояние паркинсонизма, то и последствия могут быть такие же как уже при этой болезни.
Паркинсонисты тоже могут свою болезнь почти не замечать принимая холинолитики. Так что отсутствие проявлений ни о чём не говорит, статистика по деменции у них 40-80%.
![]()
![]()
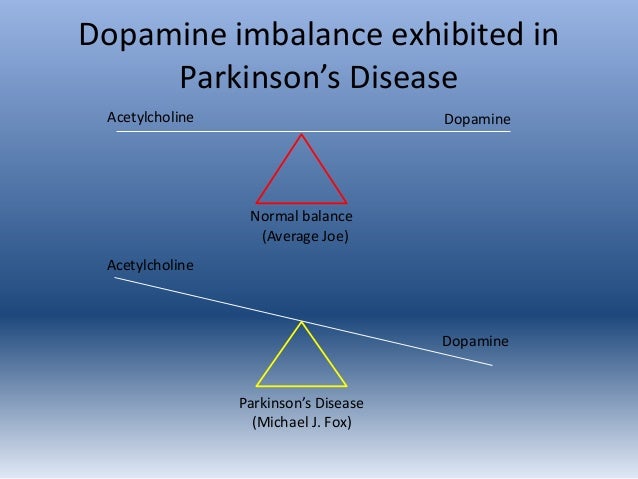
Механизм работы мозга одинаковый. Паркинсонические симптомы вытекают из изменения работы мозга прямо в точности как у человека с паркинсоном. Скажем, посмотрите на картинку выше: при паркинсонизме активность дофамина низкая, активность ацетилхолина высокая. При блокаде дофаминовых рецепторов возникает такая же ситуация: дофамин идёт вниз, ацетилхолин вверх. Мозг работает практически одинаково.
![]()
При определённой дозе галоперидола человек так же будет лежать без движения как человек с крайней стадией паркинсона. Просто для симуляции такой большой гибели дофаминергических нейронов нужна супер большая доза галоперидола.
Так вот, мозг у человека под галоперидола и паркинсониста работает одинаково.
Дисбаланс в мозге наступает одинаковый.
Тем самым в связи с дисбалансом в мозге я подозреваю развитие точно такой же деменции.
Деменция это не просто "плохая память", это спектр симптомов:
Дофамин. Нервные клетки, которые передают импульсы с помощью дофамина, сосредоточены преимущественно в трёх областях: в гипоталамусе, в чёрной субстанции и в вентральной покрышке. Нейромедиатором он работает только тут.
Итак, гипоталамус. Те нервные клетки, которые пользуются дофамином, чтобы общаться между собой, в этой области довольно замкнуты друг на друга: далеко свои аксоны не тянут, предпочитают свой тесный внутренний круг. Но при этом рулят довольно важными системными функциями: могут отдать команду на выработку ряда гормонов или тормознуть её, могут также, к примеру, понизить мотивацию на предмет чего-нибудь пожрать, могут усилить агрессивность или повысить либидо. Раз — и вектор человеческого поведения заметно поменялся.
Ну с гипоталамусом учёным ещё долго разбираться, там уж очень тесно и сложно намешано нервного и гормонального, а вот в чёрном веществе и в вентральной покрышке дофаминовые нервные клетки изучены подробнее. Не в последнюю очередь из-за паркинсонизма, шизофрении и наркотиков.
Если дофамина в чёрном веществе дофига, и чёрная субстанция активна, то такие люди — как правило, живчики. То есть, с удовольствием двигаются, танцуют, занимаются спортом и вообще получают кайф от движения. Те, кто победнее дофамином в своей чёрной субстанции — внешне кажутся более ленивыми, зато умеют получать удовольствие от чего-то иного: еды, например, новизны как таковой, созерцания.
Отростки нервных клеток из этой чёрной субстанции не только между собой соединены: в отличие от тех, что в гипоталамуса, у них более длинные лапки. И много таких отростков идут вверх, к большим полушариям головного мозга. И в частности — к скоплениям нервных клеток, которые названы базальными ганглиями. 80% этих ганглиев отвечают за движения.
На оставшиеся 20% идут отростки от другого образования —вентральной покрышки - на них-то как раз во многом завязана система, которая отвечает за формирование потребностей и мотиваций, которая тесно связана с эмоциями.
Соответственно, и нарушение работы в этой связке тоже не проходит для человека бесследно. Если в силу ряда (в том числе генетических) причин покрышка работает слабо — человек недополучает положительные эмоции от новизны. И в ряде случаев это оказывается стержнем будущей депрессии. Если дофамина в покрышке слишком много — получите скачку идей и неспособность долго сосредоточиться на одной мысли, как при выраженной мании. В отдельных же случаях система срабатывает вхолостую: вроде бы и нет входящего стимула, а отклик в покрышке почему-то возник.
Среди тех базальных ганглиев, к которым идут отростки от покрышки, есть такое образование — прилежащее ядро, или nucleus accumbens - центр, генерирующий положительные эмоции.
Именно на связь покрышки с прилежащим ядром и действуют наркотики амфетамин и кокаин, разгоняя, усиливая действие дофамина в ней. Именно это действие и даёт тот фейерверк положительных эмоций, тот прилив бодрости и сил, а также ощущение предельной собранности и кристальной ясности мышления вкупе с его быстротой.
![]()
Уж если в заголовок вынес болезнь Паркинсона, то как-то надо поподробнее про неё. И не понятно за каким ты в конце наркоту приплел ко всему. Начал за здравие, а кончил за упокой
Наркота, типа феназепама, вызывает синдром паркинсонизма
Внутри шизофрении. Часть 1.
Заболевание, которое можно счесть за шизофрению, было известно с древних времен, возможно, даже доисторических. Отчетливые упоминания есть в Библии (помните, как царь Навухудоносор кушал траву с луга?), ими сквозит Античность и так далее. Однако утверждать на 100% ничего невозможно: существуют психозы и помимо шизофрении, а также есть, например, паразиты, поражающие нервную систему и способные вызвать галлюцинации. К тому же, не надо забывать о сифилисе, который с человеком живет уж точно не меньше, чем шизофрения.

В историю шизофрении я не собираюсь сильно вдаваться, поскольку об этом много сказано. Все написанное выше я упоминаю только с одной целью: чтобы показать, насколько сложный и ускользающий смысл вкладывается в этот термин.
Здесь нужно сделать небольшую оговорку: нам с вами, с раннего детства давящимися плодами науки, которые созревали в течение столетий, люди прошлого могут казаться очень недалекими. Ну как тут было не отличить, скажем, расстройства настроения и психозы? Ну вот больного глючит, как скотину, а вот он просто грустный сидит. Очевидно же, что это разные заболевания! На самом деле, нет. Главная боль всей медицины состоит в том, что одна болезнь в большинстве случаев не мешает развиваться другой. И расстройства настроения (аффективные расстройства) не только не мешают психозам, а зачастую сочетаются.
(Вот и сам Крепелин):

Надо сказать, что в те годы содержимое черепа было настоящим черным ящиком для науки. Оно и сейчас в значительной мере остается черным ящиком, но тогда мы даже представить не могли, КАКАЯ херня там творится. Все эти нервные связи, нейромедиаторы, нейронные сети, колонки, контуры… Едва ли хоть кто-то догадывался, что все может быть устроено так странно. Сама идея о том, что электрическая активность мозга большей частью опосредуется химическими веществами – дикость какая-то. Поэтому все, что оставалось психиатрам тех лет – наблюдать и накапливать знания, надеясь на психиатров будущего.
Для того, чтобы хоть немного приоткрыть завесу тайны над заболеванием, нужны были очень крупные открытия в нейробиологии и нейрофизиологии, которые в те времена были невозможны просто технологически. Первый толчкок, который помог предположить истинные причины шизофрении, был со стороны фармакологии. Это открытие аминазина. Цитата с одного ресурса:
В 1950 году французский нейрохирург Генри Лабори предположил, что чрезмерные переживания его пациентов перед операцией вызывают выброс избыточного количества гистамина. Гистамин — небольшая молекула, которая регулирует сотни процессов в организме: от выделения желудочного сока до температуры. Лабори считал, что именно чрезмерный выброс гистамина из-за тревоги пациентов может вызывать осложнения анестезии и даже внезапную смерть.
Лабори методом проб и ошибок пытался подобрать подходящий антигистаминный препарат. Совершенно случайно он обнаружил, что не самое популярное лекарство — хлорпромазин — действительно успокаивает пациентов. Более того, хлорпромазин усиливал действие анестезии.
Предположение довольно типичное для тех времен, хотя и неверное. Тем не менее, ошибочное предположение привело к великому открытию – открытию первого на свете нейролептика. А сочетание нейролептиков с анестетиками используется до сих пор (нейролептанальгезия). Нейролептики (они же антипсихотики) – препараты, (относительно) избирательно действующие на симптомы психоза – бред и галлюцинации. Это открытие, в конечном счете, и помогло составить современные представления о причинах и патогенезе (т.е развитии болезни) шизофрении. Последовавшие исследования позволили открыть различные рецепторы в головном мозге, в том числе рецептора домафина. Именно тогда и оказалось, что основным эффектом нейролептиков является блокада эффектов дофамина, а дальше все заверте…
Вот мы и подошли к тому, чтобы описать сегодняшние представления о патогенезе шизофрении. Только представьте, какую дикую работу пришлось проделать, чтобы подойти к примерному представлению о том, как развивается эта психическая болезнь. Я буду идти в своем рассказе по такому принципу: от самых элементарных представлений на уровне молекул и клеток до нарушений в работе мозга в целом, а затем до нарушений психики.

Возможно, у вас уже возник вопрос: а почему тогда не использовать методы типа позитронно-эмисионной томографии или ф-МРТ и не выявить, какие отделы мозга работают неправильно? Да, заманчивая идея, и это, конечно же, пытались сделать, и даже есть результаты. Однако результаты эти породили больше вопросов, чем ответов. Действительно, удалось найти нарушения в работе мозга при шизофрении на ПЭТ и ф-МРТ, и касаются они преимущественно работы височных и лобных долей мозга, а также лимбической системы и их взаимодействия. Однако они встречаются не только при шизофрении, и не у всех шизофреников идентичны, чтобы можно было вбить в программу шаблон, который бы автоматически определял подобные изменения. Идея не нова, и в свое время изучали шизофрению с помощью рентгена, эхоэнцефалографии/скопии и других методик, однако результат всегда был похожим: да, что-то есть, но данных, однозначно указывающих на шизофрению, нет.

Как видно, даже здесь шизофрения дает прикурить. Очень мозаичное и скользкое заболевание, не дающее нам никакой нити, за которую можно было бы уцепиться и распустить весь клубок. Таким же оно предстает перед психиатрами – королева масок.
Как нетрудно догадаться, эти анатомические изменения порождают нейрохимические изменения, и тут, боюсь, придется вкратце напомнить основы нейрохимии мозга.
В нашем мозге постоянно осуществляется напряженная работа, которая проявляется в передаче электрических импульсов между нейронами. Соединение между двумя нейронами осуществляется с помощью специальной структуры – синапса. Примерно так он выглядит:
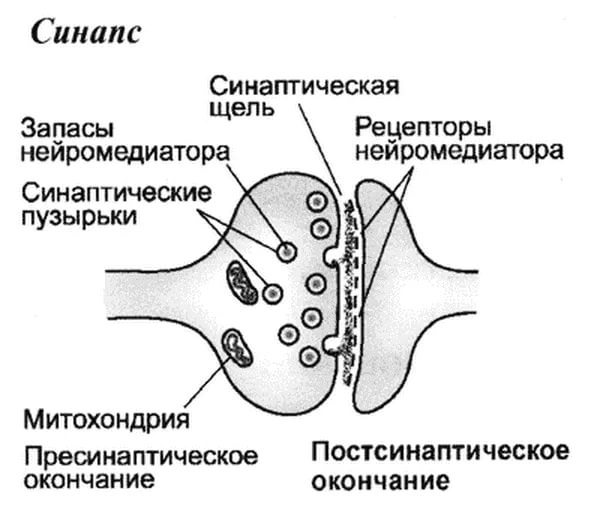

Доктор биологических наук, профессор кафедры физиологии человека и животных биологического факультета МГУ, Вячеслав Дубынин рассказывает о болезни Паркинсона, связи дофамина с шизофренией и истории нейролептиков.
Одним из важнейших медиаторов центральной нервной системы является вещество, называющееся дофамин. Дофамин известен достаточно давно, где-то с середины XX века. Это соединение, специфично связанное с мозгом, прежде всего с головным, в отличие, например, от ацетилхолина, норадреналина, которые активны в периферической нервной системе.
Дофамин образуется в наших нейронах в результате довольно несложной цепочки химических реакций. Начинается она с аминокислоты, которая называется тирозин, и дальше тирозин превращается в молекулу, называемую L-ДОФА, а уже L-ДОФА становится дофамином. То есть получается цепочка из двух реакций, причем L-ДОФА в данной цепочке является предшественником дофамина, что дальше определяет использование молекулы L-ДОФА как лекарственного препарата, но об этом чуть позже.
Дофамин действительно очень важен для центральной нервной системы, и если мы начинаем анализировать строение мозга, то обнаруживаем дофаминовые нейроны в основном в трех зонах: это гипоталамус и две области среднего мозга, одна называется черная субстанция, а вторая — вентральная покрышка. Если мы смотрим на гипоталамус, то видим, что у дофаминовых нейронов гипоталамуса довольно короткие отростки-аксоны. Они в основном занимаются внутригипоталамическими проблемами и воздействуют на выброс некоторых гормонов или на центры некоторых потребностей, немного участвуют в вегетативной регуляции, но в общем это довольно локальные функции, хотя, конечно, важные. Например, в гипоталамусе дофамин может понижать пищевую мотивацию, повышать агрессивность или усиливать либидо, то есть это локальные, но важные моменты.
Наиболее известны те дофаминовые нейроны, которые находятся как раз в черной субстанции и вентральной покрышке. Черная субстанция потому так и названа, что эта зона мозга имеет темную окраску: нейроны там содержат некоторое количество меланина — темного пигмента. Аксоны этих клеток идут вверх, в большие полушария, и в основном они заканчиваются в базальных ганглиях. Данный блок дофаминовой системы связан с регуляцией двигательной активности: от того, насколько много дофамина выделяет черная субстанция, во многом зависит, насколько человек физически активен, моторен, любит двигаться, охотно двигается. Люди с активной черной субстанцией с удовольствием занимаются спортом, танцуют и вообще перемещаются в пространстве. Люди, у которых черная субстанция не очень активна (а это в основном зависит от генов), соответственно, двигательно более ленивы и не получают столько удовольствия от физических упражнений, но они получают удовольствие от чего-то другого: от еды или новизны — во всяком случае, окружающие их порой воспринимают как лентяев.
Если мы смотрим, куда конкретно приходят аксоны черной субстанции в больших полушариях, то это зона, называемая базальные ганглии. Это очень непростая область, находящаяся в глубине больших полушарий. Когда мы говорим о больших полушариях, мы прежде всего вспоминаем кору, зону, которая находится на поверхности полушарий и содержит огромное количество нервных клеток с самыми разными функциями. Но в глубине больших полушарий есть крупные скопления нейронов, которые в свое время и были названы базальными ганглиями. И там расположена масса анатомических структур: полосатое тело, бледный шар, скорлупа, ограда. У всех них сложные латинские названия, но если в целом смотреть на базальные ганглии, то видно, что где-то 80% нейронов в этой группе структур занимаются движениями. Именно на активность этих нейронов и влияет черная субстанция. Остальные 20% базальных ганглий входят в другую систему, связанную с потребностями, мотивациями, эмоциями, и об этом блоке я еще скажу.
Вторая область — вентральная покрышка. Аксоны этой зоны идут в кору больших полушарий и в ту часть базальных ганглий, которая занимается как раз потребностями, мотивациями и эмоциями. Дофамин, вырабатывающийся нейронами вентральной покрышки, в коре больших полушарий, во многом определяет скорость обработки информации и, если угодно, скорость нашего мышления. Если много дофамина в этой системе и вентральная покрышка будет достаточно активна, то мы видим, что информационные процессы идут быстро, у человека быстрый мозг. Такие люди могут очень успешно заниматься математикой, программированием и вообще профессиями, связанными с абстрактным мышлением.
Кроме того, этот же блок дает нам положительные эмоции, связанные с новизной. Это очень важная составляющая нашей психической жизни, потому что наш мозг очень любопытен и получение новой информации биологически очень важно: мы должны знать, что меняется в окружающем мире, оперативно эти изменения детектировать и анализировать. Кроме того, нас это радует, и для человека, занимающегося наукой или искусством, это важнейшая составляющая психической жизни, потому что что-то сочинить или открыть — это просто замечательно. Получается, что дофамин связан с положительными эмоциями, которые коррелируют с новизной, творчеством, юмором, потому что шутка — это тоже некая рассказанная ситуация, в которой был банальный выход, а вам предложили что-то необычное, какую-то небанальную соль анекдота, и вы смеетесь — это тоже выделение дофамина.
К сожалению, эта система тоже может работать не очень правильно. Если она работает слабо по каким-то причинам (в основном генетическим), то человек недобирает положительных эмоций, связанных с новизной, и это может быть одним из компонентов депрессии. Если эта система работает слишком сильно, то мышление может стать избыточно быстрым, дерганным, человек не может сосредоточиться и долго думать одну и ту же мысль. Порой сенсорные системы начинают генерировать сигналы в тот момент, когда нет никаких реальных раздражителей. В пределе это выливается в симптоматику, которая называется шизофренией. К сожалению, шизофрения является весьма распространенным заболеванием: от 0,5 до 1% населения страдают этим заболеванием. В этом случае нужны препараты, ослабляющие активность дофаминовой системы. Такие препараты существуют, они относятся к группе нейролептиков и являются блокаторами дофаминовых рецепторов.
Рекомендуем по этой теме:
Молекулярные системы действия психотропных средств
У дофамина довольно много рецепторов, выделено пять основных типов. Если смотреть на разные отделы мозга, мы прежде всего обнаруживаем рецепторы D-2, тормозящие различные нервные процессы. И довольно много рецепторов D-1, то есть дофаминовых рецепторов первого типа, которые активируют различные нервные процессы. В некоторых нейросетях рецепторы D-1 и D-2 вставлены как конкурирующие блоки, рецепторы D-2 ограничивают активность D-1. Это очень хорошо наблюдается в базальных ганглиях. Если мы начинаем использовать антагонистов дофаминовых рецепторов, то степень выраженности их эффектов зависит от того, на какие рецепторы мы попадаем.
История нейролептиков начинается с вещества, которое называется аминазин. Аминазин — грубый нейролептик, воздействующий не только на все типы дофаминовых рецепторов, но и на рецепторы норадреналина. Тем не менее аминазин в истории психиатрии стал важнейшим препаратом, с помощью которого впервые удалось на фармакологическом уровне купировать и тяжелую шизофрению, и тяжелые маниакальные расстройства. В 1960-е годы стали создавать более избирательно действующие препараты, в основном блокирующие активность рецепторов D-2. Современные нейролептики являются именно блокаторами рецепторов D-2 разной степени эффективности, потому что более востребованы препараты более мягкого действия. К счастью, легкая шизофрения встречается чаще, чем тяжелая, даже с точки зрения фармакологического рынка гораздо важнее производить легкие нейролептики: они имеют гораздо более широкую сферу распространения.
Основной мишенью действия нейролептических препаратов оказывается кора больших полушарий и та часть базальных ганглиев, которая связана с эмоциями, потребностями, мотивацией. В базальных ганглиях есть две структуры: одна называется миндалина (она находится в глубине височных долей), а вторая структура — nucleus accumbens (переводится как ‘прилежащее ядро прозрачной перегородки’). Эти две структуры являются важнейшими мишенями для нейролептиков, а nucleus accumbens очень активно изучается как ключевой центр, связанный с генерацией положительных эмоций. У нас большинство информационных потоков, связанных с тем, что наш организм успешно выполнил какую-то деятельность: поел или избежал опасности, узнал что-то новое или успешно размножился, — идут через nucleus accumbens, и дальше сигналы от этой структуры, поднимаясь в кору больших полушарий, определяют процессы обучения и формирования памяти. Поэтому эта зона очень активно изучается, и дофамин там важнейший медиатор.
Если используются агонисты дофаминовых рецепторов, то можно получить активацию и процессов мышления, и центров положительных эмоций, в том числе nucleus accumbens. Известны подобного рода препараты, они относятся к группе психомоторных стимуляторов. Классическим психомоторным стимулятором является амфетамин — вещество, открытое еще в начале XX века, прошедшее сложную историю. Его пытались использовать как препарат, вызывающий похудание, и как психомоторный стимулятор, и как спортивный допинг. В настоящее время он является запрещенным наркотиком и одновременно иногда используется в клинике при тяжелых депрессиях. К этой же категории относится очень мощный и опасный наркотический препарат, который называется кокаин. Он тоже очень сильно увеличивает активность дофаминовой системы и очень быстро вызывает формирование привыкания и зависимости, серьезно меняя состояние нейронных сетей и особенно центров положительных эмоций, например nucleus accumbens.
Читайте также:


