Нервная и клеточная инженерия
Клеточная инженерия

Клеточная инженерия — КЛЕТОЧНАЯ ИНЖЕНЕРИЯ, конструирование специальными методами клеток нового типа. Клеточная инженерия включает реконструкцию жизнеспособной клетки из отдельных фрагментов разных клеток, объединение двух целых клеток, принадлежащих различным видам
Клеточная инженерия связана с культивированием отдельных клеток или тканей на специальных искусственных средах|средах. Доказано, что если взять кусочки ткани и отдельные клетки из разных органов|органов, допустим|допустим, растений, хотя это возможно и у животных, и пересадить их на специальные среды|среды, содержащие минеральные соли|соли и другие вещества, то они способны расти. Это значит, что в таких изолированных от организма тканях и клетках продолжаются клеточные деления.
Новейшим методом клеточной селекции у растений, уже давшим огромный эффект, является метод|метод гаплоидов. Гаплоидные клетки имеют половинный набор хромосом. Пыльцевые зерна|зёрна (пыльца) имеют гаплоидный набор хромосом. Сейчас разработан метод|метод проращивания пыльцевых зёрен на искусственных средах|средах в пробирках и получения из них полноценных гаплоидных растений. Какое это имеет отношение к селекции? У полученных гибридов берут пыльцу, на питательных средах|средах в пробирках регенерируют из неё гаплоидные растения, а затем удваивают у них число хромосом и сразу получают полностью гомозиготные диплоидные растения. Так как мы берём пыльцу из гибридных растений и получаем через гаплоидные растения сразу гомозиготные диплоидные, то остаётся только оценить их и затем размножить лучшие.

При гибридизации соматических клеток растений их предварительно освобождают от плотной клеточной оболочки, а затем проводят слияние изолированных протопластов. В этом случае, как и при гибридизации клеток животных, также удаётся преодолевать барьеры нескрещиваемости, которые существуют при обычной (половой|половой) гибридизации растений разных видов и родов|родов. Из гибридной растительной клетки на специальной среде можно вырастить клеточную массу – каллюс, дифференцирующуюся в нормальное целое растение с корнями, стеблями|стеблями и т. д. Такое гибридное растение можно высадить в землю и выращивать и размножать обычными способами. Эти методы, в отличие от традиционных, позволяют сравнительно легко и быстро получать достаточное количество генетически разнообразного исходного материала для селекции. Их применение привело, напр., к увеличению урожайности ряда культур – картофеля, цитрусовых и др.
Другое направление клеточной инженерии – манипуляции с безъядерными клетками, свободными ядрами и другими фрагментами, сводящиеся к комбинированию разнородных частей клетки. Эти эксперименты, а также микроинъекции в клетку хромосом, красителей и т. п. проводят для выяснения взаимных влияний ядра|ядра и цитоплазмы, факторов, регулирующих активность генов, и т. п.
Путём соединения клеток разных зародышей на ранних стадиях их развития выращивают мозаичных животных, или химер, состоящих из двух различающихся генотипами видов клеток. С помощью таких экспериментов изучают процессы дифференцировки клеток и тканей в ходе развития организма.
Ведущиеся уже не одно десятилетие опыты по пересадке ядер соматических клеток в лишённые ядра|ядра (энуклеированные) яйцеклетки животных с последующим выращиванием зародыша во взрослый организм с кон. 20 в. получили широкую известность как клонирование животных.
Преимущество клеточной инженерии в том, что она позволяет экспериментировать с клетками, а не с целыми организмами. Последнее гораздо сложнее, а иногда и невозможно, особенно в случае млекопитающих животных и человека или при получении отдалённых гибридов. Методы клеточной инженерии в медицине, сельском хозяйстве или биотехнологии часто применяют в сочетании с генной инженерией.
Видео по теме : Клеточная инженерия
Каждый живой организм состоит из клеток: начиная от бактерии, заканчивая высшими млекопитающими. Высшие организмы состоят из органов|органов, органы|органы состоят из тканей, ткани состоят из клеток. Всё|Все свойства любого организма определяются его геномом, который находится в клетке (в любой|любой из клеток данного организма).
Генная и клеточная инженерия (это одно понятие) занимается вопросами связи между устройством ДНК и наследственными свойствами организмов. Конечно, она вооружена такими методами, о которых раньше, например, во времена Менделя, и мечтать не смели|смели.
Метод|Метод клеточной инженерии заключается на современном этапе в том, что специалисты получают фрагменты ДНК различных организмов и встраивают их в ДНК организма, выбранного как объект исследования. Этот метод|метод на языке учёных, обожающих специальные термины, называется экспрессией рекомбинантных ДНК. В качестве инструмента берутся рестриктазы — особые бактериальные ферменты, способные расщеплять ДНК. Их и называют образно — биологическими ножами.

Цель, которую несёт в себе клеточная инженерия: получение лекарств, выведение качественных сортов культурных растений, создание новых пород животных, и как высшая точка — избавление нашей цивилизации от всех болезней. Те, кто спорит (не хочется называть их мракобесами) должны иметь в виду, что один только синтетический инсулин спас и спасает миллионы диабетиков и продлевает им жизнь на десятки лет!
Опасения по поводу генной инженерии берут начало|начало с момента её рождения в 1972-ом году, когда группа П. Берга (США) синтезировала первую рекомбинантную ДНК из онкогенного вируса обезьян SV40 и E.coli. Последнее — это кишечная палочка, без которой человек не может жить. И в неё встроен вирус, вызывающий рак. Учёные в прямом смысле испугались, и даже не стали продолжать работы в тот момент. Наступил долгий период постановки исследований под строжайший контроль государства, сравнимый с контролем над работами по ядерному оружию.
К счастью, сложность и стоимость биологических генных работ сопоставима по сложности и стоимости с атомными исследованиями, и поэтому не по карману потенциальным террористам.
Значение клеточной инженерии:
1. Применение клеточных культур позволяет преодолеть многие проблемы биоэтики (биологической этики), связанные с умерщвлением животных. Поэтому культуры клеток широко используются в научных исследованиях.
2. В культуре можно выращивать строго определенные клетки в неограниченном количестве. Поэтому культуры клеток и тканей, выделенные из природного материала, широко используются при промышленном производстве биологически активных веществ. В частности, на клеточно-тканевом уровне выращиваются женьшень, родиола розовая и другие лекарственные растения.
3. Из апикальных меристем путем микроклонирования получают посадочный материал ценных сортов растений, свободный от многих болезней (например, от вирусов и микоплазм), в частности, безвирусный посадочный материал цветочных и плодово-ягодных культур. На питательной среде размножают и каллусные ткани, которые в дальнейшем дифференцируются с образованием целостных растений.
4. Решаются проблемы получения отдаленных гибридов растений. Во-первых, путем соматической гибридизации можно скрещивать растения, которые не скрещиваются обычным путем. Во-вторых, полученные отдаленные гибриды можно воспроизводить, минуя семенное размножение и мейотический фильтр.
5. На культурах клеток получают вакцины, например, против кори, полиомиелита. В настоящее время решается вопрос крупномасштабного производства моноклональных антител на основе гибридомных культур.
6. Сохраняя культуры клеток, можно сохранять генотипы отдельных организмов и создавать банки генофондов отдельных сортов и даже целых видов, например, в виде мериклонов (культур меристем).
7. Манипуляции с отдельными клетками и их компонентами используются для клонирования животных. Например, ядра из клеток кишечного эпителия головастика внедряются в энуклеированные яйцеклетки лягушки. В результате из таких яйцеклеток развиваются особи с генетически идентичными ядрами.
Генная инженерия представляет собой совокупность методов, позволяющих создавать синтетические системы на молекулярно- биологическом уровне.
Генная инженерия дает возможность конструировать функционально активные структуры в форме рекомбинантных ДНК вне биологических систем (in vitro), а затем вводить их в клетки.
Практические достижения современной генной инженерии заключаются в следующем:
– Созданы банки генов, или клонотеки, представляющие собой коллекции клонов бактерий. Каждый из этих клонов содержит фрагменты ДНК определенного организма (дрозофилы, человека и других).
– На основе трансформированных штаммов вирусов, бактерий и дрожжей осуществляется промышленное производство инсулина, интерферона, гормональных препаратов. На стадии испытаний находится производство белков, позволяющих сохранить свертываемость крови при гемофилии, и других лекарственных препаратов.
– Созданы трансгенные высшие организмы (некоторые рыбы и млекопитающие, многие растения) в клетках которых успешно функционируют гены совершенно других организмов. Широко известны генетически модифицированные растения,устойчивые к высоких дозам определенных гербицидов, а также Bt-модифицированные растения, устойчивые к вредителям.
– Разработаны методы клонирования строго определенных участков ДНК, например, метод полимеразной цепной реакции. ПЦР-технологии применяются для идентификации определенных нуклеотидных последовательностей, что используется при ранней диагностике некоторых заболеваний, например, для выявления носителей ВИЧ-инфекции.
В настоящее время интенсивно изучается возможность коррекции генома человека (и других организмов) при генетических и негенетических заболеваниях.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
19 октября 2011
- 12563
- 10,1
- 16
- 4
В перспективе тканевая инженерия, если и не приведет к бессмертию, то уж точно сделает решение многих современных проблем медицины более чем реальным.
![]()
Анастасия Пешкова
![]()
Антон Чугунов![]()
Андрей Панов

В последние десятилетия стали отчетливо проявляться тревожные тенденции старения населения, роста количества заболеваний и инвалидизации людей трудоспособного возраста, что настоятельно требует освоения и внедрения в клиническую практику новых, более эффективных и доступных методов восстановительного лечения больных. На рисунке 1 показано, как изменяется структура заболеваний в настоящее время.
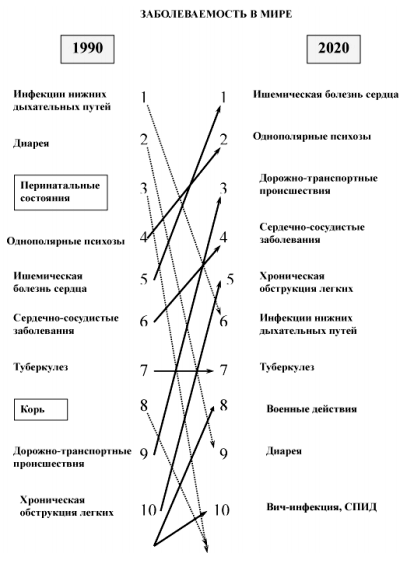
Рисунок 1. Мировая динамика частоты заболеваний.
На сегодняшний день наука и техника предлагает несколько альтернативных путей восстановления или замены поврежденных или пораженных патологией тканей и органов:
- трансплантацию;
- имплантацию;
- тканевую инженерию.
В рамках данной статьи мы подробнее остановимся на возможностях и перспективах тканевой инженерии.
Тканевая инженерия — современная инновационная технология
Принципиально новый подход — клеточная и тканевая инженерия — является последним достижением в области молекулярной и клеточной биологии. Этот подход открыл широкие перспективы для создания эффективных биомедицинских технологий, с помощью которых становится возможным восстановление поврежденных тканей и органов и лечение ряда тяжелых метаболических заболеваний человека.
Цель тканевой инженерии — конструирование и выращивание вне организма человека живых, функциональных тканей или органов для последующей трансплантации пациенту с целью замены или стимуляции регенерации поврежденных органа или ткани. Иными словами, на месте дефекта должна быть восстановлена трехмерная структура ткани.
Важно отметить, что обычные имплантаты из инертных материалов могут устранить только физические и механические недостатки поврежденных тканей, — в отличие от тканей, полученных методом инженерии, которые восстанавливают, в том числе, и биологические (метаболические) функции. То есть, происходит регенерация ткани, а не простое замещение ее синтетическим материалом.
Однако для развития и совершенствования методов реконструктивной медицины на базе тканевой инженерии необходимо освоение новых высокофункциональных материалов. Эти материалы, применяемые для создания биоимплантатов, должны придавать тканеинженерным конструкциям характеристики, присущие живым тканям:
- способность к самовосстановлению;
- способность поддерживать кровоснабжение;
- способность изменять строение и свойства в ответ на факторы окружающей среды, включая механическую нагрузку.
Клетки и матриксы — основа основ для тканевой инженерии
Наиболее важным элементом успеха является наличие необходимого количества функционально активных клеток, способных дифференцироваться, поддерживать соответствующий фенотип и выполнять конкретные биологические функции. Источником клеток могут быть ткани организма и внутренние органы. Возможно использование соответствующих клеток от пациента, нуждающегося в реконструктивной терапии, или от близкого родственника (аутогенных клеток). Могут быть использованы клетки различного происхождения, в том числе первичные (рис. 2) и стволовые клетки (рис. 3).
Рисунок 2. Первичная клетка человека.
библиотека Федерации Киокушинкай г. Южноуральска
Рисунок 3. Стволовая клетка человека.
Первичные клетки — это зрелые клетки определенной ткани, которые могут быть взяты непосредственно от организма-донора (ex vivo) хирургическим путем. Если первичные клетки взяты у определенного организма-донора, и впоследствии необходимо имплантировать эти клетки ему же в качестве реципиента, то вероятность отторжения имплантированной ткани исключается, поскольку присутствует максимально возможная иммунологическая совместимость первичных клеток и реципиента. Однако первичные клетки, как правило, не способны делиться — их потенциал к размножению и росту низок. При культивировании таких клеток in vitro (посредством тканевой инженерии) для некоторых типов клеток возможна дедифференцировка, то есть потеря специфических, индивидуальных свойств. Так, например, хондроциты, вводимые в культуру вне организма, часто продуцируют фиброзный, а не прозрачный хрящ.
Поскольку первичные клетки не способны делиться и могут потерять свои специфичные свойства, возникла необходимость альтернативных источников клеток для развития технологий клеточной инженерии. Таковой альтернативой стали стволовые клетки.

Рисунок 4. Биокерамические изделия из ортофосфатов кальция.
Для направления организации, поддержания роста и дифференцировки клеток в процессе реконструкции поврежденной ткани необходим специальный носитель клеток — матрикс, представляющий из себя трехмерную сеть, похожую на губку или пемзу (рис. 4). Для их создания применяют биологически инертные синтетические материалы, материалы на основе природных полимеров (хитозан, альгинат, коллаген) и биокомпозиты. Так, например, эквиваленты костной ткани получают путем направленной дифференцировки стволовых клеток костного мозга, пуповинной крови или жировой ткани в остеобласты, которые затем наносят на различные материалы, поддерживающие их деление (например, донорскую кость, коллагеновые матрицы и др.).
На сегодняшний день одна из стратегий тканевой инженерии такова:
- Отбор и культивирование собственных или донорских стволовых клеток.
- Разработка специального носителя для клеток (матрицы) на основе биосовместимых материалов.
- Нанесение культуры клеток на матрицу и размножение клеток в биореакторе со специальными условиями культивирования.
- Непосредственное внедрение тканеинженерной конструкции в область пораженного органа или предварительное размещение в области, хорошо снабжаемой кровью, для дозревания и формирования микроциркуляции внутри конструкции (префабрикация).
Кровеносные сосуды из принтера

Однако прежде чем действительно можно будет имплантировать выращенные в лаборатории органы с собственными кровеносными сосудами, пройдет еще какое-то время.
Давай, Россия, давай вперед!

Рисунок 6. Лауреат премии Президента РФ Екатерина Игоревна Шишацкая.
Первый опыт трансплантации тканеинженерной конструкции в клинике

Осенью 2008 года руководитель клиники Университета Барселоны (Испания) и Медицинской школы Ганновера (Германия) профессор Паоло Маккиарини (Paolo Macchiarini; рис. 7) провел первую успешную операцию по трансплантации биоинженерного эквивалента трахеи пациентке со стенозом главного левого бронха на протяжении 3 см (рис. 8) [11].
В качестве матрикса будущего трансплантата был взят сегмент трупной трахеи длиной 7 см. Чтобы получить природную матрицу, по свойствам превосходящую все то, что можно сделать из полимерных трубок, трахею очистили от окружающей соединительной ткани, клеток донора и антигенов гистосовместимости. Очищение заключалось в 25 циклах девитализации с применением 4%-деоксихолата натрия и дезоксирибонуклеазы I (процесс занял 6 недель). После каждого цикла девитализации проводили гистологическое исследование ткани для выявления количества оставшихся ядросодержащих клеток, а также иммуногистохимическое исследование на наличие в ткани антигенов гистосовместимости HLA-ABC, HLA-DR, HLA-DP и HLA-DQ. Благодаря биореактору собственной разработки (рис. 9) ученые на поверхность медленно вращающегося отрезка трахеи равномерно нанесли шприцем суспензию клеток. Затем трансплантат, наполовину погруженный в среду для культивирования, вращался вокруг своей оси с целью попеременного контакта клеток со средой и воздухом.
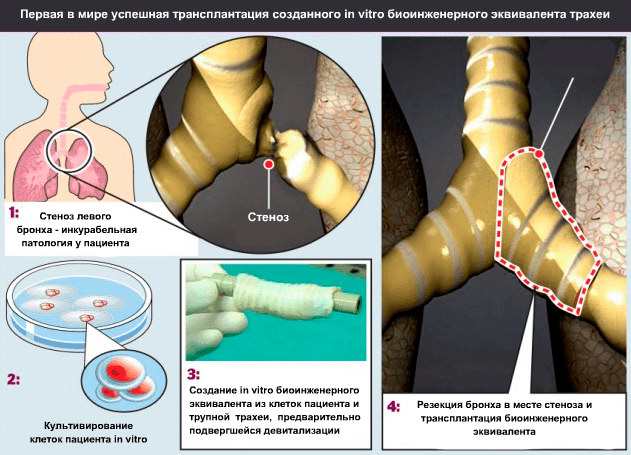
Рисунок 8. Операция по пересадке пациентке трахеи.
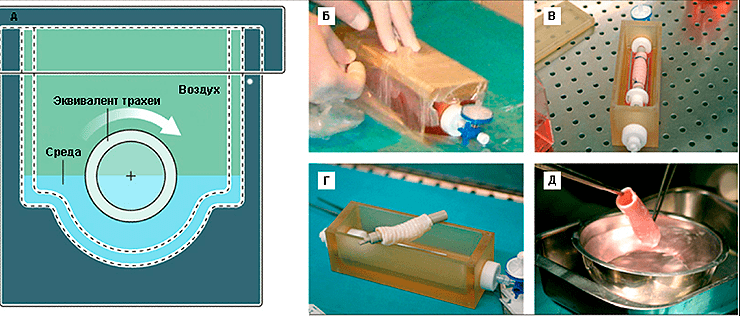
Рисунок 9. Биореактор для создания тканеинженерного эквивалента трахеи. А — схема биореактора, вид с боку. Б — герметизация биореактора. В — биореактор с тканеинженерным эквивалентом трахеи in situ. Г — биореактор после удаления эквивалента трахеи. Д — вид эквивалента трахеи непосредственно перед операцией.
Эквивалент трахеи находился в биореакторе 96 часов; затем его трансплантировали пациентке. При операции был полностью удален главный левый бронх и участок трахеи, к которому он примыкал. В образовавшийся промежуток вшили трансплантат, а некоторое несоответствие диаметров просветов тканеинженерного эквивалента и бронха реципиента было преодолено благодаря эластичности донорской ткани.
По истечении десяти суток после операции пациентка была выписана из клиники без признаков дыхательной недостаточности и иммунной реакции отторжения трансплантата. По данным компьютерной томографии, с помощью которых была сделана виртуальная 3D реконструкция дыхательных путей, тканеинженерный эквивалент был практически неотличим от собственных бронхов пациентки (рис. 10).
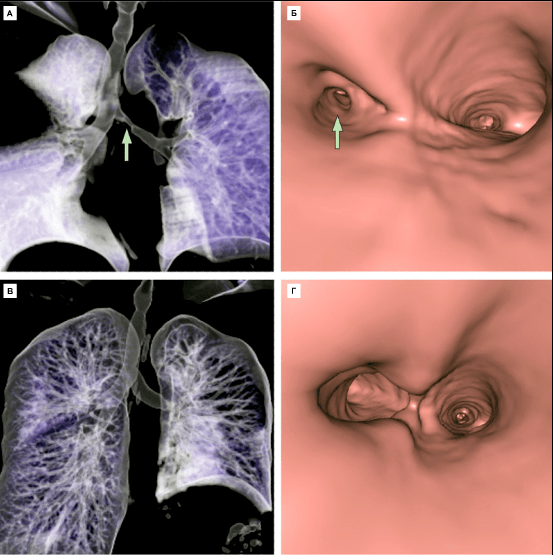
Рисунок 10. Виртуальная 3D-реконструкция дыхательных путей по данным компьютерной томографии и бронхоскопии перед операцией (А, Б) и через 1 месяц и после замены стенозного участка левого главного бронха тканеинженерным эквивалентом (В, Г). Стрелкой указан стеноз.
Для лечения многих болезней необходимы различные биологически активные вещества. При выделении их из тканей человека возникает опасность загрязнения полученного материала различными вирусами (гепатита В, иммунодефицита человека и др.). Кроме того, эти вещества производятся в небольших количествах и являются дорогостоящими. Биологически активные вещества животного происхождения низкоэффективны из-за несовместимости с иммунной системой больного человека. Только развитие новой отрасли генной инженерии помогло обеспечить получение чистых биологически активных веществ в больших количествах по более низкой цене.
Генная инженерия — это создание гибридных, рекомбинантных молекул ДНК, а стало быть, и организмов с новыми признаками. Для этого необходимо выделить ген из какого-либо организма или искусственно синтезировать его, клонировать (размножить) и перенести в другой организм.
Инструментами генной инженерии являются ферменты: рестриктазы (разрезающие молекулу ДНК) и лигазы (сшивающие ее). В качестве векторов-переносчиков используются вирусы.
С помощью генной инженерии созданы штаммы кишечных палочек, в которые встроены гены человеческого инсулина (необходимого для лечения сахарного диабета), интерферона (противовирусного препарата), соматотропина (гормона роста).
С помощью генной инженерии созданы дрожжевые клетки, продуцирующие человеческий инсулин. Биосинтетический метод производства человеческого инсулина с помощью дрожжевых клеток широко используется в фармацевтическом производстве (в Дании, Югославии, США, Германии и других странах).
В настоящее время ученые разных стран работают над получением с помощью генной инженерии ряда других необходимых биологически активных веществ, вакцины против гепатита В, активатора профибринолизина (противосвертывающий препарат), интерлейкина-2 (иммуномодулятор) и др.
В клетки животных чужеродные гены вводят в виде отдельных молекул ДНК или в составе векторов-вирусов, способных вносить в геном клетки чужую ДНК. Обычно применяют два метода:
1) ДНК добавляют в среду инкубации клеток;
2) производят микроинъекции ДНК непосредственно в ядро (что более эффективно).
Первоочередными задачами генной инженерии у человека являются создание банков генов человека для их изучения и поиск путей генотерапии, то есть замены мутантных генов нормальными аллелями.
Клеточная инженерия — это метод конструирования клеток нового типа на основе их культивирования, гибридизации или реконструкции. При гибридизации искусственно объединяются целые клетки (иногда далеких видов) с образованием гибридной клетки. Клеточная реконструкция — это создание жизнеспособной клетки из отдельных фрагментов разных клеток (ядра, цитоплазмы, хромосом и др.).
Изучение гибридных клеток позволяет решать многие проблемы биологии и медицины. Так, например, биотехнология использует гибридомы. Гибридома — это клеточный гибрид, получаемый слиянием нормального лимфоцита и опухолевой клетки. Она обладает способностью к синтезу моноклональных (однородных) антител желаемой специфичности (свойство лимфоцита) и к неограниченному росту в искусственной среде (свойство опухолевой клетки).
Биотехнология — это производство продуктов и материалов, необходимых для человека, с помощью биологических объектов.
В середине XX в. и во второй его половине, используя индуцированный мутагенез, были получены антибиотики (пенициллин, стрептомицин, эритромицин и др.) — с помощью микробов; фермент амилаза — с помощью сенной палочки, аминокислоты — с помощью кишечной палочки; молочная кислота — с помощью молочно-кислых бактерий; лимонная кислота - с помощью аспергилловой плесени; витамины группы В — с помощью дрожжей.
В последние десятилетия в результате успехов, достигнутых генной инженерией, происходит скачок в биотехнологии — развивается микробиологическая промышленность (микробиологическая индустрия), которая позволяет в промышленных условиях с помощью кишечной палочки или дрожжей получать человеческий инсулин, интерферон, соматотропин и другие вещества.
Дата добавления: 2018-11-24 ; просмотров: 132 ;
Каждый живой организм состоит из клеток: начиная от бактерии, заканчивая высшими млекопитающими. Высшие организмы состоят из органов, органы состоят из тканей, ткани состоят из клеток. Все свойства любого организма определяются его геномом, который находится в клетке (в любой из клеток данного организма).
По некоторым данным, геном обыкновенной мухи и человека совпадают на три четверти. Ничего удивительного в этом нет. Основа генов - дезоксирибонуклеиновая кислота - ДНК - несет всю информацию о построении всех белков и биохимии данного организма, а на долю "внешнего вида", размеров и веса экземпляра биологического вида, по-видимому, отводится не так уж много. Короче говоря, Дарвин абсолютно прав, и эволюция на определенном узловом этапе связывает и муху и человека. И религии это нисколько не противоречит, поскольку она утверждает только факт создания жизни Богом, но никак не регламентирует саму технологию.
Генная и клеточная инженерия (это одно понятие) занимается вопросами связи между устройством ДНК и наследственными свойствами организмов. Конечно, она вооружена такими методами, о которых раньше, например, во времена Менделя, и мечтать не смели.
Метод клеточной инженерии заключается на современном этапе в том, что специалисты получают фрагменты ДНК различных организмов и встраивают их в ДНК организма, выбранного как объект исследования. Этот метод на языке ученых, обожающих специальные термины, называется экспрессией рекомбинантных ДНК. В качестве инструмента берутся рестриктазы — особые бактериальные ферменты, способные расщеплять ДНК. Их и называют образно — биологическими ножами.
Цель, которую несёт в себе клеточная инженерия: получение лекарств, выведение качественных сортов культурных растений, создание новых пород животных, и как высшая точка — избавление нашей цивилизации от всех болезней. Те, кто спорит (не хочется называть их мракобесами) должны иметь в виду, что один только синтетический инсулин спас и спасает миллионы диабетиков и продлевает им жизнь на десятки лет!
Опасения по поводу генной инженерии берут начало с момента ее рождения в 1972-ом году, когда группа П. Берга (США) синтезировала первую рекомбинантную ДНК из онкогенного вируса обезьян SV40 и E.coli. Последнее — это кишечная палочка, без которой человек не может жить. И в нее встроен вирус, вызывающий рак. Ученые в прямом смысле испугались, и даже не стали продолжать работы в тот момент. Наступил долгий период постановки исследований под строжайший контроль государства, сравнимый с контролем над работами по ядерному оружию.
К счастью, сложность и стоимость биологических генных работ сопоставима по сложности и стоимости с атомными исследованиями, и поэтому не по карману потенциальным террористам.
В действительности же клеточная инженерия это — палка о двух концах — она может дать человеку столько лет жизни, сколько он сам захочет, но может и посеять страшные несчастья для всего живого. Не спорьте, обратное не доказано, а "цена вопроса" известна. Все зависит от того, в чьих чистых или грязных руках находится клеточная инженерия. И по объективным причинам ее нельзя ни запретить, ни подтолкнуть вперед. Развитие науки подчиняется своим внутренним законам.
С давних пор человек мечтал о том, чтобы разводимые им животные были больше, выносливее и продуктивнее. Чтобы выращиваемые им сельскохозяйственные культуры вызревали в кратчайшие сроки, не поражались вредителями и болезнями, росли даже в условиях пониженных температур окружающего воздуха и отсутствия регулярных дождей.
Основные технологии
Основным методом достижения таких результатов является клеточная инженерия. Наиболее детально все ее приемы отработаны на некоторых микроорганизмах. Вообще, дальнейшие возможности и перспективы данного направления попросту необъятны. На данный момент ведутся углубленные разработки по выделению отдельных генов, которые и можно встраивать в организм. Проще говоря, можно будет создавать домашних животных и растения, которые бы обладали строго определенным набором признаков и имели требуемый внешний вид.
Методы клеточной инженерии
Всем растительным клеткам присуще свойство тотипотентности (это когда отдельная клетка может развиться в целый организм). В сельском хозяйстве это дает неограниченные перспективы в экспериментах по выведению новых видов полезных человеку культур. Весьма перспективна клеточная инженерия в животноводстве. В настоящее время ученые имеют громадный опыт по накоплению и хранению соматических клеток разнообразных пород животных in vitro. Особенно это касается хранения материала в условиях низких температур.
Кстати, а какие существуют методы клеточной инженерии животных? Давайте их обсудим.
Разделение эмбрионов на ранних стадиях
На сегодняшний день особенно перспективен метод разделения ранних эмбрионов. Первый толчок этому направлению дала начавшая развиваться трансплантология, методы которой позволили сохранять большое количество полученных эмбрионов. Вообще, первый удачный опыт по разделению зародышевого материала на стадии 2—8 был проведен Виллардом (в английском Кембридже). Недостаток такого метода в его трудоемкости, из-за чего данная операция может быть выполнена только в условиях хорошо оснащенного медицинского учреждения.
Проще говоря, это чрезвычайно сложная биотехнология. Клеточная инженерия в наше время использует куда более простые методы.
Позднее разделение зародышей
Так, ученые начали манипулировать зародышевым материалом только на более поздних стадиях (морула, бласто-циста). Сущность метода состоит в том, что сперва вскрывается прозрачная зона (pellucida), после чего эмбрион аккуратно разделяется надвое. Одна половинка остается на прежнем месте, в то время как вторую часть переносят в заранее подготовленную зону.

Первыми в этих опытах были американские ученые. Именно они сделали вывод, что если лишить эмбрион прозрачной оболочки, то он выживает не более чем в 15% случаев, но если слой пеллюцида сохранить, то выживаемость сразу увеличивается до 35% случаев. Наиболее оптимальные результаты получаются в том случае, если у каждой половинки разделенного эмбриона есть прозрачная оболочка и каждую часть вводят в отдельный рог матки: в современных условиях выживает до 75% эмбрионов.
Но для каких целей используется клеточная инженерия на практике? Какие результаты получают с ее помощью?
Значение клеточной инженерии в племенном деле
На сегодняшний день эта методика все более активно начинает использоваться в международном племенном деле. Сравнительно недавно была успешно опробована методика получения и внедрения эмбрионов у свиней. Исследователи считают, что клеточная инженерия может позволить увеличить количество потомков одного животного минимум на 30—35%. Но не стоит забывать и о возможности получения генетических копий.
Такие животные едва ли не на вес золота для тех ученых, которые изучают взаимодействие окружающей среды и генотипа. Дело в том, что наличие двух совершенно одинаковых особей позволяет свести к минимуму влияние внутренних факторов при изучении влияния внешней среды на организм. Кроме того, можно производить забой одного животного из пары в том случае, если для исследования требуются данные о внутреннем состоянии организма.
Все эти разработки – основные методы клеточной инженерии. Но мы забыли рассказать о важнейшем направлении этой отрасли наук, связанном с искусственной регуляцией пола сельскохозяйственных животных. Пора исправить этот недочет.
Методы регуляции пола

Конечно же, в идеале стоило бы попросту разделять спермии, которые несут Х- и У-хромосомы. Именно в этом направлении и должны развиваться исследования. Другой подход (который куда проще, а потому используется) состоит в том, чтобы извлекать ранние эмбрионы из репродуктивной системы самок, определять их пол, а затем производить их трансплантацию.
Но как ко всему этому относятся методы клеточной инженерии? Все достаточно просто.
Все дело в цитологическом методе, при помощи которого определяют тип эмбриона XX или XY. Делается это посредством изучения хроматина или же половых хромосом. В последние годы также выяснено, что выяснить пол можно, изучив специфические антитела, которые у самок и самцов совершенно разные. Есть также мнения некоторых ученых, что установить гендерную принадлежность можно, изучив активность глюкозо-6-фосфат-дегидрогеназы. Впрочем, в настоящее время наиболее эффективны цитологический и иммунологический (изучение антител) методы.
Генная инженерия
В названии данной статьи неслучайно используется словосочетание "генная и клеточная инженерия". Какими бы эффективными ни были методы коррекции клеточного материала, работа непосредственно с генами всегда будет намного более эффективной.
В настоящее время именно генетические методы постепенно завоевывают лидирующую роль в животноводстве и растениеводстве всего мира. Благодаря им селекционная работа вышла на принципиально иной уровень: отныне ученые могут не просто предполагать, какими именно качествами будет обладать создаваемая ими особь, но знать это наверняка.
Нужно сразу заметить, что все не так уж и хорошо. Имеются некоторые ограничения. Дело в том, что к генетическим манипуляциям допускается только генетический материал быков, которые могут улучшать свое потомство (улучшатели). Проблема только в том, что таких животных на сегодняшний день чрезвычайно мало. Кроме того, программы, направленные на искоренение того же мастита, пока что видимых результатов не дают. Проще говоря, генная и клеточная инженерия – далеко не панацея.

Сравнительно недавно учеными был создан метод переноса ядра после слияния кариопластов. Кроме того, методы генной и клеточной инженерии уже сейчас позволяют создавать химерические организмы на основе различных видов мекопитающих.
Гарднером вскоре был разработан принципиально новый метод, при котором производится имплантация бластомеров в бластоцисты реципиента. Бутлером данная методика была успешно отработана на лабораторных мышах. Именно на основании данных разработок впервые были получены химеры на основе организма овец.
Все описанные выше работы постепенно готовили мировую сельскохозяйственную науку к широкому внедрению методов генной инженерии. Наиболее распространенным методом на сегодняшний день является перенос генного материала в культивируемые клетки с последующим их внесением в бластоцисту.
Развернутое определение
Так в чем состоит суть генной инженерии? В середине 70-х годов прошлого века ученые сделали сенсационное открытие. Они выяснили, что некоторые микробные ферменты способны разрезать молекулу ДНК в необходимом месте. Проще говоря, появилась уникальная возможность получать генетический материал со строго заданными свойствами.
- Ген должен иметь какую-то четкую характеристику, которую и предстоит детектировать.
- Выделенный генетический материал требуется прикрепить к переносчику (вирусу, к примеру), который и произведет его трансплантацию.
Проще говоря, выделенный ген из организма донора нужно перенести в организм реципиента, для которого он является чужим. Главное в работе исследователей – не просто добиться его приживления, но и создать такие условия, при которых он будет нормально реплицироваться.
Работа с зиготой
Впрочем, в последние годы не меньшее распространение получила методика, при которой чужеродные гены инъецируют в пронуклеус зиготы животных. Впервые этот способ был апробирован на ооцитах озерных лягушек: сперва в них вводилась определенная ДНК, причем учеными сразу были отмечены интеграция и транскрипция. В 1981 году впервые был проведен интереснейший эксперимент, в ходе которого ген гаммаглобулина кролика был внесен в зиготу мыши.
Ген при этом имел вид длинного геномного тандема, содержащего стабильные участки. Любопытно, но правильно транскрибировались они только при том условии, если в них совершенно не было плазмидных компонентов. Проявление генов, которые были встроены с использованием этого метода, было подробнейшим образом изучено на лабораторных мышах.
За один год до экспериментов с зиготой мыши, в 1980 году, в пронуклеус все той же мышиной зиготы поместили плазмиду pBR322, в которой содержались фрагменты вирусов SK40 и HSV. В результате ДНК вируса была найдена у трех мышей из 78 особей, которые участвовали в эксперименте. Как ни странно, но при инъекции гена гаммаглобулина человека его интеграция наблюдалась уже у пяти мышей из 33 особей (более 15%). Этот опыт уже тогда доказал, что создание химерических организмов, которые бы сочетали в себе черты сразу нескольких видов, вполне реально.
Бринстер и его последователи с учениками произвели трансплантацию в пронуклеусы зигот мышей специально подготовленной конструкции, в состав которой входил металлотионеин мыши, а также ген тимидинкиназы. В этом случае полная интеграция была отмечена уже у 17% лабораторных животных.
Основные выводы
В настоящее время генная инженерия наконец-то стала перспективной, обсуждаемой отраслью науки. Об этом знают практически все. Но в чем же состоят задачи клеточной инженерии и работы с генетическим материалом? О, они весьма разнообразны.
Во-первых, перед учеными всего мира стоит задача усмирения, снижения голода на всей планете. Методы генной и клеточной инженерии делают вполне реальным создание таких сортов растений и видов животных, продуктивность которых будет в десятки раз превышать таковую у их диких предков.
Специалисты говорят, что именно методы генной инженерии уже в ближайшем будущем позволят не только диагностировать на предельно ранних сроках беременности генетические болезни (синдром Дауна, к примеру), но и эффективно их лечить!
Читайте также:





