Нервная регуляция секреции гормонов
Содержание большинства гормонов в плазме крови колеблется в зависимости от состояния организма, причем эти колебания вполне закономерны. Например, адреналин секретируется уже через секунды после стимуляции надпочечников, и обычно такая стимуляция достигается стрессогенными воздействиями. После этого железы находятся в активном состоянии в течение последующих нескольких секунд или минут, обеспечивая секрецию гормонов. Для секреции и проявления физиологических эффектов других гормонов требуется гораздо больше времени, иногда месяцы. Примером могут служить гормоны щитовидной железы и гормон роста.
Концентрации гормонов, необходимые для большинства обменных процессов и эндокринной функции, чрезвычайно малы. Концентрации гормонов в крови варьируют от одного пикограмма (10 12 г) до нескольких микрограммов (10
3 г) в 1 мл крови. Скорость секреции чрезвычайно мала, обычно она исчисляется несколькими микрограммами в сутки.
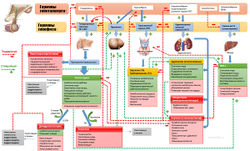
Секреция всех гормонов организма подвержена постоянному контролю. В большинстве случаев этот контроль реализуется благодаря механизму отрицательной обратной связи, обеспечивающему должный уровень гормональной активности в тканях-мишенях. После того как стимул вызвал высвобождение гормона, ответная реакция приводит к подавлению дальнейшей секреции гормона. Такой механизм препятствует чрезмерной активности гормонпродуцирующих клеток и тем самым предотвращает патологическое повышение активности ткани-мишени. Именно такой принцип регуляции, основанный на отрицательной обратной связи, характерен для гипоталамо- гипофизарпой системы (рилизинг-гормон гипоталамуса — тропный гормон аденогипофиза — гормон железы-мишени) (рис. 1.8).
Гормон Либерии гипоталамуса стимулирует синтез и секрецию гормона передней доли гипофиза, а гипофизарный гормон, называемый тройным, специфически стимулирует секрецию гормона периферической железы- мишени. При повышении концентрации этого конечного гормона происходит ингибирование всей системы путем торможения синтеза и рилизинг- гормопа гипоталамуса; при снижении концентрации конечного гормона вся система активируется за счет усиления синтеза рилизинг-гормона. Особенность такой системы состоит в том, что и гормон гипофиза может ее блокировать по короткой петле обратной связи, ингибируя собственный синтез. Из этого примера очевидно также, что уровень одного гормона определяется системой из нескольких гормонов и нескольких тканей-мишеней. Такие же петли обратной связи описаны в системах регуляции надпочечников, щитовидной железы, половых желез.

Рис. 1.8. Схема реализации регуляторных влияний в эндокринной системе по типу отрицательной обратной связи:
но такому типу регулируется работа надпочечников, щитовидной железы,
половых желез
В других случаях отрицательная обратная связь осуществляется с помощью отдельных метаболитов или субстратов, концентрация которых в плазме крови меняется при воздействии гормона на ткань-мишень. Например, увеличение концентрации глюкозы в крови (гипергликемия) вызывает высвобождение инсулина, который усиливает потребление и утилизацию глюкозы в ряде тканей: в результате уровень глюкозы в крови возвращается к норме, что в свою очередь снижает секрецию инсулина.
В ряде случаев регуляция уровня гормонов может осуществляться и по механизму положительной обратной связи. Так, эстрогены и прогестерон способствуют выбросу ЛГ, в результате чего происходят овуляция, формирование желтого тела и увеличение продукции этих стероидных гормонов.
Различные патофизиологические события — шок, травма, гипогликемия, боль и стресс — оказывают влияние на систему гипоталамус — гипофиз, воздействуя через высшие нервные центры. В этих условиях происходят глубокие изменения метаболизма катехоламинов и гормона роста, функции коры надпочечников, щитовидной железы и гонад.
Регуляция секреции гормонов: 1) гормональная регуляция за счет выработки либеринов и статинов в гипоталамусе, которые через портальную систему гипофиза из гипоталамуса попадают в аденогипофиз (переднюю долю) и усиливают (либерины) или тормозят (статины) продукцию соответствующих гормонов. В гипоталамусе вырабатываются 7 либеринов и 3 статина ( кортиколиберин, тиреолиберин, фолиберин, люлиберин, меланолиберин, пролактолиберин, соматолиберин, соматостатин, меланостатин, пролактостатин). Гормоны аденогипофиза в свою очередь вызывают изменение продукции гормонов соответствующих желез внутренней секреции; 2) регуляция продукции гормона по принципу обратной связи. Например, продукция тиреоидных гормонов щитовидной железы регулируется тиреолиберином гипоталамуса, воздействующего на аденогипофиз, продуцирующий тиреотропный гормон (ТТГ), который повышает продукцию тереоидных гормонов. Поподая в кровь, тиреоидные гормоны действуют на гипоталамус и аденогипофиз и тормозят (если уровень тиреоидных гормонов высокий) продукцию тиреолиберина и ТТГ; 3) регуляция с участием структур ЦНС:симпатическая и парасимпатическая нервные системы вызывают изменение в продукции гормонов. Активация симпатического отдела АНС приводит к повышению продукции адреналина в мозговом слое надпочечников, а повышение парасимпатического отдела – к повышению продукции инсулина. Различные структуры гипоталамуса вызывают изменение в продукции гормонов. Эмоциональные, психические воздействия через структуры лимбической системы, через гипоталамические образования способны существенно влиять на деятельность клеток, продуцирующих гормоны.
Разрушение гормонов (катаболизм). Гормоны очень быстро разрушаются в тканях, в частности в печени. Длительность полураспада гормона (время, необходимое для расщепления половины имеющегося гормона) колеблется от нескольких минут до двух часов.
Различают несколько типов взаимодействия между эндокринными железами: 1) взаимодействие по принципу положительной и отрицательной прямой и обратной связи. Например, ТТГ стимулирует продукцию гормонов щитовидной железы. При удалении передней доли гипофиза происходит атрофия щитовидной железы – эта прямая положительная связь. Гиперфункция щитовидной железы тормозит образование ТТГ – отрицательная обратная связь; 2) синергизм гормональных влияний, или однонаправленное действие разных гормонов. Например, адреналин (мозговой слой надпочечников) и глюкагон (поджелудочная железа) – активируют расщепление гликогена в печени до глюкозы и вызывают повышение сахара в крови; 3) Антагонизм гормональных влияний. Например, инсулин и адреналин вызывают разные эффекты: инсулин – гипогликемию (за счет повышения проникновения глюкозы к клеткам с дальнейшим процессом ее утилизации), адреналин - гипергликемию (за счет превращения резервного гликогена печени в глюкозу, которая поступает в кровь); 4) пермиссионное (разрешающее) действие гормонов, которое выражается в том, что гормон сам не вызывает физиологического эффекта, но создает условие для реакции клеток и тканей на действие других гормонов. Например, действие глюкокортикоидов на эффекты адреналина. Сами глюкокортикоиды не влияют на тонус сосудов, но они создают условия, при которых даже подпороговые концентрации адреналина повышают АД и вызывают гипергликемию как результат глюкогенолиза в печени.
88. Функциональные связи гипоталамуса с гипофизом (гипоталамо-гипофизарная система). Нейросекреты гипоталамуса: либерины и статины, их роль в регуляции деятельности гипофиза
Гипоталамус является высшим центром, осуществляющим нейрогуморальную регуляцию.
1. ГТ как один из отделов ЦНС является и главным координатором гормональной регуляции в организме.
2. ГТ - это то единственное место ЦНС, в области которого проницаемость для ГЭБ очень высока (это позволяет создать мост между нервной и гуморальной регуляцией, т.к. за счет большого количества хеморецепторов ГТ может воспринимать уровень биологически активных веществ в крови).
3. Нейроны ГТ обладают способностью к нейросекреции, что проявляется в изменении уровня выделения релизинг-факторов (либерины и статины). В настоящее время известно 10 релизинг-факторов (7 либеринов и 3 статина).
Либерины: 1.Соматолиберин, 2.Тиролиберин, 3.Люлиберин, 4. Фоллиберин, 5.Кортиколиберин, 6. Пролактолиберин, 7. Меланолиберин.
Статины: 1.Соматостатин, 2. Пролактостатин, 3. Меланостатин
Релизинг–факторы регулируют выделение гормонов передней доли гипофиза, большая часть которых, гландулярные, регулируют деятельность других желез внутренней секреции, выделение ими гормонов.
Некоторые гормоны гипофиза вырабатываются в гипоталамусе и лишь накапливаются в гипофизе (гормоны нейрогипофиза - АДГ и окситоцин). Регуляция в системе гипоталамус - гипофиз осуществляется по принципу отрицательной обратной связи (избыток гормонов в крови - торможение их выработки):
1. Короткая петля регуляции: Рецепторы ГФ реагируют на концентрацию тропных (собственных) гормонов, изменяют их выделение и опосредовано, уровень гормонов периферических желез внутренней секреции.
2. Длинная петля регуляции: Уровень гормонов периферических желез внутренней секреции воспринимается хеморецепторами ГФ, это изменяет выделение тропных (собственных) гормонов, и опосредовано, уровень гормонов периферических желез внутренней секреции.
3. Более длинная петля регуляции: Уровень гормонов периферических желез внутренней секреции воспринимается хеморецепторами гипоталамуса, затем гипофиз(изменение уровня тропных гормонов) – железа внутренней секреции и как следствие - изменение уровня гормона периферических желез внутренней секреции.
Регуляция в системе ГТ- задняя доля ГФ. Уровень гормонов ГФ в крови регулирует синтез гормонов в ГТ. Так регулируются все периферические железы внутренней секреции.


Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
В зависимости от природы регулирующих факторов различают не сколько видов регуляции секреции гормонов.
Кроме гормонов на секреторную функцию эндокринных клеток влияют и другие биологически акт ивные вещества. Например, биологически активный белок плазмы ангиотензин II является основным стимулятором секреции минералокортикоидов.
Метаболическая регуляция: активность эндокринных клеток может непосредственно регулироваться содержанием в крови определенных метаболитов. Этот вид регуляции является основным для секреции гормонов поджелудочной железы (в частности, секреция инсулина усиливается под действием глюкозы) и паращитовидных желез (секреция паратгормона усиливается при снижении концентрации в крови ионов Са 2+ ).
Нервная регуляция: секреция некоторых гормонов регулируется прямыми воздействиями со стороны нервной системы. Такая регуляция является ведущей в секреции гормонов гипоталамуса и нейрогипофиза, эпифиза, а также мозгового вещества надпочечников.
В большинстве случаев в регуляции секреции какого-либо гормона участвуют несколько механизмов. Например, на уровень секреции инсулина влияет не только глюкоза (основной регулирующий фактор), но и некоторые гормоны (адреналин, глюкагон и др.), а также симпатические и парасимпатические нервные воздействия.
2. Гипоталамус и гипофиз
2.1. Гипоталамо-гипофизарная система
Гипоталамус - часть промежуточного мозга, расположенная книзу от таламуса - высший вегетативный центр, координирующий функции различных систем, адаптируя их к целостной деятельности организма. Гипоталамус принимает участие во многих физиологических процессах: терморегуляции и регуляции обмена веществ и энергии, в организации пищевого и питьевого поведения, в чередовании сна и бодрствования. Широкие регуляторные возможности гипоталамуса обусловлены его тесными связями с другими структурами ЦНС, а также с вегетативной нервной системой и с эндокринной системой. Под непосредственным контролем гипоталамуса находится гипофиз, управляющий, в свою очередь, щитовидной железой, половыми железами и корковым веществом надпочечников. Таким образом, гипоталамус является нейроэндокринным центром, объединяющим нервную и эндокринную системы.
Некоторые нейроны гипоталамуса нейросекреторные клетки подобно эпителиальным клеткам эндокринных желез, синтезируют и выделяют в кровь гормоны (нейрогормоны ). Этот процесс называется нейросекрецией и протекает так же, как и секреция синаптических медиаторов (рис. 3). Аксоны нейросекреторных клеток заканчиваются на капиллярах в виде аксо-капиллярных синапсов. Нейрогормоны синтезируются в телах нейросекреторных клеток, путем аксонного транспорта (движение цитоплазмы вдоль аксона) попадают в синаптические окончания, где накапливаются. При возбуждении соответствующих нейронов гипоталамуса нейрогормоны выделяются в кровоток.
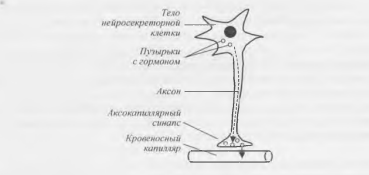
Рис. 3. Нейросекреция.
Гипофиз (нижний мозговой придаток) - центральная железа внутренней секреции, структурно и функционально связанная с гипоталамусом. В составе гипофиза человека выделяют два отдела, различных по развитию, строению и функциям: нейрогипофиз и аденогипофиз.
Нейрогипофиз (задний отдел гипофиза) образован нервной тканью и фактически является продолжением гипоталамуса; нейрогипофиз секретирует в кровь гормоны, синтез которых происходит в гипоталамусе. Аденогипофиз (передний отдел гипофиза) образован эпителиальной тканью , клетки которой синтезируют и секретируют в кровь ряд собственных гормонов.
У большинства позвоночных различают три доли гипофиза: переднюю, промежуточную и заднюю. Однако у человека и других высших приматов промежуточная доля развита слабо (она составляет лишь 2% от общей массы гипофиза). Поэтому гипофиз человека подразделяют только на два отдела: аденогипофиз, состоящий из передней и промежуточной частей, и нейрогипофиз, соответствующий задней доле гипофиза.
Связи между гипоталамусом и гипофизом представлены на рис. 4.
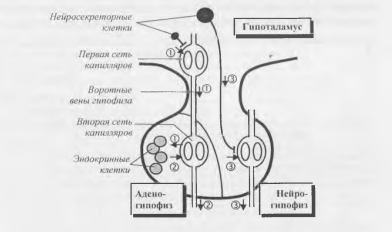
Рис. 4. Гипоталамо-гипофизарная система.
Обозначения: 1 - либерины и статины; 2 - гормоны аденогипофиза; 3 - окситоцин и вазопрессин.
В гипоталамусе и гипофизе синтезируется большое количество гормонов, регулирующих многие физиологические функции. По химической структуре эти гормоны относятся к белково-пептидным, а по мишени дейст вия среди них есть как регуляторные, так и эффекторные гормоны (рис. 5).
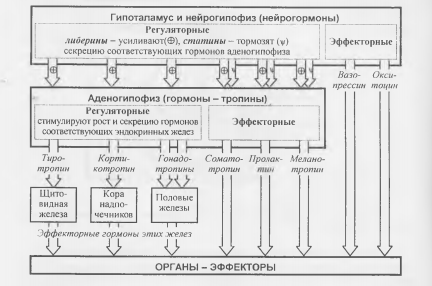
Рис. 5. Гормоны гипоталамуса и гипофиза.
Одной из важнейщих областей ЦНС, координирующей и контролирующей функции эндокринных желез, является гипоталамус, где локализуются нейросекреторные ядра и центры, принимающие участие в регуляции синтеза и секреции гормонов аденогипофиза. Гипоталамус – область головного мозга, расположенная между перекрестом зрительных нервов, зрительным трактом, внутренним краем ножки головного мозга и сосковидными телами. Гипоталамическая бороздка, идущая от сильвиева водопровода до монроева отверстия, отделяет гипоталамус от зрительного бугра. В гипоталамусе различают три больших зоны: перивентрикулярную, медиальную и латеральную. В свою очередь каждая зона состоит из нескольких ядер. Так, в перивентрикулярной зоне различают одну область и 6 ядер: преоптическую перивентрикулярную область, переднее перивентрикулярное ядро, супрахиазматическое ядро, дорсомедиальное ядро, туберальное магноцеллюлярное ядро, аркуатное или дугообразное ядро (иногда называется инфундибулярным ядром), паравентрикулярно-перивентрикулярное ядро. В срединной зоне гипоталамуса различают медиальную преоптическую область, медиальное преоптическое ядро, переднюю гипоталамическую область, паравентрикулярное ядро, вентромедиальное ядро, перифорникальное ядро, заднюю гипоталамическую область и медиальное мамиллярное (сосочковое) ядро. К латеральной зоне относят латеральную преоптическую область, латеральную гипоталамическую область и супраоптическое ядро. Экспериментальные исследования с выключением (разрушением) отдельных структур гипоталамуса и нарушением его нервных связей с другими отделами головного мозга позволили установить, что нервный контроль передней доли гипофиза осуществляется двумя механизмами (уровнями регуляции). Первый уровень регуляции реализует так называемая гипофизотропная область гипоталамуса, которая контролирует исходную (базальную) секрецию передней доли гипофиза и нейрогипофизарную секрецию. Второй, более высокий уровень обеспечивается другими гипоталамическими и внегипоталамическими областями мозга (гиппокамп, передний таламус, средний мозг и др.), которые принимают участие в стимуляции или угнетении функции гипофиза. Внегипоталамические структуры мозга осуществляют важный нейроэндокринный контроль деятельности гипофиза и ответственны за суточный ритм секреции гормонов. Средний мозг, гиппокамп и переднемедиальное таламическое ядро участвуют в регуляции секреции АКТГ, гонадотропинов, пролактина, гормона роста. Кроме того, в гипоталамус проецируются также восходящие афферентные и прямые связи из сетчатого образования и среднего мозга, где локализуются дофаминергические и другие клетки, секретирующие различные моноамины. Гипоталамус имеет богатую сеть кровеносных сосудов, которые в области срединного возвышения образуют портальную систему. Наиболее васкуляризированы супраоптическое и паравентрикулярное ядра. Гистологически область срединного возвышения представляет зону контактов, содержащую окончания многочисленных нейронов, локализованных в перечисленных ядрах гипоталамуса, по которым продукты секрета этих нейронов (гипофизотропные гормоны) достигают капилляров воротной (портальной) системы гипофиза. Венозные капилляры портальной системы имеют специальные отверстия (шунты), создающие возможность перехода соединений с достаточной молекулярной массой из крови в периваскулярные пространства срединного возвышения. Гипоталамус, таким образом, является областью, трасформирующей информацию, поступающую по нервным путям из вышележащих отделов нервной системы, посредством изменения уровня нейротрансмиттеров (нейромедиаторов), к которым относятся различные моноамины: адреналин, норадреналин, дофамин, серотонин, ацетилхолин, g-аминомасляная кислота. Стрессовые ситуации и другие факторы приводят к изменению содержания, скорости синтеза и высвобождения моноаминов в гипоталамусе, которые в свою очередь изменяют скорость секреции гипоталамических и гипофизотропных гормонов, что и приводит к соответствующему изменению функциональной активности передней доли гипофиза. Считается, что нейротрасмиттеры (моноамины) регулируют деятельность гипофиза посредством нескольких механизмов: а) участие в синаптической передаче информации, поступающей из лимбической системы мозга, на нейрон, продуцирующий гипофизотропные гормоны (пептиды); б) действие на мембрану гипоталамического нейрона и процесс высвобождения гипофизотропного гормона; в) изменение функциональной активности аксона гипоталамического нейрона в области капилляров портальной (воротной) системы гипофиза с модификацией транспорта гипофизотропного гормона в кровь; г) влияние на клетки передней доли гипофиза с увеличением или угнетением их секреторной активности или модификацией их ответа на действие гипофизотропных гормонов. Таким образом, гипоталамус является местом, где нервные и эндокринные клетки взаимодействуют друг с другом, осуществляя быструю и высокоэффективную передачу информации, необходимой для быстрого ответа со стороны органа, систем и организма в целом с целью обепечения жизнедеятельности организма. Передача информации от клетки к клетке осуществляется химическими мессенджерами (гормоны и моноамины) и электрической активностью. Межклеточные взаимодействия, как показали исследования последних лет, могут осуществляться следующими механизмами: синаптической передачей мессенджера; гормональным механизмом посредством циркулирующих гормонов; паракринным механизмом, т.е. без поступления гормона в кровь, а только в межклеточную жидкость; аутокринным механизмом, т.е. выходом гормона из клетки в межклеточную жидкость и взаимодействие этого гормона с мембранными рецепторами, расположенными на той же клетке. Показано, что норадреналин, соматостатин, дофамин, гонадолиберин, окситоцин, вазопрессин могут выступать в качестве гормонов и секретироваться эндокринными клетками или нейронами, а также выявляться в синапсах нервных клеток и выполнять роль нейротрансмиттеров. Другая группа гормонов – глюкагон, энкефалины, холецистокинин, производные проопиомеланокортина секретируются эндокринными клетками, выполняя гормональную функцию, а также, локализуясь в нервных окончаниях, оказывают нейротрансмиттерное действие. Причем эти два свойства выявляются и у других гормонов аденогипофиза. Тиролиберин и ВИП секретируются нейронами, но выполняют гормональную функцию, а в нервных окончаниях оказывают явное нейротрансмиттерное действие. Влияние ЦНС на функцию гипоталамуса осуществляется не только указанными выше нервными механизмами, но также путем транспорта спинномозговой жидкостью различных гормонов, нейротрансмиттеров и других веществ (эндорфины, энкефалины, вещество Р), вырабатывающихся в различных областях ЦНС и эпифизе. В эпифизе образуются мелатонин и ряд других индолов и полипептидов, модулирующих функцию надпочечников, щитовидной и половых желез. Гормоны эпифиза высвобождаются в спинномозговую жидкость или общий кровоток и действуют различными путями. Так, мелатонин концентрируется в гипоталамусе и среднем мозге и влияет на секрецию гипофизотропных гормонов, изменяя содержание моноаминов и нейромедиаторов. Другие полипептиды эпифиза действуют на образование гипофизотропных пептидов непосредственно. Необходимо отметить, что, помимо нейромедиаторов, в механизмах высвобождения гипофизотропных гормонов принимают обязательное участие ионы К+ и Са2+, простагландины, цАМФ и другие вещества.
56. Нейросекреторная функция гипоталамуса: либерины и статины. Функциональные связи гипоталамуса с гипофизом.
В среднем гипоталамусе располагаются нейросекреторные ядра, содержащие мелкие адренергические нейроны, которые вырабатывают аденогипофизотропные нейрогормоны - либерины и статины. С помощью этих олигопептидных гормонов гипоталамус контролирует гормонообразовательную деятельность аденогипофиза. Либерины стимулируют выделение и продукцию гормонов передней и средней долей гипофиза. Статины угнетают функции аденогипофиза. Нейросекреторная деятельность гипоталамуса испытывает влияние высших отделов головного мозга, особенно лимбической системы, миндалевидных ядер, гиппокампа и эпифиза. На нейросекреторные функции гипоталамуса сильно влияют также некоторые гормоны, особенно эндорфины и энкефалины. Гипоталамус и гипофиз находятся в тесной анатомической и функциональной связи, поэтому их рассматривают как единую систему. Рекомендуют даже выделять гипоталамо-адреногипофизар-ную систему. В гипоталамусе вырабатываются рилизинг-гормоны, стимулирующие или тормозящие гормоны адреногипофиза. В нейрогипофизе осуществляется накопление и выделение в кровь вазопрессина и окситоцина — гормонов, которые синтезируются в супраоптических и паравентрикулярных ядрах гипоталамуса. Эти гормоны называют нейрогормонами, а супраоптические, паравентрикулярные ядра гипоталамуса и нейрогипофиз рекомендуют называть гипоталамонейрогипофизарной железой внутренней секреции
Дата публикования: 2014-12-30 ; Прочитано: 880 | Нарушение авторского права страницы
Регуляция секреции гормонов [ править | править код ]
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Степень воздействия гормона на ткань-мишень пропорциональна его концентрации в крови. Содержание любого биологически активного гормона в системе кровообращения определяется сочетанием нескольких факторов. К этим факторам относятся:
- скорость секреции в кровь эндокринной железой;
- для некоторых гормонов, в частности тиреоидных, скорость активации (превращения Т4 в Т3) в крови;
- для липофильных гормонов, а именно стероидных и тиреоидных, степень связывания белками плазмы крови;
- скорость инактивации и удаления из крови (клиренса).
Из всех этих факторов первый — скорость секреции в кровь — является основным, определяющим содержание гормона в системе кровообращения, в частности в условиях отсутствия физической нагрузки (Sherwood, 2004).
Существуют два типа секреции гормона в кровь (Kelly, 1985). Конститутивная секреция представляет собой непрерывное выделение эндокринного вещества в кровь с некоторой базовой скоростью. При таком механизме секреции гормон выделяется клеткой по мере его синтеза, поскольку железа не способна его накапливать, поэтому при получении стимулирующего сигнала происходит увеличение активности синтеза и вновь синтезированный гормон выделяется непосредственно в кровяное русло путем пассивной диффузии через клеточную мембрану. Такой тип секреции характерен для стероидных и тиреоидных гормонов, которые по своим свойствам являются липофильными, как и плазматическая мембрана клетки. Конститутивная секреция регулируется изменениями уровня фосфорилирования белков, которые выступают в роли ферментов пути биосинтеза.
Регулируемая секреция представляет второй тип высвобождения гормона из эндокринной железы в кровь. В этом случае между скоростью синтеза белка и его высвобождением в кровь нет прямой зависимости, как в случае конститутивной секреции. Вместо этого эндокринные железы, которые способны к регулируемой секреции, обладают способностью накапливать синтезированный гормон. Следует отметить, что и в этом случае накопительные способности железистой клетки ограничены. На самом деле для любого отдельно взятого гормона его запас в эндокринных тканях редко превышает суточную потребность организма (Baulieu, 1990).
В случае регулируемой секреции стимулирующее воздействие приводит к высвобождению путем экзоцитоза накопленных везикул, содержащих гормон. В большинстве случаев для обеспечения постоянной готовности клеток к выделению гормона сигнал, вызывающий высвобождение гормона, активизирует ферментативные системы его синтеза. Обычно высвобождению запасенного гормона и активации синтетических процессов предшествует поступление в клетку ионов кальция. Такая регулируемая форма секреции наблюдается для белково-пептидных гормонов и катехоламинов.
Как при конститутивной, так и при регулируемой секреции гормонов стимулом, регулирующим скорость секреции, обычно является: 1) изменение в плазме концентрации питательных веществ или ионов; 2) выделение нейронами нейротрансмиттеров, воздействующих на эндокринные клетки; 3) связывание клеточными рецепторами гормонов, выделяемых другими эндокринными железами. Как правило, все эти события взаимосвязаны между собой определенным образом. С другой стороны, изменения в секреции гормонов обычно являются результатом воздействия нескольких факторов.
Ответ эндокринных желез на стимулирующее воздействие определяется чувствительной и эффективной системой обратной связи, которая передает информацию от ткани-мишени обратно к органу, выделяющему гормон. Наиболее распространенной формой регуляции скорости секреции в эндокринной системе является негативная обратная связь. Этот тип обратной связи можно наблюдать в случае, когда активность одной системы (эндокринная железа) модифицируется негативным образом, т. е. подавляется активностью другой системы (ткани-мишени), что позволяет поддерживать гомеостаз. Например, повышение концентрации глюкозы в крови стимулирует секрецию инсулина поджелудочной железой. Повышение содержания инсулина в крови способствует поглощению глюкозы мышечными клетками ткань-мишень для инсулина, а также превращению глюкозы в жир, результатом чего является нормализация содержания глюкозы в крови.
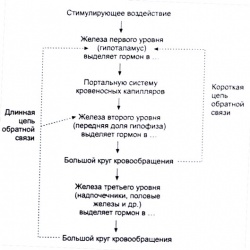
Существует несколько различных видов регуляции секреции гормонов путем негативной обратной связи. Управление секрецией нескольких важных гормонов осуществляет гипоталамо-гипофизарная система. Небольшой участок в основании мозга — гипоталамус — продуцирует несколько рилизинг-гормонов или либеринов, которые переносятся портальной системой кровеносных капилляров в переднюю долю гипофиза. В этом примере нейроэндокринной функции гипоталамус выделяет гормоны-либерины, которые, попадая в переднюю долю гипофиза, изменяют там скорость секреции ряда гормонов в систему кровообращения, которая обеспечивает их транспорт ко всем тканям организма. Эти гипофизарные гормоны могут оказывать непосредственное влияние на ткани-мишени, либо активировать железы третьего уровня этой системы регуляции, стимулируя секрецию их специфических гормонов в кровеносное русло.
Что касается негативной обратной связи, в этой нейроэндокринной системе можно выделить “короткую” и “длинную" регуляторные цепи (Vander et al., 2001). В качестве примера действия короткой цепи негативной обратной связи можно привести ситуацию, когда высокий уровень пролактина в крови детектируется гипоталамусом, в ответ на это там происходит выделение допамина, который направляется в гипофиз и ингибирует секрецию гипофизом пролактина в кровеносное русло. В случае системы, состоящей из трех органов, показано существование длинной петли обратной связи. В качестве иллюстрации такого механизма обратной связи рассмотрим регуляцию синтеза кортизола. Рассматриваемая система состоит из гипоталамуса, гипофиза и коры надпочечников. Гипоталамус выделяет кортиколиберин или кортикотропин-рилизинг-гормон (КРГ) в портальную систему кровеносных капилляров, по которой это вещество попадает в переднюю долю гипофиза. После связывания кортиколиберина с клеточными рецепторами гипофиз выделяет в кровеносное русло АКТГ, который по большому кругу кровообращения попадет к клеткам надпочечников. В тканях коры надпочечников (напомним, что мозговое вещество надпочечников продуцирует катехоламины) АКТГ индуцирует высвобождение в кровь кортизола, который оказывает специфическое воздействие на ткани-мишени печени, скелетных мышц и жировых отложений. В этом случае негативная регуляция наблюдается, когда повышение содержания кортизола в крови подавляет выделение АКТГ гипофизом и/или КРГ гипоталамусом. Этот пример показывает, насколько совершенной в эндокринной системе является интеграция подаваемых и принимаемых сигналов, которая позволяет регулировать секрецию гормонов в эндокринной системе из нескольких органов с помощью короткой и длинной цепей обратной связи (Vander et al., 2001).
Несмотря на то что негативная обратная связь является преобладающим механизмом регуляции, для изменения уровня секреции гормонов в организме используется также позитивная обратная связь. В случае позитивной обратной связи эндокринная железа, продуцирующая гормон, контролирует индуцированные этим гормоном изменения биологической активности ткани-мишени. Если ткань-мишень реагирует недостаточно интенсивно, эндокринная железа выделяет дополнительное количество гормона до тех пор, пока активность биологического процесса, который он регулирует, не достигнет адекватного уровня. Примером позитивной обратной связи является регуляция эндокринной функции во время родов. Окситоцин, выделяемый задней долей гипофиза, стимулирует сокращение матки. По мере прохождения родового процесса и увеличения потребности в более сильных родовых схватках активность матки сигнализирует гипофизу о потребности увеличения секреции окситоцина, что приводит к усилению силы и частоты сокращений матки и позволяет родам завершиться благополучно.
Хотя основной функцией эндокринной системы является поддержание гомеостаза, изменения внутренней среды организма и внешних условий не единственный регулятор секреции гормонов. Концентрация большинства гормонов в крови подвергается прогнозируемым флуктуациям или ритмическим колебаниям, происходящим на протяжении определенного периода времени. Наиболее хорошо изучены циркадные или суточные ритмы эндокринной системы. Циркадный ритм характеризует периодические колебания, происходящие в течение 24 ч солнечных суток, тогда как суточный ритм относится к колебаниям уровня секреции гормона, связанным со сменой дня и ночи. Часто эти термины используются как синонимы. Такие естественные, запрограммированные ритмы активности эндокринных желез поддерживаются супрахиазматическими ядрами гипоталамуса. Этот пейсмекер (ритмоводитель) регулирует секрецию гормонов на основании собственных внутренних часов и задаст специфический характер секреции для каждого гормона, например, содержание кортизола в крови выше всего утром, тогда как максимальное содержание гормона роста наблюдается в ночные часы (Illnerova ct al., 2000).
Наряду с суточными колебаниями уровня секреции гормонов, часто наблюдаются и регулярные пульсации с более коротким периодом, которые называются ультралианным ритмом и накладываются на циркадный ритм. Эти периодические повышения секреции гормонов, вероятно, являются следствием возрастания активности гипоталамуса и имеют важное физиологическое значение. Так, было показано, что при одном и том же общем количестве выделяемого гормона усвоение глюкозы было более эффективным в случае, когда кривая продукции инсулина имела волнообразный вил, по сравнению с ситуацией, когда его уровень в крови был постоянным (Porksen, 2002).
Известно также, что секреция гормонов изменяется и на протяжении года, хотя здесь основная масса данных была получена на животных. Годовые ритмы соответствуют изменению продолжительности светового дня, которая регистрируется шишковидной железой центральной нервной системы (Short, 1985). Эта железа, которую за фоточувствительность часто называют еще "третьим глазом", в ответ на изменение продолжительности светового дня регулирует количество выделяемого ею мелатонина (Tamarkin ct al., 1985). Другие сезонные изменения поведения, такие, как зимняя спячка, миграции и даже изменения окраски меха, управляются прогнозируемыми изменениями уровня мелатонина в крови. У человека усиление продукции мелатонина, происходящее при сокращении продолжительности светового дня, может вызывать изменения настроения и даже депрессию (Lcwy et al., 1987). Ранее было показано, что у всех млекопитающих, не исключая и человека, мелатонин играет главную роль в поддержании циркадных ритмов, оказывая влияние на клетки супрахиазматичсских ядер (Pcvct ct al., 2002).
Читайте также:


