Нервные волокна седалищного нерва лягушки
Препарат № 116. Мякотное нервное волокно (не фиксированное). Седалищный нерв лягушки (рис. 120)
Для изучения строения мякотного нервного волокна необходимо рассмотреть препараты № 116 и 117. Первый препарат дает общее представление о нервном волокне - о соотношении мякотной оболочки и аксона, о структуре перехватов Ранвье и насечек Лантермана (последние особенно хорошо видны на неокрашенном нерве).
Второй препарат (№ 117) следует рассмотреть специально с целью подробного исследования мякотной оболочки. Только при изучении данного препарата становится ясным, что оболочка нерва имеет синцитиальное строение.
Убивают лягушку, обезглавливая ее или разрушая спинной мозг, и прикрепляют препаровальными иглами к восковой ванночке, спинной стороной кверху. Разрезают кожу бедра, отодвигают ее и обнажают мышцы. Если осторожно раздвинуть мышцы, то становится виден седалищный нерв. Этот нерв имеет сравнительно большую толщину и белую окраску, благодаря чему хорошо заметен.
Для того чтобы изолировать седалищный нерв, удаляют загораживающие его мышцы, приподнимают нерв пинцетом и подрезают его в местах прикрепления. Затем разрезают нерв на куски длиной около 1 см и помещают в физиологический раствор. На предметном стекле в капле физиологического раствора нерв
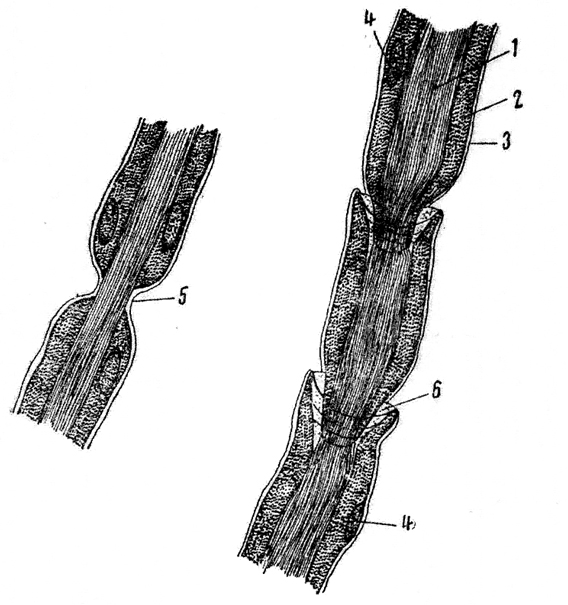
Рис. 120. Мякотное нервное волокно из седалищного нерва лягушки (увеличение - ок. 10, об. 40):
1 - аксон, 2-мякотяая оболочка, 3 - иейрилемма, 4 - шванновское ядро, 5 - перехват Ранвье, 6 -насечка Лантермава
тщательно расщипывают иголками в продольном направлении, покрывают покровным стеклом и рассматривают под микроскопом.
На препарате будет заметна группа нервных волокон разной толщины (отростки клеток). Следует наметить для наблюдения волокно, лежащее свободно и несколько изолированно от других волокон. При большом увеличении микроскопа сразу видно, что нервное волокно имеет центральную часть - осевой цилиндр, или аксон, и оболочку. Применяя иммерсионную систему, в осевом
цилиндре можно заметить слабую продольную исчерченность - это нейрофибриллы, идущие из тела нервной клетки и проходящие параллельно друг другу в осевом цилиндре. Оболочка, окружающая нерв, так называемая мякотная оболочка, содержит сильно преломляющее свет вещество-миелин. Миелин одевает осевой цилиндр не на всем его протяжёнии. В некоторых местах волокно сужается и образуются перетяжки, лишенные миелина, так называемые перехваты Ранвье. Расстояния между перехватами в разных нейритах различны. Следует внимательно рассмотреть перехват Ранвье. В нем не только прерывается миелиновая оболочка, но иногда сужается и сам осевой цилиндр. Кроме того, можно заметить, что в местах перехвата проходит непрерывная, очень тонкая, совершенно прозрачная оболочка - нейрилемма, которая покрывает с поверхности все нервное волокно; она плохо заметна вследствие незначительной толщины. Таким образом, нейрилемма вместе с миелином составляет мякотную оболочку нервного волокна.
Иногда в мякотной оболочке под нейрилеммой заметны шванновские ядра удлиненной формы.
Иммерсионная система дает возможность рассмотреть в нервном волокне особые образования - насечки Лантермана. В некоторых местах с обеих сторон миелиновой оболочки имеются светлые полоски, как бы надрезы, расположенные косо и направленные в ту или иную сторону. Вокруг этих надрезов иногда бывают заметны циркулярно расположенные тонкие волоконца. Каждая насечка, по-видимому, представляет собой протоплазматическую воронку, которая залегает в мякотной оболочке нерва.
Кроме мякотных волокон, в состав седалищного нерва входят и безмякотные нервные волокна (см. препарат № 118). Они отличаются тем, что значительно тоньше мякотных и не имеют, миелинозой оболочки.
При подсыхании препарата нерв претерпевает посмертные изменения. Мякотная оболочка становится неровной, миелин собирается в капли и часто вытекает из волокна.
В связи с тем, что не всегда имеется возможность получить свежий препарат нервного волокна, мы рекомендуем для изучения также и осмированный препарат.
Вырезают кусочек седалищного нерва лягушки способом, описанным выше. Осторожно расщипывают его иглами в продольном направлении и помещают на 20-30 мин в 1%-ный раствор осмиевой кислоты. Затем тщательно промывают препарат в дистиллированной воде в течение 30-40 мин. и помещают для окрашивания в пикрокармин или 2%-ный кислый фуксин на время от нескольких часов до суток. Обезвоживая нерв для заключения в бальзам, нужно еще раз дополнительно расщипать его в 96° спирте и в ксилоле. Можно приготовлять
непостоянные препараты, помещая нерв после окрашивания и промывания в глицерин.
Изучаемый препарат аналогичен предыдущему. Следует отметать только то, что мякотная оболочка здесь черная, так как миелин окрашивается осмием в черный цвет, шванновские ядра красные, а лантермановские насечки имеют вид светлых, косо расположенных полосок.
Тема. БИОЭЛЕКТРИЧЕСКИЕ ПОТЕНЦИАЛЫ. ПОТЕНЦИАЛ ДЕЙСТВИЯ НЕРВА.
Вопросы теоретической подготовки:
1. Строение смешанного нерва. Классификация нервных волокон, функции различных типов нервных волокон.
2. Потенциал действия. Динамика изменения ионной проницаемости. Двухфазный и монофазный ПД. Следовые потенциалы.
4. Критический уровень деполяризации. Причины абсолютной и относительной рефрактерности.
5. Зависимость пороговой силы раздражения от длительности стимула и характеризующие ее показатели (хронаксия, реобаза, полезное время).
6. Распространение ПД по немиелинизированному волокну. Кабельные свойства нервного волокна, теория локальных токов. Факторы, определяющие скорость проведения возбуждения по нервному волокну.
7. Особенности проведения возбуждения по миелинизированным нервным волокнам.
ЗАДАЧА. ПОТЕНЦИАЛ ДЕЙСТВИЯ СЕДАЛИЩНОГО НЕРВА ЛЯГУШКИ
Цели работы:
· зарегистрировать двухфазный и монофазный потенциалы действия;
· исследовать зависимость амплитуды пд от амплитуды раздражающего стимула;
· определить зависимость порога раздражения нерва от длительности стимула;
· измерить продолжительность периодов абсолютной и относительной рефрактерности
ПРИГОТОВЛЕНИЕ ПРЕПАРАТА СЕДАЛИЩНОГО НЕРВА ЛЯГУШКИ
Работа проводится на седалищном нерве (n. ischiadicus) лягушки, выделенном от позвоночника до коленного сустава. Лягушку обездвиживают обычным способом. Основные этапы приготовления препарата показаны на рис. 1.

Рис. 1. Приготовление препарата седалищного нерва лягушки. Описание в тексте.
Лягушку приподнимают ее за задние лапки таким образом, чтобы туловище и голова оказались внизу, при этом туловище сгибается и отчетливо вырисовывается позвоночник. Большими ножницами перерезают позвоночник приблизительно на уровне '/з от его нижнего конца (Рис. 1.1). Одновременно с этим удобно срезать с брюшной стороны часть кожи и свисающие вместе с ней внутренности.
Удерживая левой рукой остаток позвоночника, правой рукой захватывают край кожи, оставшейся со спинной стороны, и резким движением снимают кожу со спины и задних лапок (держать позвоночник и кожу удобнее всего кусочками марли или ваты) (Рис. 1.2).
После этого отрезают копчиковую кость — длинный отросток позвоночника (Рис. 1.3).
Задние лапки лягушки, освобожденные от кожи, кладут спинной стороной вниз на препаровальную ванночку, предварительно смоченную раствором Рингера. Оставшиеся внутренности (почки, семенники и др.) осторожно оттягивают пинцетом и отрезают малыми ножницами. После удаления внутренностей с правой и левой сторон от позвоночника отчетливо видны нервные сплетения седалищного нерва, выходящие из позвоночника каждый тремя корешками (Рис. 1.4).
Остаток позвоночника большими ножницами осторожно разрезают вдоль по средней линии и затем также осторожно, строго по средней линии разрезают лобковое сочленение и, таким образом, разъединяют лапки (по пунктирной линии на рис. 1.4).
Одну из лапок покрывают ватой, смоченной раствором Рингера, или отдают другой группе студентов. На другой лапке продолжают препаровку.
Стеклянным крючком слегка поднимают седалищное нервное сплетение и малыми ножницами подрезают вокруг него все ткани, отпрепаровывая нерв до тазобедренного сочленения (Рис. 1.5).
После этого препарат переворачивают спинной стороной вверх. На бедре видны полуперепончатая, двуглавая и трехглавая мышцы. Между двуглавой и перепончатой мышцами стеклянным крючком осторожно разрывают соединительнотканную пленку и, раздвинув эти мышцы, в глубине находят довольно толстый седалищный нерв, параллельно с которым идет бедренная артерия.
Нерв осторожно приподнимают стеклянным крючком (для того чтобы сильно не растянуть нерв, лучше брать его вместе с сосудом) и отпрепаровывают его до коленного сустава (Рис. 1.6), отрезая вокруг все мышечные ткани и подходящие к ним тонкие нервные веточки, отходящие от основного нервного ствола.
После того как нерв полностью отпрепарован, на его дистальный участок (около коленного сустава) накладывают лигатуру (Рис. 1.6).
Отрезают тазовую кость около позвоночника (Рис. 1.7).
Перерезают нерв между лигатурой и коленным суставом и выделяют нерв из тела лягушки (Рис. 1.8).
За лигатуру и часть позвоночника нерв переносят в специальную камеру с электродами (рис. 2). Первая пара электродов служит для нанесения раздражения - она соединена через изолирующий трансформатор с электростимулятором. Вторая пара электродов служит для внеклеточной регистрации ПД и соединена с входом осциллографа. Между этими парами электродов располагается электрод или пластинка заземления.
Препарат располагают в камере таким образом, чтобы его часть, содержащая больше волокон (около позвоночника), лежала на раздражающих электродах. На участок нерва, расположенный на заземляющем электроде, помещают маленький тампон, смоченный раствором Рингера. Дно камеры должно оставаться сухим, чтобы избежать закорачивания электродов. Камеру плотно закрывают крышкой.

Важным моментом в изучении функционирования нервной системы, как в рамках исследовательской, так и образовательной деятельности является регистрация биоэлектрической активности возбудимых тканей. Регистрация биопотенциалов может выполняться как инвазивным (при помощи игольчатых, или иных электродов, внедряемых непосредственно в исследуемые ткани и органы), так и не инвазивным способом – при помощи электродов, прикладываемых к поверхности кожи. Основным инструментом для этого до сих пор является усилитель биопотенциалов (УБП).
Серийно изготавливаемые усилители биопотенциалов зачастую достаточно дороги, что делает их малодоступными для исследовательских организаций в развивающихся странах. Например, нейрофизиологическое оборудование начального уровня обычно стоит более 3 тыс. долларов и требует основательной подготовки перед использованием [3].
Имеется ряд проектов по созданию доступных усилителей биопотенциалов самого различного назначения, например, для регистрации ЭМГ, ЭКГ, ЭЭГ, [10] так же существуют работы, посвященные созданию простых и компактных моделей УБП для микроэлектродной регистрации биопотенциалов методом patch-clamp [5] и экстраклеточной регистрации нейронной активности [2].
Одним из примеров недорогой и доступной системы для регистрации биопотенциалов является SpikerBox от компании Backyard Brains. Имеются версии как для записи поверхностной электромиографии, так и для регистрации экстраклеточной нейронной активности. Есть различные комплектации прибора – от полностью собранного и готового к работе устройства [9], до различных вариаций комплектов для самостоятельной сборки, представленных полным набором всех необходимых деталей, либо только готовой печатной платой [8]. Электронная схема данного усилителя биопотенциалов имеется в открытом доступе и доступна для самостоятельного воспроизведения даже для человека с начальными познаниями в электронике.
Несмотря на позиционирование данного устройства разработчиками в первую очередь для работы с беспозвоночными, большой интерес представляет потенциальная возможность регистрации нейронной активности позвоночных животных.
Цель данной работы – проверка возможности использования системы SpikerBox для экстраклеточной записи нейронной активности позвоночных животных.
В задачи данной работы входило:
1) Предварительное тестирование работоспособности SpikerBox на беспозвоночных по стандартным методикам, предлагаемым производителем.
2) Изготовление простых, совместимых со SpikerBox электродов, пригодных для использования на нервах позвоночных животных.
3) Проведение посредством SpikerBox экстраклеточной регистрации электрической активности волокон седалищного нерва лягушки при раздражении тактильных рецепторов
4) Выполнить сравнение характера сигнала, записанных нервных импульсов беспозвоночного и позвоночного животного.
Материалы и методы
Животные и подготовка препаратов для записи биопотенциалов
Беспозвоночные. Разработчиками приводится множество примеров использования SpikerBox в различных экспериментах и с различными беспозвоночными животными – дождевыми червями [6], кузнечиками [4], тараканами четырех различных видов - Blaberus discoidalis, Blaberus fusca, Americana periplaneta (Американский таракан), Gromphadorhina portentosa (Мадагаскарский шипящий таракан) [3].
В качестве объекта для тестирования на беспозвоночных в данной работе был выбран мадагаскарский шипящий таракан (Gromphadorhina portentosa). Данные насекомые легкодоступны, достаточно просты в содержании, при этом обладают значительными размерами, что облегчает проведение различных манипуляций над ними.
В качестве базового эксперимента с системой SpikerBox производителем предлагается экстраклеточная регистрация потенциалов действия при раздражении механочувствительной трихоидной сенсиллы на ноге таракана. [7], [3].
Порядок подготовки препарата ноги таракана был следующий:
1) Таракан анестезируется путем охлаждения в воде со льдом. Обездвиживание таракана является индикатором успешной анестезии.
2) Нога, включая бедро, отсекается при помощи ножниц.
3) Таракан возвращается в место содержания.
4) Нога двумя булавками-электродами фиксируется на пробковой подложке. Один электрод необходимо ввести в голень, имеющую достаточно крупные трихоидные сенсиллы, второй вводится в бедро. [7].
Позвоночные. В качестве представителя позвоночного была выбрана лягушка в силу простоты доступа к седалищному нерву и удобству манипуляций с ним. Так же использование в качестве объекта для работы с позвоночными животными лягушки укладывается в общую идеологию усилителя биопотенциалов SpikerBox – из всех позвоночных животных лягушка является одним из наиболее доступных и простых в содержании.
Подготовка препарата начиналась с обездвиживания лягушки путем разрушения головного и спинного мозга при помощи зонда. Кожа на задней конечности была рассечена продольным разрезом, при помощи стеклянных крючков был выделен седалищный нерв и зафиксирован на отдельной диэлектрической подложке из пенополистерола, после чего в нерв были введены электроды на расстоянии
1,5 см друг от друга. В процессе выделения нерва, а также при проведении эксперимента необходимо избегать контакта нерва с кожей лягушки, для предотвращения пересыхания нерва, каждые 5 минут выполнялось его увлажнение физиологическим раствором. Важным моментом являлось сохранение кожи на дистальной части конечности лягушки, поскольку планировалось регистрировать сигнал от расположенных в ней тактильных рецепторов.
Аппаратная и программная часть.
В качестве усилителя биопотенциалов использовался SpikerBox производства Backyard Brains. При помощи экранированного кабеля SpikerBox был подключен к микрофонному входу аудиоплаты ноутбука, для записи, графического отображения и изучения сигнала использовалась свободная программа для работы с аудиофайлами – Audacity. Так же выполнялось звуковое дублирование сигнала. Во-избежание синфазной помехи 50Гц от сети питания, в момент записи биопотенциалов ноутбук отсоединялся от неё и работал от батареи.
Использовались игольчатые электроды двух типов – стандартные электроды SpikerBox - для работы с препаратом ноги таракана, диаметром 0,6 мм, и модифицированные электроды, обладающие меньшим диаметром – для работы с препаратом седалищного нерва лягушки. Достижение приемлемой толщины электродов для работы с седалищным нервом осуществлялось при помощи электролитической заточки. Обе версии электродов были изготовлены из нержавеющей стали.
Выполнение регистрации и записи биопотенциалов.
В обоих случаях регистрировались сигналы от тактильных рецепторов – трихоидных сенсилл у таракана и тактильных рецепторов кожи задней конечности лягушки. Чувствительные рецепторы стимулировались при помощи щупов, изготовленных из диэлектрического материала - дерева. На ноге таракана выполнялось отклонение сенсилл, расположенных рядом с электродом, введенным в голень. Тактильные рецепторы лягушки стимулировались путем нанесения щупом штрихообразных раздражений кожи внутренней стороны дистальной части задней конечности. В режиме реального времени сигнал отображался на мониторе компьютера в окне программы Audacity, а также в звуковой форме выводился на динамики.
Беспозвоночные. При отклонении трихоидной сенсиллы на ноге таракана деревянным щупом, наблюдались пачки нервных импульсов, отчетливо выделяющиеся по амплитуде и характеру на фоне шума, и по частоте следования превосходящие фоновую активность. При анализе записи можно было отчётливо выделить одиночные потенциалы действия. Полученные данные были аналогичны таковым, описанными производителем [3], что говорит о работоспособности усилителя биопотенциалов SpikerBox, правильной подготовке препарата и выполнении записи сигналов.
Позвоночные. В момент нанесения штриховых раздражений на кожу лягушки при помощи деревянного щупа, как и при воздействии на сенсиллу ноги таракана, появлялись пачки импульсов, выделяющиеся на фоне шума как по амплитуде, так и своим характером (см. рис.1).
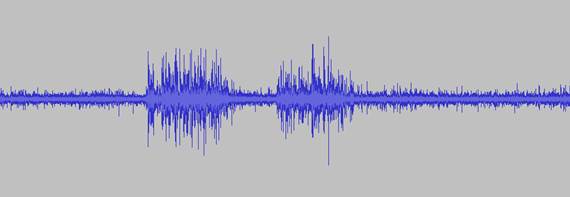
Рис.1. Запись электрической активности седалищного нерва лягушки
При этом, при работе с седалищным нервом лягушки выделить отдельные импульсы было несколько сложнее, чем при работе с препаратом ноги таракана, поскольку, в отличие от трихоидных сенсилл насекомых, зачастую иннервируемых одиночными нейронами [1], на коже лягушки единовременно активировалось большое количество рецепторов, в результате чего, неизолированные электроды получали электрические импульсы одновременно от большого количества чувствительных волокон седалищного нерва.
Выводы. Проанализировав записанную электрическую активность седалищного нерва лягушки в покое и при нанесении штриховых механических раздражений на кожу задней конечности, а, так же сопоставив её с записью электрической активности чувствительного нейрона трихоидной сенсиллы ноги таракана, можно сделать ряд выводов:
1) SpikerBox является устройством, принципиально применимым при записи биопотенциалов не только беспозвоночных, но и позвоночных животных.
2) Выполнение записи биопотенциалов нервных волокон позвоночных не представляет большой сложности и так же доступно, как и работа с беспозвоночными, хоть и требует ряд дополнительных навыков.
3) Процесс работы с позвоночными так же нагляден, как и с беспозвоночными - в процессе регистрации четко отслеживается причинно-следственная связь между раздражением тактильных рецепторов и всплесками электрической активности чувствительных нейронов.
4) Из предыдущего пункта следует, что SpikerBox применим в учебном процессе при изучении физиологии возбудимых тканей позвоночных.
В дальнейшем планируется использовать SpikerBox с более совершенными изолированными электродами, позволяющими выполнять более селективную запись сигналов с отдельных волокон для проведения более сложных экспериментов с нервной системой позвоночных.

Актуальным является разработка метода оценки параметров распространения возбуждения в нервных стволах и, в частности, в седалищном нерве лягушки.
В настоящее время существует ряд методов регистрации распространения возбуждения в нервах. Каждый из них имеет свои преимущества и недостатки. Так, наряду с традиционной нейрографией, широко используются методы компьютерного картирования с применением многоэлектродных матриц - щёток, погружаемых в нервный ствол [9. 10]. Недостатком таких методов является небольшая разрешающая способность, связанная с несоответствием размера нервных волокон и электроддов [7].
Этот недостаток устраняется методами флуоресцентной визуализации. При флуоресцентной визуализации внешний свет определенной длины возбуждает флуоресцентные молекулы-мишени, способные в ответ испускать фотоны с большей длиной волны, регистрируемые детектором. Возможна детекция флуоресценции как от эндогенных молекул, так и от искусственно внедренных белков и флуорофоров [4, 8].
В частности, для изучения распространения возбуждения используется метод флуоресцентной визуализации - метод оптического потенциала. Наряду с преимуществами, метод оптического потенциала имеет ряд недостатков. Он позволяет осуществлять регистрацию только с поверхности органа. Флуоресцентные зонды оказывают влияние на ткани, метод дорогостоящий [3].
Другой разновидностью люминесцентной визуализации является свечение в высокочастотном электрическом поле [1]. Ранее при помощи высокочастотного электрического поля выполнены работы по визуализации распространения возбуждения в венозном синусе, в беременной матке [5], в желудке [2]. Визуализация распространения возбуждения в седалищном нерве в высокочастотном электрическом поле не изучалась.
Цель исследования - создать и апробировать метод визуализации распространения возбуждения в седалищном нерве лягушки в высокочастотном электрическом поле.
Материалы и методы исследования
Результаты исследования и их обсуждение
В высокочастотном электрическом поле вне раздражения седалищного нерва лягушки в нерве наблюдали краевое свечение - эффект Кирлиан.
При раздражении седалищного нерва одиночными импульсами с частотой 1 Гц наблюдали мышечные сокращения лапки лягушки. Порог раздражения составлял 0,6±0,1 В.
При стимуляции нерва одиночными импульсами в нерве появлялись очаги внутреннего свечения. При прекращении стимуляции они исчезали.
При раздражении центрального конца нерва возбуждение распространялось в сторону мышцы.
Компьютерная программа по одинаковости интенсивности свечения выделяла 6 проекций очагов свечения.
Очаги свечения и их проекции различались по площади (таблица 1).
Как видно из таблицы 1. наибольшую площадь из очагов свечения, движущихся к спинному мозгу, имеет очаг, соответствующий по скорости волокнам Aα, затем AÝ и Aß. Наименьшую площадь - очаг свечения волокон группы B.
Если исходить из того, что площадь очага свечения отражает количество вовлекаемых в процесс возбуждения волокон, то больше всего возбуждается Aα волокон и меньше волокон группы B седалищного нерва лягушки.
Сопоставление площадей светящихся очагов, движущихся в сторону спинного мозга и их проекций в седалищном нерве лягушки при его стимуляции электрическими импульсами (М±m)
Группы волокон по скорости проведения очагов свечения
Препарат 1.Миелиновые нервные волокна. Седалищный нерв лягушки. Обработка осмиевой кислотой.
При малом увеличении видны отдельные и собранные в пучки миелиновые нервные волокна. Надо выбрать отдельно лежащее, не поврежденное после расщипывания нерва миелиновое волокно и просмотреть его по всей длине. Толщина его неодинакова. Через некоторые интервалы оно многократно истончается, образуя на поверхности короткие узловые перехваты, или перехваты Ранвье. Надо изучить строение участка миелинового волокна с перехватом Ранвье при большом увеличении. Миелиновое нервное волокно состоит из сравнительно толстого, светлого осевого цилиндра (1), занимающего его центральную часть. Осевой цилиндр может быть аксоном двигательного или дендритом чувствительного нейрона. Он одет миелиновой оболочкой (2), интенсивно окрашенной осмиевой кислотой в темно-коричневый цвет. Эта оболочка образована леммоцитами — клетками, гомологичными олигодендроцитам центральной нервной системы. Леммоциты (3) располагаются цепочками. Их границы соответствуют перехватам Ранвье (4). Отрезок миелинового волокна, заключенный между перехватами, называют сегментом (междоузлием); его оболочка представлена одной глиальной клеткой с ядром (5), лежащим в ее наружной части, приблизительно в центре сегмента. Миелиновая оболочка имеет светлые, в виде косых линий структуры — насечки нервного волокна, или насечки Шмидта—Лантермана (6).
Электронная микроскопия показала, что эти насечки являются прослойками цитоплазмы между завитками мезаксона. В области контакта леммоцитов миелиновая оболочка прерывается, нервное волокно суживается, образуя перехват Ранвье. Область перехвата имеет большое значение для доступа к осевому цилиндру необходимых веществ, находящихся в тканевой жидкости. Поверхность нервного волокна покрыта тонкой соединительной мембраной. В оболочке миелинового нервного волокна различают внутренний толстый и наружный (7) тонкий слой, состоящий из цитоплазмы леммоцитов и их ядер. Проведение импульса по нервному волокну связано с функцией аксолеммы. Миелиновые нервные волокна характеризуются быстрым и точным проведением нервных импульсов, что объясняют относительной толщиной осевого цилиндра, наличием перехватов Ранвье и сильным развитием миелинового слоя. Миелиновые нервные волокна обычно располагаются пучками, входят в состав периферических нервов или образуют белое вещество—проводящие пути спинного и головного мозга. Миелиновые волокна центральной нервной системы имеют оболочку, образованную олигодендроцитами. В них отсутствуют перехваты Ранвье, насечки Шмидта—Лантермана и соединительнотканная базальная мембрана, поскольку роль соединительной ткани в мозге выполняет нейроглия, в частности олигодендроглия. Физиологическая регенерация леммоцитов обеспечивается процессами, происходящими в активном центре — перикарионе нервной клетки. Синтезируемые вещества (в частности, белки) и образующиеся органеллы (митохондрии) непрерывно оттекают вместе с нейроплазмой по аксону. Разрушившиеся в процессе функциональной активности нейрона завитки мезаксона заменяются новыми в результате синтетических процессов в леммоцитах. В случае нарушения, задержки или прекращения синтетических процессов в леммоцитах разрушение миелиновых пластинок продолжается, а замена новыми отсутствует. Следствием этого является демиелинизация нервных волокон, сопровождающаяся тяжелейшими расстройствами их функции. Репаративная регенерация миелинового нервного волокна возможна только при сохранности тела нейрона.
Препарат 2. Безмиелиновые нервные волокна. Симпатический нерв. Окраска гематоксилином и эозином.
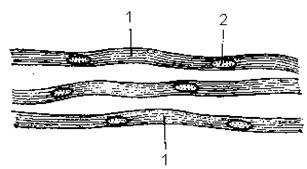 |
При малом увеличении надо выбрать расщипанные пучки нервных волокон и изучить строение нервного волокна при большом увеличении. Безмиелиновое нервное волокно значительно тоньше миелинового и, как показывает название, не имеет миелиновой оболочки. Оно состоит из тонких осевых цилиндров (1), являющихся нейритами двигательных или вставочных нейронов и леммоцитов (шванновских клеток), располагающихся цепочкой. Световая микроскопия не выявляет границ шванновских клеток и их отношений с осевыми цилиндрами. Безмиелиновая оболочка видна как однородный тяж цитоплазмы, содержащей ядра (2) овальной формы, одевающей несколько осевых цилиндров. Цитоплазма леммоцитов образует шванновскую оболочку. Снаружи нервное волокно одето соединительнотканной базальной мембраной. Осевые цилиндры располагаются рыхло и переходят в. соседние безмякотные волокна. Они не изолированы так тщательно, как в мякотных нервных волокнах, что связано с особенностями иннервации внутренних органов. Электронная микроскопия дает представление об иных, чем в миелиновом волокне, морфофункциональных отношениях осевых цилиндров и леммоцитов. Осевые цилиндры (1), принадлежащие различным нейронам, погружаются в цитоплазматический тяж, образованный леммоцитами (2), оболочка которых (3) охватывает их и образует складки (4). На дне этих складок располагаются отростки нейронов. Последние отграничены от цитоплазмы (5) леммоцитов как их собственной мембраной, так и мембраной шванновской клетки. Ядра (6) леммоцитов располагаются центрально. Физиологическая регенерация безмиелинового волокна обеспечивается процессами, происходящими в теле нейрона и в леммоцитах (внутриклеточная физиологическая регенерация). Репаративная регенерация возможна лишь при сохранности тела нейрона.
При малом увеличении (А) видна поверхность нерва, покрытая соединительнотканной оболочкой — эпиневрием (1), в котором находятся кровеносные сосуды (2) и жировые клетки (3). Плотная соединительная ткань
делит нервы на отдельные пучки различной величины, округлой или овальной формы. От оболочки нервного пучка — периневрия (4) идут прослойки рыхлой соединительной ткани, окружающей группы и отдельные нервные волокна. Соединительнотканные образования внутри нервного пучка называются эндоневрием (5). Пучки состоят из нервных волокон, в состав которых входят длинные отростки различных в функциональном и морфологическом отношении нейронов. Нервные волокна располагаются не строго параллельно и оказываются перерезанными поперек (6) и косо. Надо изучить строение нервных волокон в поперечном сечении при большом увеличении (Б). Нервные волокна отличаются толщиной, цветом и строением. В наиболее толстых миелиновых волокнах различают миелиновую оболочку (1), имеющую вид периферически расположенного черного кольца, и внутреннюю светлую часть, представленную осевым цилиндром (2). Миелиновая оболочка нервных волокон, лежащих в центральных отделах пучка, может быть бесцветной или светло-серого цвета, что объясняется неравномерным проникновением осмиевой кислоты при фиксации. Иногда видна в виде тонкого ободка цитоплазма (3) шванновских клеток, свободная от миелина. Попавшие в срез ядра (4) леммоцитов округлой формы прилежат к миелиновой оболочке. Встречаются безмиелиновые волокна (5); в светлой цитоплазме их леммоцитов иногда видны осевые цилиндры в виде мелких точек.
Дата добавления: 2015-09-04 ; просмотров: 2369 . Нарушение авторских прав
Читайте также:


