Промежуточные филаменты нервных клеток
Промежуточные филаменты – характерная структура эукариотических клеток. Они обладают способностью к самосборке и являются химически устойчивыми. Строение и функции промежуточных филаментов определяются особенностями связей в белковых молекулах. Они служат не только для формирования клеточного каркаса, но и обеспечивают взаимодействие органелл.
Общее описание
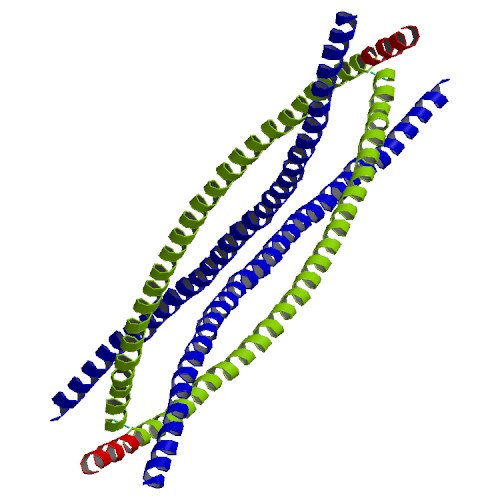
Филаменты – это белковые структуры нитчатого вида, которые принимают участие в построении цитоскелета. В соответствии с диаметром их делят на 3 класса. Промежуточные филаменты (ПФ) имеют среднюю величину в поперечном разрезе – 7-11 нм. Они занимают промежуточное положение между микрофиламентами Ø5-8 нм и микротрубочками Ø25 нм, за что и получили свое название.
Различают 2 типа этих структур:
- Ламиновые. Они находятся в ядре. Ламиновые филаменты есть у всех животных.
- Цитоплазматические. Располагаются в цитоплазме. Имеются у нематод, моллюсков, позвоночных. У последних в некоторых видах клеток могут отсутствовать (например, в глиальных клетках).
Местонахождение

Промежуточные филаменты являются одним из основных элементов цитоскелета живых организмов, клетки которых содержат ядра (эукариоты). У прокариотов также встречаются аналоги этих фибриллярных структур. В клетках растений они не найдены.
Большая часть филаментов находится в околоядерной зоне и пучках фибрилл, которые располагаются под плазматической мембраной и отходят от центра к краям клеток. Особенно их много в тех видах, которые подвергаются механическим нагрузкам – в мышечных, эпителиальных, а также в клетках нервных волокон.
Типы белков

Как показывают исследования, белки, входящие в состав промежуточных филаментов, различают в зависимости от вида клеток и стадии их дифференцировки. Однако все они являются родственными.
Белки промежуточных филаментов делят на 4 типа:
- Кератины. Они образуют полимеры из двух подтипов – кислых и нейтральных. Молекулярная масса этих соединений колеблется в интервале 40 000-70 000 а. е. м. В зависимости от тканевого источника число разнообразных гетерогенных форм кератинов может достигать нескольких десятков. Их подразделяют на 2 группы по изоформе – эпителиальные (наиболее многочисленные) и роговые, из которых состоят волосы, рога, ногти и перья животных.
- Во втором типе объединяют 3 вида белков, имеющих практически одинаковую молекулярную массу (45 000-53 000 а. е. м.). К ним относятся: виментин (соединительная ткань, плоские клетки, выстилающие поверхность кровеносных и лимфатических сосудов; клетки крови); десмин (мышечная ткань); периферин (периферические и центральные нейроны); глиальный фибриллярный кислый протеин (высоко специфичный белок мозга).
- Белки нейрофиламентов, встречающиеся в нейритах – цилиндрических отростках, по которым проходят импульсы между нервными клетками.
- Белки ядерной ламины, подстилающей ядерную мембрану. Они являются предшественниками всех остальных ПФ.
Промежуточные филаменты могут состоять из нескольких видов вышеперечисленных веществ.
Свойства
Характеристики ПФ определяются следующими их особенностями:
- большое число полипептидных молекул в поперечном сечении;
- сильные гидрофобные взаимодействия, играющие важную роль в сборке макромолекул по типу скрученной суперспирали;
- образование тетрамеров с высоким электростатическим взаимодействием.
В результате промежуточные филаменты приобретают свойства прочного скрученного каната – они хорошо гнутся, но не рвутся. При обработке реагентами и сильными электролитами эти структуры последними переходят в раствор, то есть для них характерна высокая химическая стабильность. Так, после полной денатурации белковых молекул в мочевине филаменты могут самостоятельно собираться. Белки, привнесенные извне, быстро встраиваются в уже существующую структуру данных соединений.
Структура

По своему строению промежуточные филаменты представляют собой неветвящиеся полимеры, которые способны как к образованию высокомолекулярных соединений, так и к деполимеризации. Их структурная неустойчивость помогает клеткам изменять свою форму.
Несмотря на то что филаменты имеют разнообразный состав по типу белков, у них существует один и тот же план строения. В центре молекул находится альфа-спираль, имеющая форму правозакрученной винтовой линии. Она образована за счет контактов между гидрофобными структурами. В ее структуре находятся 4 спиральных сегмента, разделенных короткими не спиральными участками.
На концах альфа-спирали расположены домены с неопределенной структурой. Они играют важную роль в сборке филаментов и взаимодействии с клеточными органеллами. Их размеры и белковая последовательность сильно варьируются среди разных видов ПФ.
Строительный белок
Основным строительным материалом для ПФ являются димеры – сложные молекулы, составленные из двух простых. Обычно они включают 2 разных белка, соединенных между собой палочковидными структурами.
Цитоплазматический тип филаментов состоит из димеров, которые образуют нити толщиной в 1 блок. Так как они расположены параллельно, но в противоположном направлении, то полярность отсутствует. Из этих димерных молекул впоследствии могут сформироваться более сложные.
Функции

Основными функциями промежуточных филаментов являются следующие:
- обеспечение механической прочности клеток и их отростков;
- адаптация к стрессовым факторам;
- участие в контактах, обеспечивающих прочное соединение клеток (эпителиальная и мышечная ткань);
- внутриклеточное распределение белков и органелл (локализация аппарата Гольджи, лизосом, эндосом, ядер);
- участие в транспортировке липидов и передаче сигналов между клетками.
ПФ также оказывают влияние на функции митохондрий. Как показывают лабораторные эксперименты на мышах, у тех особей, которые лишены гена десмина, нарушается внутриклеточное расположение этих органелл, а сами клетки запрограммированы на меньший срок жизни. В результате снижается потребление кислорода тканями.
С другой стороны, присутствие промежуточных филаментов способствует снижению подвижности митохондрий. Если в клетку ввести искусственно виментин, то можно восстановить сеть ПФ.
Значение в медицине
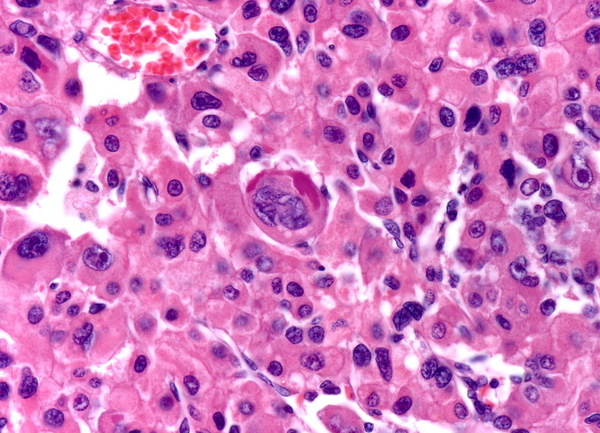
Нарушения синтеза, накопления и структуры ПФ приводит к возникновению некоторых патологических состояний:
- Образование гиалиновых капель в цитоплазме клеток печени. По-другому они называются тельцами Мэллори. Эти структуры представляют собой белки ПФ эпителиального типа. Они образуются при длительном влиянии алкоголя (острый алкогольный гепатит), а также в результате нарушения метаболических процессов при первичном гепатоцеллюлярном раке печени (у больных вирусным гепатитом В и циррозом), при застое желчи в печени и желчном пузыре. Алкогольный гиалин обладает иммуногенными свойствами, что предопределяет развитие системной патологии.
- При мутациях генов, отвечающих за выработку кератинов, возникает наследственное кожное заболевание – буллезный эпидермолиз. При этом происходит нарушение прикрепления наружного слоя кожи к базальной мембране, отделяющей его от соединительной ткани. В результате образуются эрозии и пузыри. Кожа становится очень чувствительной к малейшим механическим повреждениям.
- Формирование сенильных бляшек и нейрофибриллярных клубков в клетках головного мозга при болезни Альцгеймера.
- Некоторые виды кардиомиопатии, связанные с избыточным накоплением ПФ.
Надеемся, что наша статья ответила на все ваши вопросы.
• Промежуточные филаменты представляют собой основные компоненты ядерного и цитоплазматического цитоскелета
• Промежуточные филаменты необходимы для поддержания правильной структуры тканей и их функционирования
• По диаметру промежуточные филаменты находятся между актиновыми филаментами и микротрубочками и образуют прочные сети
• Промежуточные филаменты представляют собой полимеры, состоящие из белковых субъединиц
• Белки, из которых состоят промежуточные филаменты, гетерогенны и кодируются семейством больших и сложно устроенных генов
• У человека более 50 болезней обусловлены возникновением мутаций в белках промежуточных филаментов
Микротрубочки, актиновые филаменты (микрофиламенты) и промежуточные филаменты представляют собой три основные системы белковых филаментов, составляющих цитоскелет. Промежуточные филаменты образуют в цитоплазме и ядре сеть и присутствуют во всех клетках метазоа (животных).
В отличие от микротрубочек и актиновых филаментов, которые необходимы даже для выживания изолированных клеток in vitro, основная функция промежуточных филаментов проявляется на уровне тканевой организации, где они необходимы для надлежащего функционирования тканей и органов. Некоторые типы промежуточных филаментов участвуют в скреплении клеток друг с другом, что необходимо для формирования тканей.
Белки промежуточных филаментов кодируются несколькими большими семействами генов. Эти белки образуют сложную систему филаментов, на долю которых в клетке в нормальных физиологических условиях приходится до 80% общего клеточного белка. Внутриклеточное распределение промежуточных филаментов отличается от характерного для актиновых филаментов и микротрубочек.
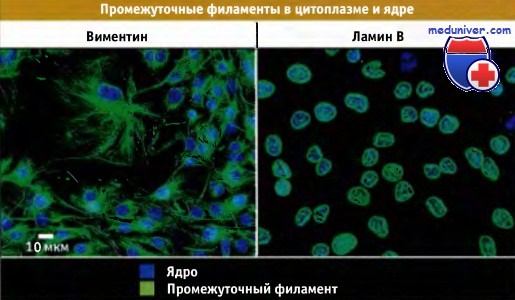
Распределение различных типов промежуточных филаментов в культивируемых фибробластах.
Иммунофлуоресцентное окрашивание на виментин и ламин В. Виментин находится в цитоплазме, а ламины в ядре.
Белки промежуточных филаментов характеризуются общей молекулярной структурой и полимеризуются в филаменты, обладающие высокой механической прочностью. В электронном микроскопе они выглядят одинаково. У высших позвоночных семейство соответствующих белков организовано наиболее сложно, и этот вопрос будет рассмотрен в настоящей главе.
Похожие промежуточные филаменты также обнаружены у беспозвоночных, однако у них количество генов, кодирующих соответствующие белки, значительно меньше, чем у позвоночных. Также промежуточные филаменты беспозвоночных менее гетерогенны и обладают меньшей тканевой специфичностью, чем у млекопитающих. В геноме человека находится порядка 70 генов, кодирующих белки промежуточных филаментов. Принимая во внимание альтернативный сплайсинг для пары из них, общее количество этих белков приближается к 75.
Они представлены гораздо большим числом вариантов и более гетерогенны, чем актиновые или тубулиновые белки. Для всех белков промежуточных филаментов характерна тканеспецифическая экспрессия. Также их экспрессия изменяется в процессе дифференцировки.
Большинство сведений, касающихся экспрессии и биохимических свойств промежуточных филаментов, были получены до того, как были установлены их функции и связь с некоторыми заболеваниями. Сейчас показано, что мутации в генах белков промежуточных филаментов связаны с многими генетическими заболеваниями, которые характеризуются различными фенотипическими проявлениями. Они включают по меньшей мере 50 отдельных болезней, от фликтены до прогерии.
Почти все типы генов белков промежуточных филаментов связаны с той или иной формой проявления хрупкости тканей. Это позволяет предполагать, что для функционирования ткани in vivo необходима надлежащая механическая прочность и что в значительной степени она прямо или опосредованно связана с промежуточными филаментами. Принимая во внимание, что экспрессия генов белков промежуточных филаментов носит тканеспецифический характер, весьма возможно, что все эти белки придают клеткам тканей мельчайшие оттенки различия. Клеткам тканей необходимы различные свойства, такие как прочность, пластичность, быстрота сборки и разборки структур, обеспечивающих прочность.
Может быть, в этом кроется причина того, что в ходе эволюции возникло столь много генов, кодирующих белки промежуточных филаментов.

Основные компоненты цитоскелета в электронном микроскопе.
На ультратонком срезе клетки эпителия почки видны актиновые микрофиламенты, промежуточные филаменты К8/К18 и микротрубочки.
Промежуточные филаменты (ПФ) строятся из фибриллярных мономеров. Поэтому основная конструкция промежуточных филаментов напоминает канат, имеющий толщину около 8-10 нм. Они локализуются главным образом в околоядерной зоне и в пучках фибрилл, отходящих к периферии клеток и располагающихся под плазматической мембраной (рис. 238, 240, 241). Встречаются промежуточные филаменты во всех типах клеток животных, но особенно обильны в тех, которые подвержены механически воздействиям: клетки эпидермиса, нервные отростки, гладкие и исчерченные мышечные клетки. В клетках растений ПФ не обнаружены.
В состав промежуточных филаментов входит большая группа изобелков, родственных белков, которую можно разделить на четыре типа. Первый – кератины, кислые и нейтральные, встречающиеся в эпителиальных клетках; они образуют гетерополимеры из этих двух подтипов. Кератины, кроме того, имеют некоторую гетерогенность, зависящую от тканевого источника. Так, в эпителиях встречается до 20 форм кератинов, 10 форм других кератинов найдено в волосах и ногтях. Молекулярный вес кератинов колеблется от 40 до 70 тыс.
Второй тип белков ПФ включает в себя три вида белков, имеющих сходный молекулярный вес (45-53 тыс.). Это – виментин, характерный для клеток мезенхимного происхождения, входящий в состав цитоскелета клеток соединительной ткани, эндотелия, клеток крови. Десмин – характерен для мышечных клеток, как гладких, так и исчерченных. Глиальный фибриллярный белок входит в состав ПФ некоторых клеток нервной глии – в астроциты и некоторые Шванновские клетки. Периферин – входит в состав периферических и центральных нейронов.
Третий тип – белки нейрофиламентов (мол. вес от 60 до 130 тыс.) встречается в аксонах нервных клеток.
И наконец, четвертый тип – белки ядерной ламины. Хотя эти последние имеют ядерную локализацию, они сходны по строению и свойствам со всеми белками промежуточных филаментов.
Как уже говорилось, промежуточные филаменты, построены из фибриллярных белков наподобие каната. При этом некоторые белки могут образовывать сополимеры, например виментин с десмином, или виментин с глиальными белками.
Все белки промежуточных филаментов обладают сходной аминокислотной последовательностью из 130 остатков в центральной части фибриллярной молекулы, которая обладает a-спиральным строением. Концевые же участки молекул имеют разные последовательности аминокислот, разную длину, и не имеют a-спирального строения. Наличие протяженных a-спиральных участков позволяет двум молекулам образовывать двойную спираль, подобно тому, что приводит к образованию палочковидного димера, длиной около 48 нм. Два димера, объединяясь бок о бок, образуют короткий протофиламент, тетрамер, толщиной около 3 нм. Такие протофиламенты могут объединяться в более толстые и длинные фибриллы и в конечном итоге в промежуточный полный филамент, состоящий из 8 продольных протофиламентов (рис. 242).
Иначе полимеризуются белки ядерной ламины: они образуют димеры с головками на одном конце и полимеризуются, образую рыхлую прямоугольную решетку. Такие слои ламины быстро разрушаются во время митоза при фосфорилировании ламинов.
Цитоплазматические промежуточные филаменты относятся к самым стабильным и долгоживущим элементам цитоскелета. Однако in vivo наблюдается включение инъецированных меченых молекул кератина в состав ПФ эпителиальных клеток. ПФ устойчивы к действию солей низкой и высокой концентрации, разрушаются только после воздействия денатурирующих растворов, таких как мочевина.
Такая структура и химическая устойчивость промежуточных филаментов, вероятно, определяет и их физическую устойчивость. Они служат как бы истинно опорной системой в клетках подвергающихся значительным физическим нагрузкам. В клетках кожного эпидермиса промежуточные филаменты образуют пучки (тонофиламенты), связанные с десмосомами, и создают жесткую внутриклеточную сеть (рис. 243). Так, в нервных аксонах, простирающихся на многие десятки сантиметров, ПФ или нейрофиламенты создают жесткую основу, обеспечивающую гибкость и целостность тонких цитоплазматических отростков нервных клеток. В поперечно исчерченных мышечных клеток десминовые филаменты входят в состав z-дисков и связывают их друг с другом как в составе саркомера, так и в соседних миофибриллах, а также с плазматической мембраной.
Специфических ингибиторов полимеризации белков промежуточных филаментов пока еще не найдено. Поэтому остается неясным сам процесс сборки и разборки этих элементов цитоскелета в живой клетке. Вероятнее всего, что они подобно ламинам деполимеризуются при действии цитоплазматических киназ, приводящих к их фосфорилированию. Выделенные промежуточные филаменты под действием фосфорилаз могут распадаться на мономеры, деполимеризоваться.
Топографически в клетке расположение промежуточных филаментов повторяет расположение микротрубочек, они как бы идут бок о бок. При разрушении микротрубочек колхицином, происходит т.н. колапс промежуточных филаментов: они собираются в плотные пучки или кольца вокруг ядра. Восстановление новой сети промежуточных филаментов начинается от зоны клеточного центра. Это наводит на мысль, что центром их полимеризации или нуклеации могут быть центры, общие с микротрубочками.
Глава 21.Микрофиламенты
Общие свойства микрофиламентов.
Микрофиламенты встречаются во всех клетках эукариот. Особенно они обильны в мышечных волокнах и клетках – высокоспециализированных клетках, выполняющих функции сокращения мышц. Микрофиламенты (МФ) входят также в состав специальных клеточных компонентов, таких как микроворсинки, ленточные соединения эпителиальных клеток, в состав стереоцилий чувствительных клеток. МФ образуют пучки в цитоплазме подвижных клеток животных, и образуют слой под плазматической мембраной – кортикальный слой (рис. 244а, 245). У многих растительных клеток и клеток низших грибов они располагаются в слоях движущейся цитоплазмы.
Основным белком микрофиламентов является актин. Актин – неоднородный белок, в различных клетках могут быть разные его варианты или изоформы, каждая из которых кодируется своим геном. Так, у млекопитающих есть 6 различных актинов: один в скелетных мышцах, один в сердечной мышце, два типа – в гладких мышцах (один из них в сосудах), и два, немышечных, цитоплазматических актина, являющихся универсальным компонентом любых клеток млекопитающих. Все эти изоформы актина очень сходны по аминокислотным последовательностям, вариантными в них являются концевые участки, которые определяют скорость полимеризации, но не влияют на сокращение. Такое сходство актинов, несмотря на некоторые отличия, определяет их общие свойства. Актин имеет молекулярный вес около 42 тыс. и в мономерной форме имеет вид глобулы (G-актин), содержащей в своем составе молекулу АТФ. При его полимеризации образуется тонкая фибрилла (F-актин) толщиной 8 нм, представляющая собой пологую спиральную ленту (рис. 246). Актиновые микрофиламенты полярны по своим свойствам. При достаточной концентрации G-актин начинает самопроизвольно полимеризоваться. При такой спонтанной полимеризации актина на образовавшейся нити микрофиламента один из ее концов быстро связывается с G-актином (+)- конец микрофиламента) и поэтому растет быстрее, чем противоположный (минус-конец). Если концентрация G-актина будет недостаточной, то образовавшиеся фибриллы F-актина начинают разбираться. В растворах, содержащих т.н. критическую концентрацию G-актина, будет устанавливаться динамическое равновесие между полимеризацией и деполимеризацией, в результате чего фибрилла F-актина будет иметь постоянную длину (рис. 247). Из этого следует, что актиновые микрофиламенты представляют собой очень динамичные структуры, которые могут возникать и расти или же, наоборот, разбираться и исчезать в зависимости от наличия глобулярного актина. На растущем конце нити актина встраиваются мономеры, содержащие АТФ. По мере нарастания полимера происходит гидролиз АТФ, и мономеры остаются связанными с АДФ. Молекулы актина, связанные с АТФ, прочнее взаимодействуют друг с другом, чем мономеры, связанные с АДФ.
В клетках такая, казалось бы, неустойчивая фибриллярная система, стабилизируется массой специфических белков, ассоциирующих с F-актином. Так, белок тропомиозин, взаимодействуя с микрофиламентами, придает им необходимую жесткость. Целый ряд белков, например филамин и a-актинин образуют поперечные скрепки между нитями F–актина, что приводит к образованию сложной трехмерной сети, придающей гелеобразное состояние цитоплазме. Другие дополнительные белки могут связывать филаменты в пучки (фимбрин) и т.д. Кроме того, существуют белки, взаимодействующие с концами микрофиламентов и предотвращая их разборку, стабилизируют их. Взаимодействие F–актина со всей этой группой белков регулирует агрегатное состояние микрофиламентов, их рыхлое или наоборот тесное расположение, связь их с другими компонентами. Особую роль при взаимодействии с актином играют белки миозинового типа, которые образуют вместе с актином комплекс, способный к сокращению при расщеплении АТФ (см. ниже) (рис. 262).
Таким образом, МФ представляют собой фибриллы полимеризованного актина, связанного с многими другими белками. В принципе микрофиламенты во всех немышечных клетках могут осуществлять по крайней мере два ряда функций: быть частью сократительного аппарата, взаимодействуя с моторными белками (миозин), или участвовать в формировании скелетных структур, способных к собственному движению за счет процессов полимеризации и деполимеризации актина.
Особенно много сведений о цитоскелете, и о микрофиламентах получено при изучении фибробластов в культуре ткани, обладающих способностью к амебоидному движению. Эти клетки не имеют ответственных за движение постоянных фибриллярных структур, их фибриллярный аппарат все время находится в реорганизации: часть фибриллярных элементов разбирается в одних участках клетки и новообразуется в других.
Обычно ползущий по поверхности субстрата фибробласт поляризован: у него есть движущийся конец и “хвостовой” отдел. (рис. 248, 249 ) На движущемся конце, который часто более распластан по субстрату, чем боковые и хвостовые участки фибробласта, постоянно возникают и убираются тонкие нитевидные или пластинчатые выросты – ламеллоподии. Это – ведущий край клетки (ламеллоплазма). Который и обеспечивает движение фибробласта вперед. В таком движущемся фибробласте с помощью антител можно узнать места расположения актина. Он будет распределяться по трем основным частям клетки: он в виде тонкого слоя (1) располагается по всему периметру клетки под плазматической мембраной. Это кортикальный (cortex – кора) слой. Обильно актин выявляется в выростах цитоплазмы ведущего края клетки (2) и (3) в пучках актиновых филаментов, отходящих от ведущего края вглубь клетки (рис. 245).
Кортикальный слой состоит из плотной трехмерной сети актиновых филаментов, ассоциированных с плазматической мембраной (таб. ). Он обеспечивает механическую устойчивость поверхностному слою цитоплазмы и создает условия, позволяющие клетке изменять свою форму и двигаться. Этот слой постоянно меняет свое агрегатное состояние, переходя из состояния структурированного геля в жидкий золь. Такие переходы гель-золь связаны с изменениями в структуре кортикального слоя. Здесь в ассоциации с актиновыми филаментами находятся фибриллярные белки-стабилизаторы (например, филамин), которые образуют сшивки в местах пересечения филаментов, что придает жесткость всему кортикальному слою. Однако эта жесткость может быть легко снята за счет взаимодействия с другими белками, такими как гельзолин, которые вызывают фрагментацию и разборку филаментов и тем разжижают гель. Такая перестройка подмембранного слоя особенно выражена в ведущем крае, что позволяет быстро менять форму его поверхности, образовывать ламеллоподии и двигаться вперед. С другой стороны сеть актиновых филаментов способна к сокращению, т.к. в ней обнаружены короткие миозиновые агрегаты. Это приводит или к втягиванию ламеллоподий или же к подтаскиванию клеток вперед. Сеть актиновых филаментов в ведущем крае организована более определенно, чем в остальном кортексе. Здесь от небольших начальных выростов плазмалеммы внутрь клетки отходят пучки актиновых филаментов, оканчивающихся своими (+)-концами на плазматической мембране.
Сам процесс образования актиновых филаментов и их роста в зоне ламеллоплазмы зависит от ряда регуляторных белков. Один из них белок WASp/Scar связывается с плазматической мембраной. В его составе есть участки, связывающиеся с актином, другой специальный белковый комплекс Arp2/3, который связывается с (-)-концом растущей цепи полимера, препятствуя его деполимеризации. Такие сложные взаимодействия двух групп регуляторных белков приводят к тому, что на границе с плазматической мембраной происходит надстраивание растущих филаментов, которые могут прогибать плазматическую мембрану так, что возникает тонкий вырост – филоподия (рис. 250).
Иначе происходит полимеризация актина при образовании ламеллоподий. Здесь также ведущую роль играют белки WASp/Scar, которые закрепляются на плазматической мембране и связываются с комплексом Arp2/3и прикрепляют его к боковой поверхности уже готовой актиновой фибриллы. Комплекс Arp2/3 инициирует полимеризацию новой актиновой фибриллы, которая начинает расти под углом около 70 0 по отношению к первичной нити актина и закрепляется на плазматической мембране. Таких новых белковых цепей возникает несколько, и они как бы веером простираются к плазматической мембране и толкают ее вперед. Так образуется псевдоподия или ламеллоподия (рис. 251) За счет наращивания актиновых филаментов на (+) концах. Одновременно с этим происходит деполимеризация тех (-) концов филаментов, которые не заблокированы комплексами Arp2/3 и подвергаются воздействию белков, способствующих деполимеризации МФ.
Таким образом сложный процесс роста МФ приводит к перемещению в пространстве края движущейся клетки. По мере возникновения ламеллоподий их плазматическая мембрана с помощью белков интегринов образует с субстратом фокальные контакты, от которых отходят пучки актиновых филаментов, участвующие уже в другой форме подвижности, связанной со взаимодействиями между актиновыми филаментами и моторными белками-миозинами.
Миозины являются одним из составных компонентов МФ. Основная работа по перемещению клеток или их внутренних компонентов с помощью МФ происходит за счет работы акто-миозинового комплекса, где актиновые фибриллы играют роль направляющих (“рельсы”), а миозины – транслокаторы. Весь акто-миозиновый комплекс представляет собой АТФ-азу, и движение происходит за счет энергии гидролиза АТФ.
Миозины представляют собой семейство сходных белков. У всех из них есть головная (моторная ) часть, отвечающая за АТФ-азную активность комплекса, шейка, которая связана с несколькими регуляторными белковыми субъединицами и хвост, характерный для каждого типа миозина, определяющего специфичность функции в клетке. Существуют три основных типа миозинов. Миозин II и миозин V являются димерами, у которых a-спиральный участок хвоста образует сверхспиральный палочковидный участок. Миозин I представляет собой мономерную молекулу (рис. 252). Две молекулы миозина II могут ассоциировать друг с другом, образуя биполярную толстую фибриллу, участвующую в мышечном сокращении, при сокращении внутриклеточных пучков МФ и при делении клетки. Миозины I и V типа участвуют во взаимодействиях между элементами цитоскелета и мембранами, например в транспорте везикул.
Механизмы работы актомиозиновых комплексов очень сходен, независимо от типа миозина: он начинается со связи миозиновой головки с актиновым филаментом, ее изгибанием и последующим откреплением. За каждый цикл миозиновая головка перемещается в направлении (+)-конца актинового филамента на 5-25 нм при гидролизе одной молекулы АТФ. Таким образом происходит однонаправленное смещение или скольжение МФ относительно молекул миозина (рис. 253).
Лекция 4. Цитоплазма. Гиалоплазма. Немембранные компоненты цитоплазмы.
Цитоплазма включает в себя гиалоплазму, мембранные и немембранные компоненты.
Гиалоплазма или матрикс цитоплазмы имеет вид тонкозернистого или гомогенного вещества с низкой электронной плотностью. Является сложной коллоидной системой, включающей в себя различные биополимеры: белки, нуклеиновые кислоты и т. д. Существует в двух состояниях: золеобразном (жидком) и гелеобразном. Отдельные зоны гиалоплазмы могут менять свое агрегатное состояние в зависимости от условий или от функциональной задачи. Так, известно, что отдельные молекулы белков-тубулинов могут быть диспергированы в гиалоплазме, но в определенные моменты они начинают собираться и строить длинные трубчатые структуры — микротрубочки. Этот процесс самосборки микротрубочек обратим: при изменении условий жизни клетки (повышение давления или изменение проницаемости мембран клетки) микротрубочки распадаются до мономерных молекул тубулинов. Таким же образом в бесструктурной на взгляд гиалоплазме могут возникать и распадаться различные фибриллярные, нитчатые комплексы белковых молекул.
В состав гиалоплазмы из микромолекул входят главным образом различные глобулярные белки и ферменты цитоплазматического матрикса. Они составляют 20‑25% общего содержания белков в эукариотической клетке. К важнейшим ферментам матрикса относятся ферменты гликолиза, ферменты метаболизма сахаров, азотистых оснований, аминокислот, липидов и других важных соединений. В матриксе располагаются ферменты активации аминокислот при синтезе белка, транспортные РНК. Осмотические и буферные свойства клетки в значительной степени определяются составом и структурой гиалоплазмы.
Роль гиалоплазмы заключается в том, что
1) она объединяет все клеточные структуры и обеспечивает химическое взаимодействие их друг с другом;
2) через нее осуществляется большая часть внутриклеточных транспортных процессов;
3) она является основным вместилищем АТФ;
4) в ней откладываются запасные продукты (гликоген, жировые капли).
К немембранным компонентам относят цитоскелет, клеточный центр и рибосомы.
Цитоскелет
Представляет собой сложную динамическую систему микротрубочек, микрофиламентов, промежуточных филаментов и микротрабекул. Каждый из этих компонентов образует в клетке трехмерную сеть, которая взаимодействует с сетями из других компонентов.
Основные функции цитоскелета:
‑ поддержание и изменение формы клетки;
‑ распределение и перемещение компонентов клетки;
‑ транспорт веществ в клетку и из нее;
‑ обеспечение подвижности клетки;
‑ участие в межклеточных соединениях.
Микротрубочки
Микротрубочки ‑ наиболее крупные компоненты цитоскелета. Они представляют собой полые цилиндрические образования, имеющие форму трубочек, длиной до нескольких микрометров (в жгутиках более 50 нм) диаметром около 24-25 нм, с толщиной стенки 5 нм и диаметром просвета 14-15 нм (рис.).

Стенка микротрубочки состоит из спиралевидно уложенных нитей ‑ протофиламентов толщиной 5 нм (которым на поперечном разрезе соответствуют 13 субъединиц), образованных димерами из белковых молекул α-и β-тубулина.
I Функции микротрубочек:
(1) поддержание формы и полярности клетки, распределения ее компонентов;
(2) обеспечение внутриклеточного транспорта;
(3) обеспечение движения ресничек, хромосом в митозе (формируют ахроматиновое веретено, необходимое для клеточного деления);
(4) образование основы других органелл (центриолей, ресничек).
Расположение микротрубочек. Микротрубочки располагаются в цитоплазме в составе нескольких систем:
а) в виде отдельных элементов, разбросанных по всей цитоплазме и формирующих сети;
б) в пучках, гдеони связаны тонкими поперечными мостиками (в отростках нейронов, в составе митотического веретена, манжетки сперматиды, переферического "кольца" тромбоцитов);
в) частично сливаясь друг с другом с формированием пар, или дублетов (в аксонеме ресничек и жгутиков), и триплетов (в базальном тельце и центриоли).
Образование и разрушение микротрубочек. Микротрубочки представляют собой лабильную систему, в которой имеется равновесие между их постоянной сборкой и диссоциацией. У большинства микротрубочек один конец (обозначаемый как "‑") закреплен, а другой ("+") свободен и участвует в их удлинении или деполимеризации. Структурами, обеспечивающими образование микротрубочек, служат особые мелкие сферические тельца ‑ сателлиты (от англ, satellite ‑ спутник), отчего последние называют центрами организации микротрубочек (ЦОМТ). Сателлиты содержатся в базальных тельцах ресничек и клеточном центре (см. рис.)

После полного разрушения микротрубочек в цитоплазме они отрастают от клеточного центра со скоростью около 1 мкм/мин., а их сеть вновь восстанавливается менее, чем за полтора часа. К ЦОМТ относят также и центромеры хромосом.
Угнетение самосборки микротрубочек посредством ряда веществ, являющихся ингибиторами митоза (колхицин, винбластин, винкристин), вызывает избирательную гибель быстро делящихся клеток. Поэтому некоторые из таких веществ успешно используются для химиотерапии опухолей. Блокаторы микротрубочек нарушают также транспортные процессы в цитоплазме, в частности, секрецию, аксонный транспорт в нейронах. Разрушение микротрубочек приводит к изменениям формы клетки и дезорганизации ее структуры и распределения органелл.
Микрофиламенты
Микрофиламенты ‑ тонкие белковые нити диаметром 5‑7 нм, лежащие в цитоплазме поодиночке, в виде сетей или пучками. В скелетной мышце тонкие микрофиламенты образуют упорядоченные пучки, взаимодействуя с более толстыми миозиновыми филаментами.
Под плазмолеммойнаходится густая сетьмикрофиламентов, характерная для большинства клеток. В этой сети микрофиламенты переплетены между собой и "сшиты" друг с другом с помощью особых белков, самым распространенным из которых является филамин. Кортикальная сеть препятствует резкой и внезапной деформации клетки при механических воздействиях и обеспечивает плавные изменения ее формы путем перестройки, которая облегчается актин-растворяющими ферментами.
Актин ‑ основной белок микрофиламентов ‑ встречается в мономерной форме (G-, или глобулярный актин), которая способна в присутствии цАМФ и Са 2 + полимеризоваться в длинные цепи (F-, или фибриллярный актин). Обычно молекула актина имеет вид двух спирально скрученных нитей.

В микрофиламентах актин взаимодействует с рядом актин-связывающих белков (до нескольких десятков видов), выполняющих различные функции. Некоторые из них регулируют степень полимеризации актина, другие способствуют связыванию отдельных микрофиламентов в системы. В не мышечных клетках на актин приходится примерно 5‑10% содержания белка, лишь около половины его организовано в филаменты. Микрофиламенты более устойчивы к физическим и химическим воздействиям, чем микротрубочки.
Функции микрофиламентов:
(1) обеспечение сократимости мышечных клеток (при взаимодействии с миозином);
(2) обеспечение функций, связанных с кортикальным слоем цитоплазмы и плазмолеммой (экзо- и эндоцитоз, образование псевдоподий и миграция клетки);
(3) перемещение внутри цитоплазмы органелл, транспортных пузырьков и других структур благодаря взаимодействию с некоторыми белками (минимиозином), связанными с поверхностью этих структур;
(4) обеспечение определенной жесткости клетки за счет наличия кортикальной сети, которая препятствует действию деформаций, но сама, перестраиваясь, способствует изменениям клеточной формы;
(5) формирование сократимой перетяжки при цитотомии, завершающей клеточное деление;
(6) образование основы ("каркаса") некоторых органелл (микроворсинок, стереоцилий).
(7) участие в организации структуры межклеточных соединений (опоясывающих десмосом).
Актиновые микрофиламенты образуют основу микроворсинок ‑ пальцевидные выросты цитоплазмы клетки диаметром 0.1 мкм и длиной 1 мкм. Микроворсинки обеспечивают многократное увеличение площади поверхности клетки, на которой происходит расщепление и всасывание веществ. На апикальной поверхности некоторых клеток, активно участвующих в указанных процессах (в эпителии тонкой кишки и почечных канальцев) имеется до нескольких тысяч микроворсинок, образующих в совокупности щеточную каемку. Каркас каждой микроворсинки образован пучком, содержащим около 40 микрофиламентов, лежащих вдоль ее длинной оси (рис. ).

В апикальной части микроворсинки этот пучок закреплен в аморфном веществе. Его жесткость обусловлена поперечными сшивками из белков фимбрина и виллина, изнутри пучок прикреплен к плазмолемме микроворсинки особыми белковыми мостиками (молекулами минимиозина). У основания микроворсинки микрофиламенты пучка вплетаются в терминальную сеть, среди элементов которой имеются миозиновые филаменты. Взаимодействие актиновых и миозиновых филаментов терминальной сети, вероятно, обусловливает тонус и конфигурацию микроворсинки.
Промежуточные филаменты
Промежуточные филаменты ‑ прочные и устойчивые в химическом отношении белковые нити толщиной около 10 нм (что является промежуточным значением между толщиной микротрубочек и микрофиламентов). Они встречаются в клетках разных тканей (см. ниже) и располагаются в виде трехмерных сетей в различных участках цитоплазмы, окружают ядро, входят в состав десмосом и полудесмосом эпителиальных клеток (в плазмолемме которых они закреплены посредством трансмембранных белков), лежат по всей длине отростков нейронов. Промежуточные филаменты образованы нитевидными белковыми молекулами, сплетенными друг с другом наподобие каната.

Функции промежуточных филаментов изучены недостаточно; установлено, однако, что они не влияют ни на движение, ни на деление клетки. К их основным функциям относятся:
(1) структурная ‑ поддерживающая и опорная, обеспечение распределения органелл по определенным участкам цитоплазмы;
(2) обеспечение равномерного распределения сил деформации между клетками ткани, что препятствует повреждению отдельных клеток (благодаря связи промежуточных филаментов с трансмембранными белками десмосом и полудесмосом);
(3) участие в образовании рогового вещества в эпителии кожи; в эпителиальных клетках связываются с другими белками и образуют непроницаемые барьеры (роговые чешуйки), являются главным компонентом волос и ногтей;
(4) поддержание формы отростков нервных клеток и фиксация трансмембранных белков (в частности, ионных каналов);
(5) удержание миофибрилл в мышечной ткани и прикрепление их к плазмолемме, что обеспечивает их сократительную функцию.
В поврежденной клетке сеть промежуточных филаментов (в отличие от других компонентов цитоскелета) спадается и концентрируется вокруг ядра, связывая поврежденные органеллы и белковые агрегаты. Формируется своеобразная структура, которая наподобие кокона концентрирует поврежденные компоненты клетки для последующего уничтожения путем их внутриклеточного переваривания. В ходе восстановления структуры и функции клетки после повреждения сеть промежуточных филаментов вновь развертывается по всей цитоплазме. В отличие от микрофиламентов и микротрубочек, для образования промежуточных филаментов не требуется АТФ, причем они не подвергаются постоянной сборке и диссоциации, а представляют собой менее лабильные и сравнительно устойчивые структуры.
Несмотря на то, что строение промежуточных филаментов в клетках различных типов сходно, они существенно различаются по своей молекулярной массе и химической природе, что может быть продемонстрировано иммуноцитохимическими методами с антителами к промежуточным филаментам различных классов.
Различают 6 основных классов промежуточных филаментов: кератиновые (эпителиальные ткани), десминовые (мышечные ткани), виментиновые (клетки мезенхимного происхождения – фибробласты, макрофаги, остеобласты и т.д.), нейрофиламенты (нейроны), глиальные (астроциты, олигодендроциты), ламины (во всех клетках, образуют кариоскелет).
Идентификация классов промежуточных филаментов имеет важное значение в диагностике опухолей для выявления тканевой принадлежности опухолевых клеток, что может определить выбор лечения и прогноз. Наибольшее диагностическое значение имеет выявление цитокератинов, десмина и глиального фибриллярного кислого белка, которые служат маркерами опухолей эпителиального, мышечного и глиального происхождения. Менее отчетливые результаты дает обнаружение виментина, который экспрессируется и коэкспрессируется (экспрессируется в сочетании с белками других классов промежуточных филаментов) многими типами клеток. Существенную информацию о степени поражения эпителия можно получить путем определения экспрессии молекулярных форм кератинов, специфичных для клеток конкретной локализации и уровня дифференпировки. Таким путем можно установить, например, ранние предраковые изменения в эпителии, не выявляемые стандартными морфологическими методами.
Микротрабекулы
Микротрабекулы ‑ наименее изученная система цитоскелета, само существование которой оспаривается многими исследователями. Предполагают, что три описанные выше системы филаментов пронизываются и объединяются некоей четвертой системой, названной микротрабекулярной сетью. Последняя выявляется при высоковольтной электронной микроскопии как система нитей неравномерной толщины (2‑10 нм), связывающая три системы цитоскелета, различные органеллы и плазмолемму. В "узлах" микротрабекулярной сети располагаются свободные рибосомы и полисомы. Белок, образующий микротрабекулярную сеть, не идентифицирован. Высказываются предположения о том, что эта сеть представляет собой артефакт, возникающий в результате преципитации и коагуляции белков при фиксации цитоплазмы клетки.
Читайте также:


