Нервный двигательный импульс вызывает гидролиз атф
14.1 Проследите последовательность участия ионов Са 2+ в процессе мышечного сокращения:
1. кальций связывается с С-субъединицей тропонина и вызывает конформационные изменения в структуре тропомиозина.
2. Са 2+ -АТФ-аза транспортирует ионы кальция из саркоплазматического ретикулума.
3. Нервный импульс вызывает высвобождение ионов кальция из саркоплазматического ретикулума.
4. Взаимодействие головки миозина с актином.
5. Уборка кальция в цистерны саркоплазматического ретикулума.
14.2 Укажите последовательность этапов мышечного сокращения:
1. происходит скольжение нитей актина вдоль нитей миозина.
2. Происходит контакт головки миозина с актином.
3. Происходит гидролиз АТФ и выделение энергии.
4. Проявляется АТФ-азная активность головки миозина.
5. Актин связан с миозином.
14.3 Выберите последовательность этапов, происходящих в мышце в стадии расслабления:
1. Миозиновая головка в присутствии АТФ отделяется от F-актина, вызывая расслабление.
2. Комплекс TнС-4Са 2+ утрачивает свой кальций.
3. Содержание кальция в цитоплазме падает вследствие его поглощения саркоплазматическим ретикулумом.
4. Тропонин, реагируя с тропомиозином, ингибирует дальнейшие взаимодействия миозиновой головки с F-актином.
14.4 Мышечное сокращение активируется …
14.5 В состав тропонина входят следующие субъединицы …
14.6 Количество АТФ в мышце поддерживается за счет …
14.7 Выберите ферменты, проявляющие наибольшую активность:
| А – в скелетных мышцах. | 1. Аспартатаминотрансфераза и изоферменты ЛДГ1 и ЛДГ2. |
| 2. Аспартатаминотрансфераза и изоферменты ЛДГ4 и ЛДГ5. | |
| Б – в миокарде. | 3. Изоформы креатинкиназы МВ и ВВ. |
| 4. Изофермент креатинкиназа МВ и аспартатаминотрансфераза. | |
| 5. Изоферменты ЛДГ1 и ЛДГ2. | |
| В – ни в одной из перечисленных тканей. | 6. Изоформа креатинкиназы ММ и ЛДГ4 и ЛДГ5. |
| 7. Аспартат- и аланинаминотрансферазы. | |
| 8. Изоферменты ЛДГ4 и ЛДГ5. |
14.8 Какие из следующих утверждений характеризуют белок тропонин (А) и тропомиозин (Б):
1. Глобулярный белок.
2. Состоит из 7-ми глобул.
3. Связан с миозином.
4. Фибриллярный белок.
5. По длине соответствует 7 глобулам актина.
6. Состоит из 3-х субъединиц.
7. Присоединяет ионы кальция.
8. Закрывает участок актина для взаимодействия с миозином.
14.9 Укажите особенности, характерные для:
| А – миокарда. | 1. Тропонин имеет три центра связывания ионов кальция. |
| 2. Ресинтез АТФ идет преимущественно за счет окислительного фосфорилирования. | |
| 3. Основным субстратом окисления является глюкоза. | |
| Б – скелетной мышцы. | 4. Ресинтез АТФ идет, в основном, за счет гликолиза. |
| 5. Тропонин имеет четыре центра связывания ионов кальция. | |
| 6. Са 2+- АТФ-аза имеет наибольшее сродство к ионам кальция и легче его убирает. | |
| 7. Основным субстратом окисления чвляются жирные кислоты и ацетоновые тела. |
14.10 Выберите положения, соответствующие:
| А – состоянию покоя мышцы. | 1. Комплекс ТнС-4Са 2+ утрачивает кальций. |
| 2. В головке миозина идет гидролиз АТФ. | |
| 3. Тропонин, реагируя с тропомиозином, ингибирует взаимодействие миозина с актином. | |
| Б – процессу сокращения мышцы. | 4. Актин меняет свою длину относительно миозина. |
| 5. Скольжение тонких нитей относительно тонких. | |
| 6. Головка миозина связана с актином. | |
| В – ни одному из них. | 7. Тропомиозин связан с контактным участком актина. |
| 8. Актин и миозин изменяют свою длину. | |
| 9. Головка миозина поворачивается на 180 0 . |
14.11 В состав миозина входят:
1. две основные тяжелые нити и четыре легких цепи;
2. нити легкого меромиозина, обладающие АТФ-азной активностью;
3. головка, обладающая АТФ-азной активностью;
4. тяжелые нити, обладающие АТФ-азной активностью.
14.12 Для актина характерно:
1. наличие двух форм: глобулярной и фибриллярной;
2. образование комплекса с миозином в присутствии АДФ;
3. обравзование комплекса с тропомиозином;
4. способность к гидролизу АТФ;
5. отсутствие АТФ-азной активности.
14.13 Свойства миозина:
1. спонтанно образовывать волокна при физиологических значениях рН;
2. ферментативная активность;
3. связываеть полимеризованную форму актина;
4. спонтанно образовывать связь с тропомиозином;
5. при мышечном сокращении тонкие нити миозина могут изменять свою толщину и скользить вдоль нитей актина.
14.14 Тропомиозин – это:
1. глобулярный белок;
2. фибриллярный белок;
3. белок, укладывающийся на актин, закрывая центр связывания с головкой миозина;
4. белок, активирующий АТФ-азную активность миозина;
5. белок, связывающий 7 глобул актина.
14.15 Актин имеет в своем составе и характеризуется:
1. F-актин, спираль из мономеров актина.
2. G-актин, спираль из мономеров актина.
3. Актин, участвующий в мышечном сокращении, т.к. обладает АТФ-азной активностью.
4. АТФ-азная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина.
14.16 Глобулярный актин обладает следующимим особенностями:
1. состоит из 7 глобул, закручивающихся между собой;
2. образует нити фибриллярного актина;
3. каждая глобула имеет центр связывания с миозином4
4. связывается с миозином в участке перекручивания 2-х глобулярных цепей;
5. каждая глобула обладает АТФ-азной активностью.
14.17 Тропомиозин выполняет следующие функции:
1. блокирует связь между актином и миозином;
2. способствует уборке ионов кальция;
3. блокирует связь между ингибиторной субъединицей тропонина и контактным участком актина;
4. ингибирует гидролиз АТФ.
14.18 Среди функций тропонина и тропомиозина можно выделить следующие:
1. тропонин и тропомиозин активируют связывание актина и миозина;
2. в отсутствие Са2+тропонин и тропомиозин ингибируют взаимодействие актина и миозина;
3. гидролиз АТФ активирует влияние регуляторных белков тропонина и тропомиозина на образование актомиозинового комплекса;
4. высвобождение Са2+из саркоплазматического ретикулума приводит к блокированию тропомиозином актина к головкам миозина.
14.19 Роль Са2+в мышечном сокращении:
1. ионы Са2+запускают мышечное сокращение, присоединяясь к тропомиозину;
2. ионы Са2+связываются с ТнС – компонентом тропонина, что вызывает конформационные сдвиги;
3. Са2+регулирует мышечное сокращение по аллостерическому механизму со следующей последовательностью передачи информации: Са2+→тропомиозин →актин →миозин;
4. в отсутствие Са2+тропонин и тропомиозин ингибируют взаимодействие актина и миозина.
14.20 Регуляция потока ионов Са2+саркоплазматическим ретикулумом происходит следующим образом:
1. в состоянии покоя система активного транспорта Са2+накапливает его в саркоплазматическом ретикулуме;
2. кальциевый насос, приводимый в действие АТФ, увеличивает концентрацию Са2+в цитоплазме покоящейся мышцы;
3. деполяризация мембран Т-микротрубочек вызывает выброс Са2+из цистерн саркоплазматического ретикулума;
4. нервный импульс, приводящий к деполяризации мембран, вызывает перекачивание Са2+ в цистерны саркоплазматического ретикулума.
14.21 Мышечное сокращение обеспечивается:
1. тем количеством АТФ, которое имеется в мышце и может поддержать сократительную активность всего лишь на протяжении доли секунды;
2. тем количеством АТФ, которое имеется в мышце для поддерживания сократительной активности на длительное время;
3. запасом богатых энергией фосфатных связей в виде фосфокреатина;
4. т.к. в работающей мышце возрастает концентрация АДФ и Фн, то они полностью обеспечивают энергией мышечное сокращение.
14.22 Роль АТФ при мышечном сокращении заключается в следующем:
1. активация мышечного сокращения;
2. регуляция функции тропонина;
3. активация аденилатциклазной реакции;
4. активация Са 2+ -АТФ-азы;
5. обеспечение реполяризации мембраны.
14.23 Пути ресинтеза АТФ следующие:
1. за счет энергии креатинфосфата;
2. в процессе окислительного фосфорилирования в дыхательной цепи внутренней мембраны митохондрий;
3. в дыхательной цепи наружной мембраны митохондрий;
4. при распаде креатинфосфата с образованием креатинина;
5. в аденилатциклазной реакции.
14.24 Гидролиз АТФ:
1. запускает мышечное сокращение;
2. запускает цикл ассоциации и диссоциации актина и миозина;
3. активирует тропониновую систему;
4. вызывает стадию расслабления мышечного сокращения;
5. вызывает конформационные изменения в головках миозина.
14.25 В процессе сокращения происходит:
1. сокращение актина и миозина;
2. скольжение тонких нитей относительно толстых нитей;
3. актин меняет свою длину относительно миозина;
4. миозин меняет свою длину относительно актина;
5. актин и миозин не меняют своей длины.
14.26 Механизм запуска мышечного сокращения происходит:
2. за счет ионов Са2+;
3. за счет энергии креатинфосфата.
14.27 Сердце борется за диастолу, поэтому для миокарда характерно:
1. наибольшее сродство к ионам кальция;
2. сродство к ионам кальция ниже, чем в скелетной мышце;
3. высокая активность Са 2+ -АТФ-азы;
4. низкая активность Са 2+ -АТФ-азы.
14.28 На рисунке изображено:
1. состояние покоя мышцы;
2. начало мышечного сокращения;
3. конформационные сдвиги в структуре тропомиозина;
4. состояние в момент деполяризации мембраны.
 |
14.29 На рисунке изображено:
1. состояние расслабления мышцы;
2. начальный этап мышечного сокращения;
3. конформационные сдвиги в системе тропонин-тропомиозин;
4. состояние в момент деполяризации мембраны;
Мышечное сокращение является сложным механо-химическим процессом, в ходе которого происходит преобразование химической энергии гидролитического расщепления АТФ в механическую работу, совершаемую мышцей.
В настоящее время этот механизм еще полностьюне раскрыт. Но достоверно известно следующее:
1. Источником энергии, необходимой для мышечной работы является АТФ;
2. Гидролиз АТФ, сопровождающийся выделением энергии, катализируется миозином, который как уже отмечалось, обладает ферментативной активностью;
3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов Са 2+ в саркоплазме миоцитов, вызываемое двигательным нервным импульсом;
4. Во время мышечного сокращения между толстыми и тонкими нитями миофибрилл возникают поперечные мостики или спайки;
5. Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом.
В мышце, находящейся в состоянии покоя, толстые и тонкие нити миофибрилл друг с другом не соединены, так как участки связывания на молекулах актина закрыты молекулами тропомиозина.
Мышечное сокращение происходит под воздействием двигательного нервного импульса, представляющего собою волну повышенной мембранной проницаемости, распространяющуюся по нервному волокну[1]. Эта волна повышенной проницаемости передается через нервно-мышечный синапс на Т-систему саркоплазматической сети и в конечном итоге достигает цистерн, содержащих ионы кальция в большой концентрации. В результате значительного повышения проницаемости стенки цистерн (это тоже мембрана!) ионы кальция выходят из цистерн и их концентрация в саркоплазме за очень короткое время (около 3 мс) возрастает примерно в 1000 раз. Ионы кальция, находясь в высокой концентрации, присоединяются к белку тонких нитей - тропонину и меняют его пространственную форму (конформацию). Изменение конформации тропонина, в свою очередь, приводит к тому, что молекулы тропомиозина смещаются вдоль желобка фибриллярного актина, составляющего основу тонких нитей, и освобождают тот участок актиновых молекул, который предназначен для связывания с миозиновыми головками. В результате этого между миозином и актином (т.е. между толстыми и тонкими нитями) возникает поперечный мостик, расположенный под углом 90º. Поскольку в толстые и тонкие нити входит большое число молекул миозина и актина (около 300 в каждую), то между мышечными нитями образуется довольно большое количество поперечных мостиков или спаек. На электронной микрофотографии (рис. 15) хорошо видно, что между толстыми и тонкими нитями имеется большое количество поперечно расположенных мостиков.

Рис. 15. Электронная микрофотография продольного среза
участка миофибриллы (увеличение 300000 раз) (Л.Страйнер, 1985)
Образование связи между актином и миозином сопровождается повышением АТФ-азной активности последнего (т.е. актин действует подобно аллостерическим активаторам ферментов), в результате чего происходит гидролиз АТФ:
АТФ + Н2О ¾® АДФ + Н3РО4 + энергия
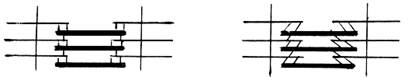 |
За счет энергии, выделяющейся при расщеплении АТФ, миозиновая головка подобно шарниру или веслу лодки поворачивается, и мостик между толстыми и тонкими нитями оказывается под углом 45º, что приводит к скольжению мышечных нитей навстречу друг другу (рис. 16).
Рис.16. а) образовавшиеся мостики между толстыми и
тонкими нитями располагаются под углом 90º;
б) после поворота мостики оказываются под углом 45º
Совершив поворот, мостики между толстыми и тонкими нитями разрываются. АТФ-азная активность миозина вследствие этого резко снижается и гидролиз АТФ прекращается. Но если двигательный нервный импульс продолжает поступать в мышцу, и в саркоплазме сохраняется высокая концентрация ионов кальция, поперечные мостики вновь образуются, АТФ-азная активность миозина возрастает и снова происходит гидролиз новых порций АТФ, дающий энергию для поворота поперечных мостиков с последующим их разрывом. Это ведет к дальнейшему движению толстых и тонких нитей навстречу друг другу и укорочению миофибрилл и мышечного волокна.
В результате многократного образования, поворота и разрыва мостиков мышца может максимально сократиться, при этом тонкие нити наслаиваются друг на друга (иногда могут переплетаться), а толстые нити упираются в Z-пластинку (при сверхмаксимальном сокращении их концы даже могут быть расплющены) (рис. 17).

Рис. 17. Схема строения участка максимально
Подвижность является характерным свойством всех форм жизни. Направленное движение имеет место при расхождении хромосом в процессе клеточного деления, активном транспорте молекул, перемещении рибосом в ходе белкового синтеза, сокращении и расслаблении мышц. Мышечное сокращение – наиболее совершенная форма биологической подвижности. В основе любого движения, в том числе и мышечного, лежат общие молекулярные механизмы.
У человека различают несколько видов мышечной ткани. Поперечно-полосатая мышечная ткань составляет мышцы скелета (скелетные мышцы, которые мы можем сокращать произвольно). Гладкая мышечная ткань входит в состав мышц внутренних органов: желудочно-кишечного тракта, бронхов, мочевыводящих путей, кровеносных сосудов. Эти мышцы сокращаются непроизвольно, независимо от нашего сознания.
В данной лекции мы рассмотрим строение и процессы сокращения и расслабления скелетных мышц, поскольку именно они представляют наибольший интерес для биохимии спорта.
Механизм мышечного сокращения до настоящего времени раскрыт не полностью.
Достоверно известно следующее.
1. Источником энергии для мышечного сокращения являются молекулы АТФ.
2. Гидролиз АТФ катализируется при мышечном сокращении миозином, обладающим ферментативной активностью.
3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов кальция в саркоплазме миоцитов, вызываемое нервным двигательным импульсом.
4. Во время мышечного сокращения между тонкими и толстыми нитями миофибрилл возникают поперечные мостики или спайки.
5. Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом.
В покоящейся мышце тонкие и толстые нити находятся в разъединенном состоянии.
Под воздействием нервного импульса ионы кальция выходят из цистерн саркоплазматической сети и присоединяются к белку тонких нитей – тропонину. Этот белок меняет свою конфигурацию и меняет конфигурацию актина. В результате образуется поперечный мостик между актином тонких нитей и миозином толстых нитей. При этом повышается АТФазная активность миозина. Миозин расщепляет АТФ и за счет выделившейся при этом энергии миозиновая головка подобно шарниру или веслу лодки поворачивается, что приводит к скольжению мышечных нитей навстречу друг другу.
Совершив поворот, мостики между нитями разрываются. АТФазная активность миозина резко снижается , прекращается гидролиз АТФ. Однако при дальнейшем поступлении нервного импульса поперечные мостики вновь образуются, так как процесс, описанный выше, повторяется вновь.
В каждом цикле сокращения расходуется 1 молекула АТФ.
В основе мышечного сокращения лежат два процесса:
• спиральное скручивание сократительных белков;
• циклически повторяющееся образование и диссоциация комплекса между цепью миозина и актином.
Мышечное сокращение инициируется приходом потенциала действия на концевую пластинку двигательного нерва, где выделяется нейрогормон ацетилхолин, функцией которого является передача импульсов. Сначала ацетилхолин взаимодействует с ацетилхолиновыми рецепторами, что приводит к распространению потенциала действия вдоль сарколеммы. Все это вызывает увеличение проницаемости сарколеммы для катионов Na + , которые устремляются внутрь мышечного волокна, нейтрализуя отрицательный заряд на внутренней поверхности сарколеммы. С сарколеммой связаны поперечные трубочки саркоплазматического ретикулума, по которым распространяется волна возбуждения. От трубочек волна возбуждения передается мембранам пузырьков и цистерн, которые оплетают миофибриллы на участках, где происходит взаимодействие актиновых и миозиновых нитей. При передаче сигнала на цистерны саркоплазматического ретикулума, последние начинают освобождать находящийся в них Са 2+ . Высвобожденный Са 2+ связывается с Тн-С, что вызывает конформационные сдвиги, передающиеся на тропомиозин и далее на актин. Актин как бы освобождается из комплекса с компонентами тонких филаментов, в котором он находился. Далее актин взаимодействует с миозином, и результатом такого взаимодействия является образование спайки, что делает возможным движение тонких нитей вдоль толстых.
Генерация силы (укорочение) обусловлена характером взаимодействия между миозином и актином. На миозиновом стержне имеется подвижный шарнир, в области которого происходит поворот при связывании глобулярной головки миозина с определенным участком актина. Именно такие повороты, происходящие одновременно в многочисленных участках взаимодействия миозина и актина, являются причиной втягивания актиновых филаментов (тонких нитей) в Н-зону. Здесь они контактируют (при максимальном укорочении) или даже перекрываются друг с другом, как это показано на рисунке.
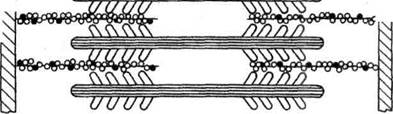
в
Рисунок. Механизм сокращения: а – состояние покоя; б – умеренное сокращение; в – максимальное сокращение
Затрата АТФ необходима и для расслабления мышц. После прекращения действия двигательного импульса Са 2+ переходит в цистерны саркоплазматического ретикулума. Тн-С теряет связанный с ним кальций, следствием этого являются конформаци-онные сдвиги в комплексе тропонин-тропомиозин, и Тн-I снова закрывает активные центры актина, делая их неспособными взаимодействовать с миозином. Концентрация Са 2+ в области сократительных белков становится ниже пороговой, и мышечные волокна теряют способность образовывать актомиозин.
В этих условиях эластические силы стромы, деформированной в момент сокращения, берут верх, и мышца расслабляется. При этом тонкие нити извлекаются из пространства между толстыми нитями диска А, зона Н и диск I приобретают первоначальную длину, линии Z отдаляются друг от друга на прежнее расстояние. Мышца становится тоньше и длиннее.
Скорость гидролиза АТФпри мышечной работе огромна: до 10 мк моль на 1 г мышцы за 1 мин. Общие запасы АТФневелики, поэтому для обеспечения нормальной работы мышц АТФдолжна восстанавливаться с той же скоростью, с какой она расходуется.
Расслабление мышцыпроисходит после прекращения поступления длительного нервного импульса. При этом проницаемость стенки цистерн саркоплазматической сети уменьшается, и ионы кальция под действием кальциевого насоса, используя энергию АТФ, уходят в цистерны. Удаление ионов кальция в цистерны ретикулума после прекращения двигательного импульса требует значительных энерготрат. Так как удаление ионов кальция происходит в сторону более высокой концетрации, т.е. против осмотического градиента, то на удаление каждого иона кальция затрачивается две молекулы АТФ. Концентрация ионов кальция в саркоплазме быстро снижается до исходного уровня. Белки вновь приобретают конформацию характерную для состояния покоя.
Таким образом, и процесс мышечного сокращения и процесс мышечного расслабления – это активные процессы, идущие с затратами энергии в виде молекул АТФ,
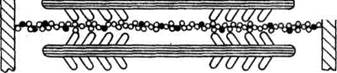
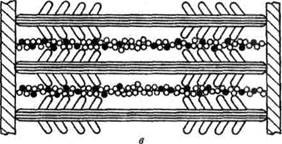
В гладких мышцах нет миофибрилл, которые состоят из нескольких сотен саркомеров. Тонкие нити присоединяются к сарколемме, толстые находятся внутри волокон. Ионы кальция также играют роль в сокращении, но поступают в мышцу не из цистерн, а из внеклеточного вещества, поскольку в гладких мышцах отсутствуют цистерны с ионами калькия. Этот процесс медленный и поэтому медленно работают гладкие мышцы.
Рисунок. Схема расположения толстых и тонких нией в гладких мышечных волокнах.
Вопросы для повторения
1.Что происходит в процессе мышечного сокращения ?
2. Где располагается Z-пластинка (Z-линия) и её предназначение ?
3. Скелетная мышца состоит из …
5. Типы мышечных волокон и их характерные различия.
6. Тонкие и толстые нити миофибрилл образованы …
7. Типы мышц и их характерные различия.
8. Общая структура миозина и его предназначение.
10. Актин и его важнейшие свойства.
11. Кальциевый насос (его локализация и предназначение).
12 .Тропонин представляет собой …
13. Сарколемма и миофибриллы (что это ?).
14. Назовите три биологически важные функции, выполняемые миозином.
15. Саркоплазма миоцитов содержит: …
16. Механизм расслабление мышцы.
17. Строение миофибрилл
18. Механизм мышечного сокращения.
19. Назовите виды поперечнополосатых мышц.
20. Анизотропные диски (темные диски или А-диски).
21. Поля Конгейма и их расположение в тренированных и нетренированных мышцах.
22. Изотропные диски (светлые диски или I-диски).
Мышечное сокращение является сложным механохимическим процессом, в ходе которого происходит преобразование химической энергии гидролитического расщепления АТФ в механическую работу, совершаемую мышцей. В настоящее время этот механизм еще полностью не раскрыт. Но достоверно известно следующее:
1. Источником энергии, необходимой для мышечной работы является АТФ.
2. Гидролиз АТФ, сопровождающийся выделением энергии, катализируется миозином, который, как уже отмечалось, обладает ферментативной активностью.
3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов Са2+ в саркоплазме миоцитов, вызываемое двигательным нервным импульсом.
4. Во время мышечного сокращения между толстыми и тонкими нитями миофибрилл возникают поперечные мостики, или спайки.
5. Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом.
В мышце, находящейся в состоянии покоя, толстые и тонкие нити миофибрилл друг с другом не соединены, так как участки связывания на молекулах актина закрыты молекулами тропомиозина.
Мышечное сокращение происходит под воздействием двигательного нервного импульса, представляющего собой волну повышенно)) мембранной проницаемости, распространяющуюся по нервному волокну • Эта волна повышенной проницаемости передается через нервно-мышечный синапс на Т-систему саркоплазматической сети и в конечном счете достигает цистерн, содержащих ионы кальция в большой концентрации. В результате значительного повышения проницаемости стенки цистерн ионы кальция выходят из цистерн и их концентрация в саркоплазме за очень короткое время возрастает с 10-8 до КГ г-ион/л, т.е. в 1000 раз. Ионы кальция, находясь в высокой концентрации, присоединяются к белку тонких нитей -тропонину - и меняют его пространственную форму. Изменение конформации тропонина, в свою очередь, приводит к тому, что молекулы тропомиозина смещаются вдоль желобка фибриллярного актина, составляющего основу тонких нитей, и освобождают тот участок актиновых молекул, который предназначен для связывания с миозиновыми головками. В результате этого между миозином и актином возникает поперечный мостик, расположенный под углом 90°. Поскольку в толстые и тонкие нити входит большое число молекул миозина и актина, то между мышечными нитями образуется довольно большое количество поперечных мостиков, или спаек. На электронной микрофотографии хорошо видно, что между толстыми и тонкими нитями имеется большое количество поперечно расположенных мостиков.
Образование связи между актином и миозином сопровождается повышением АТФазной активности последнего, в результате чего происходит гидролиз АТФ:
За счет энергии, выделяющейся при расщеплении АТФ, миозиновая головка, подобно шарниру или веслу лодки, поворачивается и мостик между толстыми и тонкими нитями оказывается под углом 45°, что приводит к скольжению мышечных нитей навстречу друг другу.
Совершив поворот, мостики между толстыми и тонкими нитями разрываются. АТФазная активность миозина вследствие этого резко снижается, и гидролиз АТФ прекращается. Но если двигательный нервный импульс продолжает поступать в мышцу и в саркоплазме сохраняется высокая концентрация ионов кальция, поперечные мостики вновь образуются, АТФазная активность миозина возрастает и снова происходит гидролиз новых порций АТФ, дающий энергию для поворота поперечных мостиков с последующим их разрывом. Это ведет к дальнейшему движению толстых и тонких нитей навстречу друг другу и укорочению миофибрилл и мышечного волокна.
В результате многократного образования, поворота и разрыва мостиков мышца может максимально сократиться, при этом тонкие нити наслаиваются друг на друга, а толстые нити упираются в Z-пластинку.
Каждый цикл сокращения требует расходования одной молекулы АТФ в качестве источника энергии. Учитывая, что во всей мышце во время ее сокращения возникает огромнейшее количество поперечных мостиков, затраты АТФ на энергообеспечение мышечной деятельности очень велики.
Расслабление мышцы происходит после прекращения поступления двигательного нервного импульса. При этом проницаемость стенки цистерн саркоплазматического ретикулума уменьшается, и ионы кальция под действием кальциевого насоса, использующего энергию АТФ, уходят в цистерны. Их концентрация в саркоплазме быстро снижается до исходного уровня. Снижение концентрации кальция в саркоплазме вызывает изменение конформации тропонина, что приводит к фиксации молекул тропомиозина в определенных участках актиновых нитей и делает невозможным образование поперечных мостиков между толстыми и тонкими нитями. За счет упругих сил, возникающих при мышечном сокращении в коллагеновых нитях, окружающих мышечное волокно, оно при расслаблении возвращается в исходное положение. Возвращению мышцы в исходное состояние также способствует сокращение мышц-антагонистов. Таким образом, процесс мышечного расслабления, или релаксация, так же как и процесс мышечного сокращения, осуществляется с использованием энергии гидролиза АТФ.
Гладкие мышечные волокна по строению существенно отличаются от поперечно-полосатых. В гладких мышечных клетках нет миофибрилл. Тонкие нити присоединяются к сарколемме, толстые находятся внутри волокон.
В гладких мышечных волокнах отсутствуют также цистерны с ионами кальция. Под действием нервного импульса ионы Са2+ поступают в саркоплазму из внеклеточного вещества. Поступают ионы кальция в саркоплазму медленно и также медленно уходят из волокна после прекращения поступления нервного импульса. Поэтому гладкие мышцы медленно сокращаются и медленно расслабляются.
Читайте также:


