Перекисное окисление липидов нервной
Кислород, необходимый организму для функционирования ЦПЭ и многих других реакций, является одновременно и токсическим веществом, если из него образуются так называемые активные формы.
К активным формам кислорода относят:
ОН • — гидроксильный радикал;
О2 • — супероксидный анион;
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода. Конечный продукт этих реакций — вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления. Эти свободнорадикальные реакции окисления могут выполнять полезные функции, например, когда клетки белой крови с участием активных форм кислорода разрушают фагоцитированные клетки бактерий. Но в остальных клетках свободнорадикальное окисление приводит к разрушению органических молекул, в первую очередь липидов, и, соответственно, мембранных структур клеток, что часто заканчивается их гибелью. Поэтому в организме функционирует эффективная система ингибирования перекисного окисления липидов (ПОЛ).
А. Источники активных форм кислорода
ЦПЭ как источник активных форм кислорода
Утечка электронов из ЦПЭ и непосредственное их взаимодействие с кислородом — основной путь образования активных форм кислорода в большинстве клеток.
Кофермент Q в ЦПЭ принимает от доноров последовательно по одному электрону, превращаясь в форму семихинона (рис. 8-55) — КоQН • (см. раздел 6).
Этот радикал может непосредственно взаимодействовать с кислородом, образуя супероксидный анион О2 • , который, в свою очередь, может превращаться в другие активные формы кислорода:

Рис. 8-55. Реакции последовательного восстановления убихинона в дыхательной цепи.

Реакции, катализируемые оксидазами и оксигеназами
Многие оксидазы — ферменты, непосредственно восстанавливающие кислород, образуют пероксид водорода — Н2O2. Оксидазы образуют пероксид водорода по схеме:
Примеры таких оксидаз — оксидазы аминокислот, супероксид дисмутаза, оксидазы, локализованные в пероксисомах. Оксидазы пероксисом окисляют, в частности, жирные кислоты с очень длинной углеродной цепью (более 20 углеродных атомов) до более коротких, которые далее подвергаются β-окислению в митохондриях.
Монооксигеназы, например, цитохром Р450, включающий один атом кислорода в окисляемую молекулу, и диоксигеназы, включающие оба атома кислорода, также служат источниками активных форм кислорода.
Пероксид водорода химически не очень активен, но способствует образованию наиболее токсичной формы кислорода — гидроксильного радикала (ОН•) по следующей реакции:
Наличие в клетках Fе 2+ или ионов других переходных металлов увеличивает скорость образования гидроксильных радикалов и других активных форм кислорода. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного аниона.
Б. Перекисное окисление липидов
ПОЛ — цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления.
Стадии перекисного окисления липидов
1) Инициация: образование свободного радикала (L•)

Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2-групп полиеновой кислоты, что приводит к образованию липидного радикала.

Развитие цепи происходит при присоединении O2, в результате чего образуется липопероксирадикал LOO• или пероксид липида LOOH.
ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других.
3) Разрушение структуры липидов

Конечные продукты перекисного окисления полиеновых кислот — малоновый диальдегид и гидропероксид кислоты.
4) Обрыв цепи — взаимодействие радикалов между собой:

Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в стабильную окисленную форму.
В. Повреждение клеток в результате перекисного окисления липидов
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении.
Такая же ситуация возникает при образовании тромба в сосуде, питающем миокард. Формирование тромба приводит к окклюзии просвета сосуда и развитию ишемии в соответствующем участке миокарда (гипоксия ткани). Если принять быстрые лечебные меры по разрушению тромба, то в ткани восстанавливается снабжение кислородом (реоксигенация). Показано, что в момент реоксигенации резко возрастает образование активных форм кислорода, которые могут повреждать клетку. Таким образом, даже несмотря на быстрое восстановление кровообращения, в соответствующем участке миокарда происходит повреждение клеток за счёт активации перекисного окисления.
Изменение структуры тканей в результате ПОЛ можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней. Этот пигмент называют липофусцин, представляющий собой смесь липидов и белков, связанных между собой поперечными ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, и поэтому накапливается в клетках, нарушая их функции.
ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при неправильном приготовлении и хранении пищи. Прогоркание жиров, образование более тёмного слоя на поверхности сливочного масла, появление специфического запаха у молочных продуктов — всё это признаки ПОЛ. В продукты питания, содержащие ненасыщенные липиды, обычно добавляют антиоксиданты — вещества, ингибирующие ПОЛ и сохраняющие структуру компонентов пищи.
Г. Системы защиты клеток от активных форм кислорода
Ферменты антиоксидантного действия
К ферментам, защищающим клетки от действия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико. Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода:
Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи.
СОД — ицдуцируемый фермент, т. е. синтез его увеличивается, если в клетках активируется перекисное окисление.
Пероксид водорода, который может инициировать образование самой активной формы ОН • , разрушается ферментом каталазой:
Глутатионпероксидаза — важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (y-глутамилцистеинилглицин). Сульфгидрильная группа глутатиона (GSН) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона, в которой 2 молекулы глутатиона связаны через дисульфидную группу.
Окисленный глутатион восстанавливается глутатионредуктазой:
GS-SG + NADPH + Н + —> 2 GSH + NADP + .
Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается.
Витамины, обладающие антиоксидантным действием
Витамин Е (α-токоферол) — наиболее распространённый антиоксидант в природе — является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен.
Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (ROO • ), восстанавливая его до гидропероксида (ROOH) и таким образом останавливает развитие ПОЛ (рис. 8-56).
Рис. 8-56. Механизм антиоксидантного действия витамина Е. Витамин Е (α-токофероп) ингибирует свободнорадикальное окисление путём отдачи электрона, что приводит к инактивации радикала липида, а витамин Е превращается в стабильный, полностью окисленный токоферолхинон.

Свободный радикал витамина Е, образовавшийся в результате реакции, стабилен и не способен участвовать в развитии цепи. Наоборот, радикал витамина Е непосредственно взаимодействует с радикалами липидных перекисей, восстанавливая их, а сам превращается в стабильную окисленную форму — токоферолхинон.
Витамин С (аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в ингибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода — O2 • , Н2O2, ОН• и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ингибирует ПОЛ. Показано, что растительная диета, обогащённая витаминами Е, С, каротиноидами, существенно уменьшает риск развития атеросклероза и заболеваний ССС, подавляет развитие катаракты — помутнения хрусталика глаза, обладает антиканцерогенным действием. Имеется много доказательств в пользу того, что положительное действие этих компонентов пищи связано с ингибированием ПОЛ и других молекул и, следовательно, с поддержанием нормальной структуры компонентов клеток.
Академический редактор: Кота В. Рамана
Известно, что мозг чувствителен к окислительному стрессу и перекислению липидов. Было показано, что, несмотря на то, что перекисное окисление липидов способствует многим процессам болезни, его роль в психиатрической болезни еще не исследовалась до недавнего времени. В этой статье мы предлагаем обзор перекисного окисления липидов в центральной нервной системе, а также клинические данные, подтверждающие связь между перекисным окислением липидов и такими нарушениями, как шизофрения, биполярное расстройство и основное депрессивное расстройство. Эти данные подтверждают дальнейшее исследование перекисного окисления липидов с целью выявления терапевтических целей и биомаркеров психиатрического заболевания.
За последнее столетие несколько областей клинического и биомедицинского исследования претерпели столь же быстрое преобразование, как и нейронаука психических расстройств. В последние несколько десятилетий все более сложные эксперименты, исследовательские инструменты и модельные системы привели к более тонкому подходу к фармакотерапии. Хотя в настоящее время считается, что различные психические расстройства связаны с уникальными отклонениями в биохимии, схеме и / или мозговой архитектуре нейронов, новые данные свидетельствуют о наличии окислительного стресса и могут играть активную роль в этих психиатрических заболеваниях. В этой статье мы проведем оценку недавних клинических данных о перекисном окислении липидов, применительно к патобиологии шизофрении, биполярного расстройства, основного депрессивного расстройства и ряда других психических расстройств.
Степень окислительного стресса в клеточной среде является прямым результатом тех процессов, которые ускоряют производство активных форм кислорода и тех, которые их детоксифицируют (обсуждение окислительного стресса см. В [1]). Реактивные виды кислорода, такие как супероксидный анион и гидроксильные радикалы, получают из различных клеточных процессов. Эти реакционноспособные виды кислорода нейтрализуются антиоксидантами, такими как витамины С и Е, а также ферментами, такими как супероксиддисмутаза (СОД), каталаза и глутатионпероксидаза. Низкие уровни реакционноспособных видов кислорода используются окислительно-восстановительными датчиками для модуляции функции клеток, но высокие уровни реактивных видов кислорода повреждают и окисляют нуклеиновые кислоты, углеводы и липиды. Мозг составляет приблизительно 2% от общей массы тела, но использует 20% общего кислорода, что позволяет использовать достаточные метаболические субстраты для генерации свободных радикалов [2]. В свете этого и учитывая тот факт, что липиды являются основными компонентами нейронных мембран, а также миелиновых оболочек, которые помогают вести нейронную сигнализацию, их перекисное окисление и дисфункция могут резко нарушать функцию мозга во всем мире.
До настоящего времени перекисное окисление липидов головного мозга не может быть непосредственно оценено живыми субъектами. Вместо этого маркеры глобального окислительного стресса могут аппроксимировать перекисное окисление липидов и включать в себя антиоксидантный статус и активность антиоксидантных ферментов, таких как супероксиддисмутаза, каталаза и глутатионпероксидаза, периферически [3]. Более прямые меры перекисного окисления липидов in vivo включают оценку реакционноспособных видов изопростантов и малоандиальдегида / тиобарбитуровой кислоты в различных биологических жидкостях или алканах, таких как пентан в выдыхаемом воздухе [3,4]. Хотя дисфункция уровня цепи и динамическая патофизиология психических расстройств плохо аппроксимируются посмертным исследованием головного мозга, такой анализ ткани может помочь в локализации перекисного окисления липидов в регионах, которые, как известно, важны для психического заболевания.
Наибольшим доказательством перекисного окисления липидов при шизофрении являются косвенные маркеры, такие как активность СОД, каталаза и глутатионпероксидаза. Повышенная периферическая активность SOD наблюдалась у пациентов с шизофренией, коррелируя с положительными симптомами (галлюцинациями, бредом, дезорганизованным поведением) и снижается при введении антипсихотических препаратов [7, 8]. Тем не менее, в нескольких сообщениях было высказано предположение о том, что повышенная активность СОД происходит на поздних стадиях заболевания, при этом снижается активность СОД рано и у молодых пациентов, что подразумевает, что функция СОД варьируется в зависимости от прогрессирования заболевания [9, 10]. В последнее время исследование полиморфизма SOD у пациентов с шизофренией показало связь между вариантом Ala-9Val и более низкой эффективностью в нейропсихологической оценке [11]. Активность каталазы при шизофрении сообщается как увеличенная, неизменная или уменьшенная различными исследователями, хотя, вероятно, периферические уровни плохо приближают уровни содержания каталазы в мозге, особенно потому, что активность каталазы может быть резко изменена антипсихотическими препаратами 14. Наконец, глутатионпероксидаза, как сообщается, как правило, снижается периферически, а также в посмертных мозгах. В целом, эти данные свидетельствуют о наличии прооксидативного состояния при шизофрении. Оценка более прямых маркеров перекисного окисления липидов в целом подтвердила более косвенные оценки: пациенты с шизофренией имеют больший плазменный и цереброспинальный уровни реакционноспособных веществ тиобарбитуровой кислоты, увеличенный выдыхаемый пентан и увеличенный мочевой изопростан-8-эпи-простагландин F2α [15- 18].
Были предприняты клинические вмешательства, направленные на смягчение последствий перекисного окисления липидов, включая введение эйкозапентаеновой кислоты, длинноцепочечной омега-3 жирной кислоты, витаминного антиоксиданта (прежде всего витаминов Е и С) и N-ацетилцистеина 21. Тем не менее, никакое плацебо-контролируемое исследование до настоящего времени не продемонстрировало долгосрочное улучшение симптомов после нормализации перекисного окисления липидов. В то время как некоторые сообщили, что антипсихотические препараты, используемые для шизофрении, изменили маркеры окислительного стресса, другие не обнаружили улучшения 26. Интересно, что электросудорожная терапия у пациентов с шизофренией уменьшает реакционные вещества плазменной тиобарбитуровой кислоты, что проявляется только через несколько месяцев после первоначальной терапии [13].
Биполярное расстройство — это расстройство настроения, характеризующееся периодами как мании, так и депрессии. Хотя его лежащая в основе патофизиология остается многогранной и неуловимой, последние данные свидетельствуют о том, что митохондриальная дисфункция и аберрация в статусе окисления являются важными компонентами биполярного расстройства. Ранее Андреаза и коллеги показали, что реакционноспособные вещества тиобарбитуровой кислоты повышаются в обоих эпизодах мании и депрессии и даже повышаются по сравнению с контролем при ремиссии [27, 28]. Помимо общего прооксидативного состояния, окислительный ущерб также локализуется при биполярном расстройстве. Используя посмертные образцы головного мозга, Андреаза и коллеги отмечали повышенное карбонилирование и нитрование наряду с уровнями альфа-изопростана-8-эпи-простагландина F2 в префронтальной коре пациентов с биполярным расстройством [29]. Кроме того, окисление также, по-видимому, локализуется в дофаминовых транспортер-позитивных и тирозин-гидроксилазных нейронах в префронтальной коре [30]. У пациентов с депрессией или эутимией у пациентов с биполярным расстройством нарушение цикла сна положительно коррелирует с мерами уровня малонового диальдегида, отношения, не встречающиеся в сопоставимых по возрасту здоровом контроле, что предполагает, что перекисное окисление липидов следует за курсом болезни, а не происходит случайно [31]. Уровни каталазы и глутатионпероксидазы также повышаются у пациентов с биполярным расстройством во время депрессивных эпизодов [32]. Лечение липием стабилизатора настроения уменьшает реактивные вещества тиобарбитуровой кислоты у пациентов, представляющих начальный маниакальный эпизод, а также у пациентов с эпизодами гипомании (биполярное расстройство типа II) [32, 33]. Было отмечено, что введение лития у пациентов с биполярным расстройством увеличивает активность АТФазы Na + K +, клеточного события, которое независимо связано с уменьшением перекисного окисления липидов [34]. Корреляция между периферически собранными маркерами перекисного окисления липидов и магнитно-резонансной томографией пациентов с биполярным расстройством также объясняет большую часть дисперсий в белых повязках на изображениях тензора диффузии в их мозгу. Продольные проспективные исследования, которые снижают окислительную нагрузку у пациентов в дополнение к лечению стабилизаторами настроения, были бы поучительны, чтобы определить, какая часть бремени болезни может быть связана с перекисным окислением липидов при биполярном расстройстве.
Основным депрессивным расстройством характеризуются подавленное настроение и симптомы, которые значительно ухудшают нормальную функцию. Основная фармакологическая терапия при главном депрессивном расстройстве включает использование серотонинергических и норадренергических средств для симптоматического контроля, но несколько наблюдений привели к рассмотрению целей перекисного окисления липидов в этом заболевании. Например, люди, страдающие депрессией, как молодые взрослые, демонстрируют повышенный уровень сердечной заболеваемости и смертности в более позднем возрасте, а мета-анализ показал, что у пациентов, страдающих депрессией после инфаркта миокарда, хуже сердечные исходы у пациентов, не страдающих депрессией [35, 36]. Поскольку основной компонент сердечно-сосудистого риска связан с окислением липидов и прогрессированием атеросклеротической бляшки, комментаторы предположили, что повышенная окислительная нагрузка при главном депрессивном расстройстве может объяснять этот вывод. В недавнем исследовании пожилых людей, живущих в общине, уровни изопростан-8-эпипластендина F2α в изопростане-8-эпи-простагландине были выше у пациентов с депрессивными симптомами, чем при недержащих контролях [37]. Эти результаты наблюдались в более молодой когорте, а другая работа также указывала на то, что повышенный мочевой изопростан-8-эпи-простагландин F2-альфа ассоциируется с подавленным настроением, особенно у мужчин [38, 39]. Повышенные уровни глутатионпероксидазы и супероксиддисмутазы обнаруживаются у пациентов с депрессией, особенно у пациентов с хроническим заболеванием, и эти возвышения сохраняются в течение нескольких месяцев даже после начала стандартной фармакотерапии [40, 41]. Таким образом, перекисное окисление липидов, по-видимому, значительно нарушается при большой депрессии, и его ослабление может быть полезным для уменьшения случайного заболевания. Как и при данных шизофрении и биполярных расстройствах, необходимо провести долгосрочные исследования, чтобы лучше понять роль перекисного окисления липидов при большой депрессии.
Доказательства перекисного окисления липидов также были недавно обнаружены в других психических расстройствах. В небольшом исследовании взрослых с синдромом дефицита внимания с гиперактивностью уровни сывороточного малондиальдегида были повышены по сравнению с контролем без контроля; однако не было обнаружено корреляции между серьезностью симптомов на нейропсихиатрической батарее и уровнями малонового диальдегида [42]. У детей с расстройством гиперактивности дефицита внимания также обнаружено, что продукты перекисного окисления липидов увеличиваются в моче по сравнению с контрольными [43]. Напротив, сывороточные уровни малонового диальдегида были сопоставлены с поведенческой оценкой тяжести обсессивно-компульсивного расстройства [44]. В нескольких сообщениях также описывается связь между другими тревожными расстройствами и окислительным стрессом, включая генерализованное тревожное расстройство, паническое расстройство и посттравматическое стрессовое расстройство 46. Повышенные маркеры окисления также обнаружены в областях мозга пациентов с расстройством спектра аутизма, в том числе в височной коре и мозжечке 48. Однако исследование окислительного стресса и перекисного окисления липидов в других психиатрических заболеваниях, таких как расстройства личности и расстройства пищевого поведения, не проводилось широко.
Таким образом, недавние клинические данные выявили окислительный ущерб, и перекисное окисление липидов наблюдается в нескольких психических расстройствах. Необходимо провести более крупные продольные исследования, чтобы определить, можно ли использовать меры перекисного окисления липидов и окислительного стресса для определения риска развития различных психиатрических заболеваний и для того, чтобы определить, могут ли долгосрочные результаты заболевания быть изменены с помощью вмешательств, которые уменьшают активность активных форм кислорода. Оценка окислительного повреждения и перекисного окисления липидов у пациентов в настоящее время ограничена использованием косвенной периферической оценки перекисного окисления липидов головного мозга или посмертного анализа образцов головного мозга. Поскольку перекисное окисление липидов, по-видимому, присутствует в нескольких психиатрических расстройствах, меры перекисного окисления липидов не могут использоваться в качестве конкретных биомаркеров для скрининга или мониторинга прогрессирования заболевания. Разработка более сложных методов обнаружения перекисного окисления липидов, несомненно, была бы полезной в этом отношении. Несмотря на это, исходя из имеющихся данных, дальнейшее исследование перекисного окисления липидов при психическом заболевании, скорее всего, выявит клинически значимую информацию и должно быть проведено.
Авторы заявляют, что не существует конфликта интересов в отношении публикации этого документа.
Процесс перекисного окисления липидов (ПОЛ) является важной причиной накопления клеточных дефектов. Основным субстратом ПОЛ являются полиненасыщенные цепи жирных кислот, входящих в состав клеточных мембран, а также липопротеинов. Их атака кислородными радикалами приводит к образованию гидрофобных радикалов, взаимодействующих друг с другом [1–3]. В результате такого взаимодействия в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшена), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей [4]. Поиск веществ регулирующих активность ПОЛ является одной из актуальных научных проблем.
Влияние аллогенных мононуклеарных клеток, введенных в вену, на активность ПОЛ мозговой ткани фактически не изучено, тем более в разные сроки после трансплантации, хотя именно этот аспект проблемы представляет огромный практический интерес.
Материалы и методы исследования
Для получения мононуклеарной фракции использовали аспират костного мозга бедренной кости 3х-мес крыс. Костный мозг заготавливали, аспирируя клетки из полостей трубчатых костей. Дальнейшее очищение состояло из удаления фрагментов кости фильтрацией и изоляции лейкоцитарного слоя (buffy-coat) после центрифугирования. Выделение мононуклеарной фракции из донорского костного аспирата проводили по методу Boyum [8].
Полученные результаты статистически обрабатывали с использованием программы Microsoft Excel и изменения параметров с учетом непарного критерия Фишера – Стьюдента и считали достоверными при р ≤ 0,05. Также использовали непараметрические тесты Манна-Уитни. Результаты представлены в виде M ± m, где М – среднее значение, m – ошибка среднего, p – уровень значимости: p ≤ 0,05 при сравнении всех групп с контрольной группой.
Результаты исследований и их обсуждение
После трансплантации МНК определяли уровень малонового диальдегида (МДА), диеновых коньюгат (ДК) и оксида азота на 30, 60 и 90 сут наблюдений. Данные по этим показателям показаны в таблице.
У интактных 12-мес животных контрольной группы МДА составлял 8,24 ± 1,69 нмоль/мг белка мозговой ткани, у 18-мес. статистически значимо МДА возрастал до уровня 8,56 ± 0,15, у 24-мес – до 9,03 ± 1,38 нмоль/мг белка ткани. Повышение МДА у крыс с 12-мес. возраста до 24-мес возраста составило 110 % (таблица).
После введения МНК во всех группах крыс, независимо от возраста, на всем периоде наблюдений наблюдали снижение уровня МДА в мозговой ткани на 30–48 %, более выраженное у молодых 12-мес. животных, по сравнению с контрольными данными (таблица).
После трансплантации МНК содержание ДК в гомогенате головного мозга опытных крыс увеличилось в среднем за весь период наблюдений на 15 % у 12-мес., на 2 % – у 18-мес. и 3 % – у 24-мес. крыс по отношению к контрольным данным. Такое увеличение ДК отражает тенденцию к накоплению продуктов перекисного окисления липидов в мозговой ткани крыс после введения МНК.
Следовательно, после трансплантации аллогенных МНК уровень МДА – конечного продукта липопероксидации – в мозговой ткани снижается во всех возрастных группах на протяжении всего периода наблюдений по сравнению с контролем, на фоне незначительного увеличения промежуточного продукта ДК.
Это отражает разную скорость генерации и расхода энергии в клетках, что по мере окислительной деградации, развивающейся как компенсаторно-адаптационная реакция на стресс – введение МНК, приводит к разбалансировке уровня конечного и промежуточного продуктов окисления. Большое значение при этом играет срок исследования последействия МНК. Вероятно, что 30 и 60 сут после введения МНК отражают процесс острой фазы пероксидации.
Для окончательного выявления состояния окислительной активности мозговой ткани после введения МНК определяли уровень оксида азота NOx в гомогенате мозга. Для этого использовали спектрофотометрический метод определения. Для построения калибровочной кривой использовали 1М водный раствор NaNO2. Количество нитрита рассчитывали в мкмолях/л по калибровочной кривой. Полученные результаты представлены в таблице.
Уровень малонового диальдегида (МДА), диеновых коньюгатов (ДК) и оксида азота (NOx) в гомогенате головного мозга крыс в разные сроки после введения МНК
Переписное окисление липидов (ПОЛ) представляет собой свободнорадикальный цепной процесс, протекающий в биомембранах и липопротеинах крови, который сопровождается ступенчатой окислительной деградацией полиненасыщенных жирных кислот фосфолипидов с образованием свободнорадикальных и молекулярных продуктов, обладающих разнообразными физиологическими и патологическими эффектами.
Свободнорадикальные реакции ПОЛ постоянно протекают во всех организмах– от микроорганизмов до животных и человека.
- обновление мембранных липидов
- поддержание структурного гомеостаза
- биосинтез биологически активных соединений (простагландинов, тромбоксанов, лейкотриенов)
- функционирование мембранных ферментов
- Чрезмерная активация ПОЛ приводит к развитию патологических процессов (окислительный стресс).
Общее уравнение свободнорадикального ПОЛ имеет следующий вид:
(L • + LO • ) + LH + O2 → (L • + LO • ) + LOOH + H2O
L • , LO • - липидные радикалы
LH - полиненасыщенная жирная кислота (ПНЖК)
LOOH – гидроперекись липида
Субстратами ПОЛ являются полиненасыщенные жирные кислоты фосфолипидов, которые могут подвергаться свободнорадикальному окислению (СРО) как после гидролиза фосфолипазами типа А2, так и находясь в составе мембранных фосфолипидов. В результате ПОЛ происходит постепенная деградация ПНЖК с образованием различных свободнорадикальных интермедиатов, промежуточных высокоактивных молекулярных продуктов, а также широкого набора низкомолекулярных конечных соединений и продуктов полимеризации с неопределенной структурой.
Особенности:
О2 - зависимый процесс. О2 необходим для образования АКМ, для инициации процесса, реакций продолжения и разветвления цепи;
2. скорость процесса зависит не только от концентрации исходных и конечных веществ, но и от содержания промежуточных соединений – липидных радикалов;
3. большая зависимость ПОЛ от температуры среды
4. скорость ПОЛ сильно зависит от степени ненасыщенности липидов;
5. ПОЛ инициируется путем отрыва атома водорода от атома углерода в α-положении, т.е. соседнего с двойной связью;
6. по типу утилизации кислорода ПОЛ относится к диоксигеназному пути окисления.
Стадии ПОЛ.
В развитии процесса ПОЛ выделяют 4 стадии:
1. Инициация или зарождение цепи. Самым мощным индуктором ПОЛ является гидроксильный радикал (ОН•).
Гидроксильный радикал образуется в организме в реакции Фентона:
2. Продолжение цепи.
3. Разветвление цепи. На этой стадии участвуют металлы переменной валентности и скорость процесса возрастает в десятки раз.
LOOH + Fe 2+ → LO• + OH‾ + Fe 3+
4. Обрыв цепи .
L• + L• → L-L LO2• + LO2• → LOH + L=O + O2 + hῡ↑
Данная реакция называется реакцией диспропорционирования или квадратичного обрыва, в результате образуется органический спирт, кетон и высвечиваются кванты света. Эта реакция вносит важный вклад в процесс сверхслабого свечения или хемилюминесценции, который сопровождает ПОЛ.
На стадии обрыва цепи принимают участие различные антиоксиданты.
где InH – антиоксидант, который переходит в свободнорадикальное состояние In•, которое восстанавливается другими антиоксидантами.
Продукты ПОЛ, их характеристика.
В процессе ПОЛ образуются разнообразные продукты, которые условно делят на два типа:
1.Свободнорадикальные продукты - L•, LO•, LO2•.
2. Молекулярные продукты, которые делятся на 3 класса:
- первичные (диеновые конъюгаты, триеновые конъюгаты, диенкетоны и др.);
- вторичные, или промежуточные (карбонильные соединения – альдегиды, кетоны), в том числе малоновый диальдегид;
- конечные (шиффовы основания, алканы).
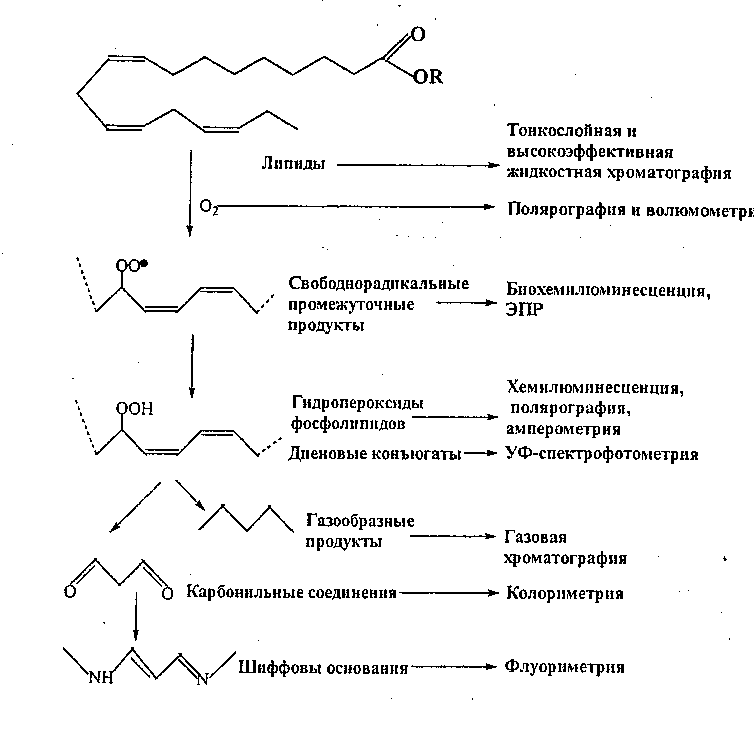
Рис.1. Продукты ПОЛ
Для поддержания ПОЛ на стационарном уровне в организме существуют антиоксидантная система, которая ингибируют ПОЛ на различных стадиях цепного процесса.
Антиоксиданты (АО) – широкий класс соединений различной химической природы, которые тормозят ПОЛ на различных стадиях цепного процесса.
К антиоксидантам относятся:
1) Ферментативные АО (супероксиддисмутаза, каталаза, пероксидазы), которые характеризуются высокой специфичностью.
Например, супероксиддисмутаза (СОД) обезвреживает супероксидный анион-радикал:
Каталаза превращает Н2О2 в воду и кислород:
Глутатионпероксидаза (ГПО) восстанавливает перекиси липидов до органических спиртов:
LOOH + 2GSH → LOH + GSSG + Н2О
GSH - восстановленный глутатион (Глу-Цис-Гли)
GSSG - окисленный глутатион
2) Неферментативные (низкомолекулярные) АО (аскорбат, α-токоферол, аминокислоты, пептиды, SH-соединения, эстрогены, мочевая кислота, мочевина и др.).
3) Соединения-комплексоны, которые связывают металлы переменной валентности (например, Fe 2+ ), предотвращают реакцию Фентона, уменьшают продукцию токсичного гидроксильного радикала (ОН•) и тем самым снижают интенсивность ПОЛ (десферал, этилендиаминтетраацетат-ЭДТА).
4) Гидрофобные мембранотропные соединения (α-токоферол, холестерол и др.) тормозят ПОЛ в липидном бислое мембран путем восстановления активных форм кислорода и радикалов липидов (L•, LO•, LO2•).
Усиление процессов ПОЛ вследствие повышенного образования АФК и недостаточности антиоксидантной системы приводит к глубоким нарушениям структурно-функционального состояния биомембран. Это играет важную роль в механизмах окислительного стресса.
Влияние ПОЛ на биомембраны.
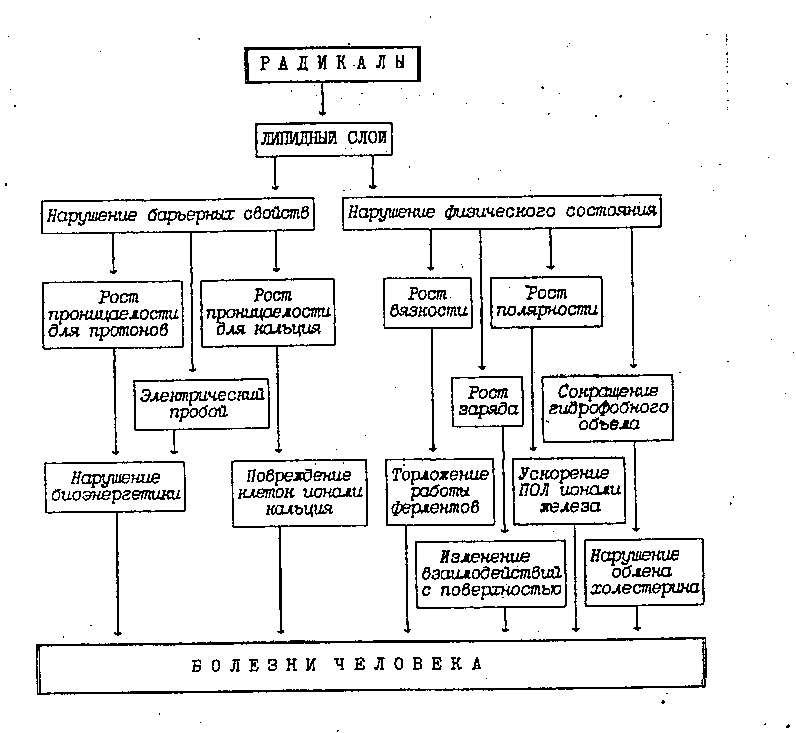
Рис. 2. Влияние ПОЛ на липидный бислой мембран
Влияние ПОЛ на липидный бислой осуществляется по 2 главным направлениям:
I. Нарушение барьерных свойств.
II. Нарушение физического состояния.
I. Нарушение барьерных свойств - это острое повреждение приводит к гибели клетки. Это повреждение реализуется путем 3 главных нарушений:
1) роста проницаемости для протонов;
2) роста проницаемости для кальция;
3) нарушения электрической стабильности мемюраны.
1.Рост проницаемости для протонов, прежде всего, наблюдается во внутренней мембране митохондрий, где локализована электрон-транспортная цепь (ЭТЦ). В норме внутренняя мембрана митохондрий не проницаема для Н + , транслокация протонов присходит через I, III, и IV ферментативные комплексы ЭТЦ против градиента концентрации за счет энергии электронов, которые поступают из цикла Кребса и переносятся по ЭТЦ. В результате повышения интенсивности ПОЛ во внутренней мембране митохондрий повышается проницаемость для протонов, что препятствует созданию ΔμН + и последующему синтезу АТФ, что приводит к нарушению биоэнергетики.
| Комплекс I НАДН-дегидрогеназа |
| Комплекс II Сукцинат-дегидрогеназа |
| Комплекс V АТФ-синтаза |
| Комплекс IV цитохромокси-доредуктаза |
| Комплекс III Убихинон-цитохром-с-оксидоредуктаза |
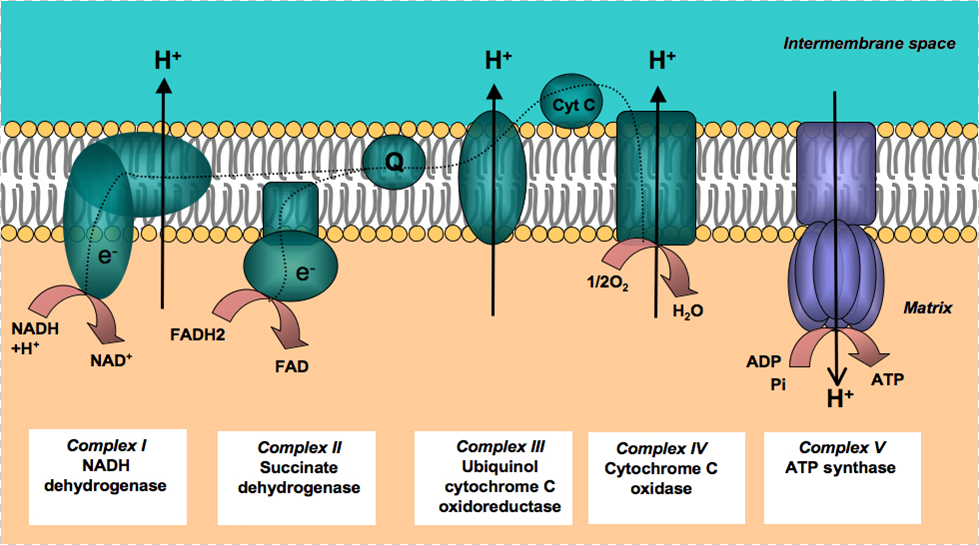
Рис.2 - Электрон-транспортная цепь митохондрий
2. Рост проницаемости для Са 2+ - при активации ПОЛ происходит повышение проницаемости для кальция плазматической мембраны и субклеточных мембран: мембран ЭПР и митохондрий, где имеются депо ионов кальция. Клетка чрезвычайно чувствительна к концентрации Са 2+ , который является вторичным посредником и его концентрация внутри клетки в 10000 раз ниже, чем во внеклеточном пространстве. Перегрузка клетки ионами кальция может приводить к гибели клетки.
3. Электрический пробой клетки собственным мембранным потенциалом - повышение интенсивности ПОЛ приводит к нарушению электрической стабильности биомембран. Гидрофильные продукты ПОЛ типа гидроперекисей липидов (LOOH) могут выталкиваться из гидрофобного объема мембраны, что приводит к его сокращению. В результате снижается электрическая стабильность мембраны, которая может разрушаться собственным мембранным потенциалом.
II. Нарушение физического состояния биомембран - это повреждения, которые сопровождают хронические патологические процессы.
1. Рост относительной микровязкости липидного бислоя БМ - повышение интенсивности ПОЛ приводит к снижению содержания полиненасыщенных жирных кислот (ПНЖК) в мембранных липидах, т.к. ПНЖК являются субстратом ПОЛ. При протекании ПОЛ происходит ступенчатая окислительная деградация ПНЖК и насыщенность мембранных липидов увеличивается, что повышает микровязкость. Пластичность мембран снижается, они становятся более ригидными и легко разрушаются. Повышение микровязкости липидного бислоя мембран приводит к снижению активности мембранных ферментов, функция которых зависит от липидного микроокружения.
2. Рост отрицательного поверхностного заряда биомембран - при повышении уровня ПОЛ происходит образование различных продуктов ПОЛ и, прежде всего, гидроперекисей липидов, которые гидрофильны и вследствие гидрофобности внутреннего объема мембраны могут изменять свою локализацию.
Диффузия к поверхности раздела мембраны гидрофильное/гидрофобное - на границе с цитоплазмой или внеклеточной средой. Здесь на границе раздела гидроперекиси липидов диссоциируют: LOOH ↔ H + + LOO - . Анионы гидроперекисей липидов вызывают повышение отрицательного поверхностного заряда биомембран, что негативно влияет на межклеточные взаимодействия.
3. Рост полярности гидрофобного объема мембраны - при усилении ПОЛ во внутреннем пространстве мембраны образуются гидрофильные продукты ПОЛ (гидроперекиси и др.), которые в силу гидрофобности внутреннего объема образуют "гидрофильные кластеры" для уменьшения контактов с гидрофобным микроокружением. В гидрофильные кластеры устремляются различные гидрофильные молекулы, в том числе, вода и Fe 2+ . Диффузия воды во внутренний объем мембраны нарушает ее стабильность. Это явление Владимиров Ю.А. назвал "водной коррозией" мембраны.
Появление Fe 2+ в гидрофильных кластерах мембраны приводит к запуску реакции разветвления цепи c образованием высоко токсичного липоксильного радикала и еще большему усилению ПОЛ:
LOOH + Fe 2+ ↔ LO ● + OH ─ + Fe 3+
4. Сокращение гидрофобного объема мембраны - в результате усиления ПОЛ часть гидрофильных продуктов ПОЛ выталкиваются из мембраны, что приводит к снижению гидрофобного объема мембраны. Это приводит к нарушению обмена холестерина. В результате ПОЛ и изменения структуры липопротеинов низкой плотности (ЛПНП), которые являются транспортной формой холестерина в крови, ЛПНП легче отдают холестерин, например, мембранам клеток крови, а липопротеины высокой плотности значительно медленнее забирают холестерин из мембран. В результате холестерин накапливается в мембранах и повышает их микровязкость. Известно, что микровязкость липидного бислоя повышается при увеличении содержания ПНЖК и холестерина.
5. Скрамблинг - нарушение асимметрии липидного бислоя мембран. Известно, что важнейшим свойством мембранных липидов является трансмембранная асимметрия липидного бислоя, т.е. различное распределение липидов между внутренним и наружным монослоями.
1. Во внешнем монослое локализуются холинсодержащие ФЛ (фосфатидилхолин, сфингомиелин), а также стероид холестерол.
2. Во внутреннем монослое локализуются аминосодержащие ФЛ (фосфатидилэтаноламин, фосфатидилсерин).
3. Во внешнем монослое сосредоточена 1/3 двойных связей, во внутреннем – 2/3 двойных связей.
При усилении ПОЛ активируются скрамблазы, которые нарушают асимметрию липидного бислоя. В результате во внешнем монослое появляется фосфатидилсерин (ФС), который называют рецептором "съешь меня". Он является сигналом к апоптозу и поглощению клетки макрофагами.
Понятие об антиоксидантах.
См продукты 28
Доп
Для поддержания активности процессов ПОЛ на стационарном уровне в организме, имеются разнообразные антиоксидантные системы. Недостаток поступления облигатных антиоксидантов и дефицит эндогенных антиоксидантных систем приводит к развитию свободно-радикальных патологий. Действие внешних прооксидантов (радиация, ультрафиолет; загрязнители воздуха, гипероксия, гипоксия и др.) и активация эндогенных механизмов генерации активированных кислородных метаболитов (АКМ) приводит к напряжению механизмов антиоксидантной защиты и развитию окислительного стресса, при котором происходит сдвиг равновесия системы антиоксиданты прооксиданты в сторону последних. Окислительный стресс играет важную роль в патогенезе многих заболеваний.
В инициации ПОЛ ведущая роль отводится активным формам кислорода (АФК), которые постоянно образуются в организме:
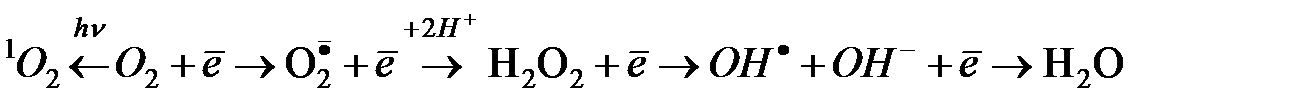
Процесс последовательного восстановлении кислорода лежит в основе двух главных типов окислительных превращений биосубстратрв в клетке: оксидазного и оксигеназного.

Схема участия молекулярного кислорода в окислительных превращениях субстратов (S) в клетке.
Типичным примером оксидазного пути являются процессы окисления энергетических субстратов в митохондриях, где восстановление кислорода катализируется цитохромоксидазой. Огромное разнообразие реакций гидроксилирования монооксигеназного типа в клетках катализируется полиферментным комплексом, содержащим в качестве терминальной оксигеназы цитохром Р-450.
Примером реакции диоксигеназного типа является процесс перекисного окисления внутриклеточных липидных субстрато
Дата добавления: 2019-02-22 ; просмотров: 651 ;
Читайте также:


