Пэт при болезни паркинсона
- Все новости
- Лечение в Израиле
- Новости компании
- Новости клиники Ихилов
- Новости медицины

Болезнь Паркинсона представляет собой хроническое дегенеративное заболевание центральной нервной системы, характеризующееся прогрессирующим нарушением двигательной функции, развивающееся в результате нарушения механизма секреции нейротрансмиттера допамина на фоне дегенерации нервных клеток и чёрного вещества (substantia nigra) в головном мозге.
Распространённость болезни Паркинсона
Болезнь Паркинсона является вторым по распространённости нейродегенеративным заболеванием. Средний возраст пациентов с данным диагнозом составляет 62-63 года. Приблизительно в 10% случаев возраст пациента составляет менее 40 лет. Показатели заболеваемости увеличиваются с возрастом, и достигают 1-3% в возрастной группе старше 80 лет. Согласно данным израильского министерства здравоохранения, на сегодняшний день в Израиле живут порядка 27000 пациентов с диагнозом болезни Паркинсона, в то время как ежегодно диагностируется 2500 новых случаев заболевания.
Согласно некоторым данным, процент ошибочной диагностики болезни Паркинсона, когда она основана лишь на клинической диагностике, превышает 35%.
Давайте разберемся в методах лечения болезни Паркинсона в Израиле. Обследование начинается с томографии головного мозга с помощью КТ или МРТ и с помощью ПЭТ-КТ с флюородопа (18-F-Dopa)
Болезнь Паркинсона: Диагностика
Лечение паркинсонизма в Израиле начинается с тщательной диагностики. Большинством неврологов диагноз болезни Паркинсона выносится на основании клинической картины и данных клинического опросника UPDRS (Unified Parkinson’s Disease Rating Scale). Также, немаловажной частью диагностики болезни Паркинсона является исключение органической патологии путём проведения КТ или МРТ головного мозга. На ранних этапах заболевания, когда клиническая симптоматика ещё не ярко выражена, однозначное вынесение диагноза затруднительно, в связи с чем, требуется применение дополнительных диагностических методов. И тут на помощь приходит дополнительный метод диагностики, обладающий практически 100% точностью в показателях — это ПЭТ-КТ с 18-F-Dopa.
ПЭТ-КТ с 18-F-Dopa
ПЭТ-КТ с флюородопа (18-F-Dopa) является вспомогательным методом диагностики болезни Паркинсона и представляет собой радиоизотопное исследование головного мозга, выполняющееся с целью метаболической визуализации пресинаптических окончаний допаминергических нейронов в полосатом теле (стриатуме). F-Dopa (схожая по строению с L-Dopa) превращается в головном мозге в допамин, меченный 18-F, и накапливается в окончаниях допаминергических нервов в полосатом теле. При болезни Паркинсона, в связи с уменьшением количества нервных клеток, способность к накоплению допамина в полосатом теле может нарушаться.
На основании результатов ряда исследований, было установлено, что процентный показатель чувствительности и специфичности данного вида исследования, по сравнению с клинической диагностикой, составляет 100% и 95.4% соответственно.
При сравнении ПЭТ-КТ с 18-F-Dopa с FP-CIT DatScan, было обнаружено, что на ранних стадиях заболевания чувствительность и специфичность накопления FP-CIT и 18-F-Dopa в скорлупе чечевицеобразного ядра и полосатом теле с противоположной стороны составляли 100%. Что касается способности накопления в скорлупе чечевицеобразного ядра, специфичность и чувствительность при обоих исследованиях составляли более 90%.
Нас часто спрашивают, сколько стоит в Израиле лечение болезни Паркинсона. Точная сумма складывается из многих факторов, поэтому мы рекомендуем обратиться за получением подробной информации к нашим профессиональным консультантам.
Медицинский центр ArMedical поможет в организации процедуры ПЭТ-КТ с 18-F-Dopa в отделении изотопной диагностики медицинского центра Ихилов (Сораски). Помните, что вовремя поставленный точный диагноз определяет дальнейший ход лечения и выздоровления пациента. Будьте здоровы!
а) Терминология:
1. Сокращения:
• Идиопатическая болезнь Паркинсона (БП), дрожательный паралич
б) Визуализация болезни Паркинсона:
1. Общие характеристики:
• Лучший диагностический критерий:
о Истончение компактной части черной субстанции
• Локализация:
о Черная субстанция (ЧС), хвостатое ядро и скорлупа
• Размеры:
о Уменьшение (атрофия)
2. КТ признаки болезни Паркинсона:
• Бесконтрастная КТ:
о Неспецифическая атрофия больших полушарий
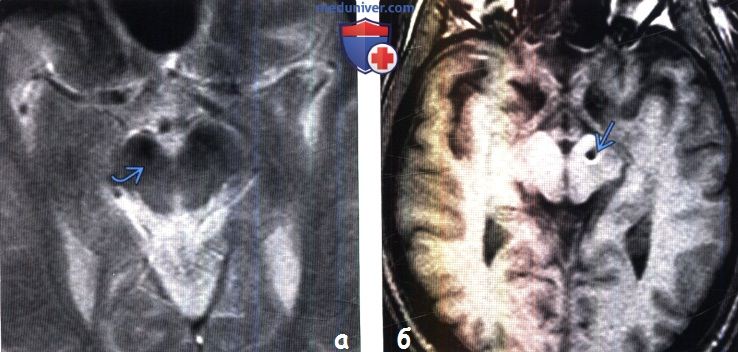
(а) MPT, T2*GRE, аксиальный срез: у пациента 61 года с болезнью Паркинсона определяется сужение компактной части черной субстанции, особенно справа, с утратой четкой дифференцировки между черной субстанцией и красным ядром.
(б) MPT, Т1 -ВИ, аксиальный срез: у пациента с болезнью Паркинсона визуализируется электрод глубокого стимулятора головного мозга. Правильное расположение электрода в субталамическом ядре: кончик электрода располагается на расстоянии 9 мм от срединной линии и находится непосредственно в структуре верхней границы ножек мозга.
5. Радионуклидная диагностика болезни Паркинсона:
• ПЭТ:
о Может использоваться для изучения функционального статуса допаминергических нейронов в ЧС, допаминовых Э2-рецепторов в базальных ганглиях или опиоидных рецепторов в базальных ганглиях
о Допаминергические нейроны в ЧС:
- ПЭТ с 18F-флюородопой: ↓ поглощения в полосатых телах пропорционально уменьшению количества допаминергических нейронов; коррелирует с тяжестью клинического течения заболевания:
Более выраженное уменьшение в скорлупе, чем в хвостатом ядре
Позволяет диагностировать раннюю/относительно бессимптомную стадию БП
о Допаминовые D2-рецепторы в базальных ганглиях
- ПЭТ с 11С-раклопрайдом; на ранних стадиях БП количество допаминергических терминалей скорлупы нормальное или повышенное, но нормализуется при прогрессировании БП, уменьшается при MCA
о Опиоидные рецепторы в базальных ганглиях:
- 11С-дипренорфин; уменьшение поглощения в скорлупе, таламусе и передних отделах поясной извилины у пациентов с дискинезиями при БП; нормальное поглощение у пациентов с БП без дискинезии
• ОФЭКТ: изменения аналогичны таковым при ПЭТ; может быть использована для изучения допаминергических нейронов ЧС или допаминовых D2-рецепторов в базальных ганглиях:
о Допаминергические нейроны черной субстанции:
- Изменения со стороны скорлупы по данным ОФЭКТ с I-123-ФП-КИФ сходны с таковыми по данным ПЭТ с 18F-флюородопой
о Допаминергические D2-рецепторы в базальных ганглиях:
- Изменения поданным ОФЭКТ с И 23-ФП-КИФ сходны с таковыми по данным ПЭТ с 11С-раклопрайдом
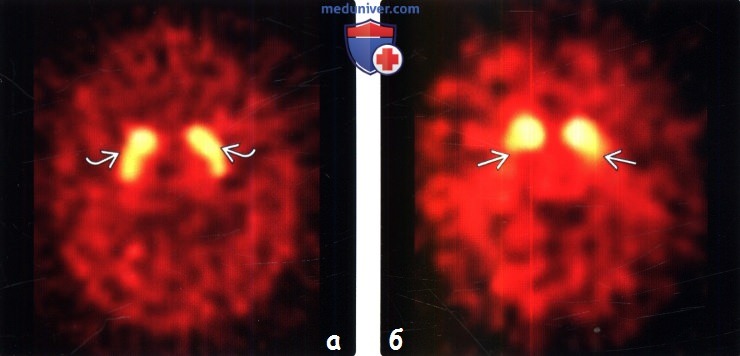
(а) ОФЭКТ с 123-ФП-КИФ с допаминовым транспортером (ДТ), аксиальный срез: наблюдается нормальное симметричное поглощение радиофармпрепарата в хвостатых ядрах и скорлупе билатерально с очень низко-интенсивной, практически незаметной, фоновой активностью.
(б) ДТ-ОФЭКТ с 123-ФП-КИФ, аксиальный срез: у пациента с идиопатической болезнью Паркинсона определяется асимметричное уменьшение накопления в скорлупе, больше справа. Обратите внимание на нормальное поглощение радиофармпрепарата в хвостатых ядрах.
в) Дифференциальная диагностика болезни Паркинсона:
3. Кортикобазальная дегенерация:
• Истончение пред-/постцентральных извилин с расширением центральной борозды с заметным преобладанием изменений в парасагиттальных отделах
4. Деменция с тельцами Леви:
• Тельца Леви диффузно расположенные в веществе головного мозга
• Атрофия ствола мозга, ЧС и коры
г) Патология:
1. Общие характеристики болезни Паркинсона:
• Этиология:
о Изучаются различные генетические маркеры, которые увеличивают склонность к развитию БП
о Воздействие факторов окружающей среды: МФТИ (1-метил-4-фенил-1,2,3,6-тетрагидропиридин); вероятно, воздействие пестицидов
о Старение: процесс нормального старения связан с уменьшением количества нейронов в ЧСкч
• Генетика:
о Спорадический характер (в 3-5% случаев-семейный характер)
• Ассоциированные патологии:
о Увеличение содержания железа в ЧСкч
2. Макроскопические и хирургические особенности:
• Потеря пигментации ЧС и голубого пятна
3. Микроскопия:
• Потеря допаминергических нейронов в ЧС (особенно ЧСкс), голубом пятне, дорсальном ядре блуждающего нерва и безымянном веществе
• Патология Леви: дезорганизованные α-синуклеиновые конгломераты, которые формируют цитоплазматические включения внутри тел (тельца Леви) и отростков нейронов (нейриты Леви)
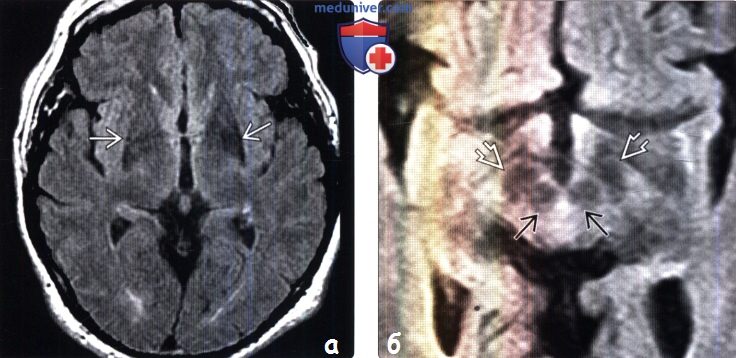
(а) MPT FLAIR, аксиальный срез: у пациента с болезнью Паркинсона отмечается патологическое уменьшение интенсивности сигнала от задних отделов базальных ганглиев, а также легкое уменьшение объема скорлупы билатерально.
(б) MPT FLAIR, аксиальный срез: у того же пациента: красное ядро и сетчатая часть практически соприкасаются друге другом, что говорит об истончении компактной части.
д) Клиническая картина:
2. Демография:
• Возраст:
о Характерно начало заболевания между 50-60 годами
• Пол:
о М:Ж= 1,5:1
• Эпидемиология:
о Идиопатическая БП является наиболее частым двигательным расстройством
о БП является вторым по частоте встречаемости нейродегенеративным расстройством после болезни Альцгеймера
о Частота встречаемости: 1 % среди населения старше 50 лет
3. Течение и прогноз:
• Начальные проявления БП обычно асимметричны
• Медленное прогрессирование брадикинезии, мышечной ригидности и нарушений походки → в конечном итоге, инвалидность через несколько лет
4. Лечение болезни Паркинсона:
• Медикаментозное (преимущественно для молодых пациентов): леводопа, бромокриптин, амантадин, селегилин
• Хирургическое (рефрактерные к медикаментозному лечению случаи): стереотаксическая паллидотомия или глубокая стимуляция субталамического ядра, таламуса, бледного шара
ж) Список литературы:
1. Booth ТС et al: The role of functional dopamine-transporter SPECT imaging in parkinsonian syndromes, part 2. AJNR Am J Neuroradiol. 36(2):236—44, 2015
2. Goveas J et al: Diffusion-MRI in neurodegenerative disorders. Magn Reson Imaging. ePub, 2015
3. Kalia LV et al: Parkinson's disease. Lancet. ePub, 2015
4. Broski SM et al: Structural and functional imaging in parkinsonian syndromes. Radiographics. 34(5): 1273-92, 2014
5. Cosottini M et al: MR imaging of the substantia nigra at 7T enables diagnosis of Parkinson disease. Radiology. 271 (3):831 —8, 2014
6. Brooks DJ et al: Imaging biomarkers in Parkinson's disease. Prog Neurobiol. 95(4):614-28, 2011
Редактор: Искандер Милевски. Дата публикации: 4.5.2019
(495) - 506 61 01
Лечение в Германии ¦ Болезнь Паркинсона – диагностика болезни Паркинсона в Германии
По данным ВОЗ около 4,1 млн. человек в мире страдают болезнью Паркинсона, из них примерно 200-300 тыс. проживает в России, а 250-280 тыс. человек в Германии. Замечено, что мужчины болеют немного чаще, чем женщины. Негативной тенденцией последних лет стало распространение заболевания в возрастной группе от 30-40 лет. Причины возникновения заболевания до конца не выяснены. Факторами риска считаются: генетическая предрасположенность, старение, хроническая цереброваскулярная недостаточность, лекарственная терапия с применением препаратов-нейролептиков, негативное воздействие окружающей среды.
Как и при любом другом заболевании, эффективность лечения болезни Паркинсона зависит от срока ее выявления, постановки диагноза и правильно назначенного курса лечения. Многие ведущие клиники и медицинские центры Германии проводят научные исследования с целью качественного улучшения методов диагностики и лечения этого заболевания. Для выработки новых решений и улучшенных методов в лечения болезни Паркинсона в Германии (г. Вюрцбург) с 12 по 15 марта 2013 года проходил 8-й национальный конгресс по болезни Паркинсона, в котором приняли участие более 500 экспертов неврологов, нейрохирургов и нейрофизиологов. Последние исследования открыли 5 новых генов, принимающих участие в развитии этой болезни. Выявлено, что именно сочетание этих нескольких генетических факторов играют важную роль в патогенезе заболевания. Благодаря высокому уровню медицинского обслуживания и новейшим достижениям в области медицины лечение болезни Паркинсона в Германии позволяет быстро и точно поставить возможный диагноз, определить общие показания для конкретного медицинского и хирургического лечения, провести оптимизацию потенциала существующих (в том числе новейших) методов лечения, избежать необходимости повторной диагностики, предоставить при необходимости возможность госпитализации с целью эффективного проведения лечебных и диагностических мероприятий.
Поскольку заболевание Паркинсона считается до конца неизлечимым, то здесь особенно важно проведение качественной ранней диагностики, так как при своевременном обнаружении заболевания часто легче предупредить его развитие и свести к минимуму его прогрессирование. Поэтому лечение болезни Паркинсона в Германии предполагает в первую очередь проведения различных диагностических программ, проводимых в диагностическо-исследовательских медицинских центрах Германии и специализированных клиниках, оснащённых самым современным оборудованием и новейшими методами диагностики. При обследовании всегда учитываются индивидуальные факторы риска и даются нужные рекомендации на будущее, которые помогут избежать других серьезных заболеваний. Если в ходе исследования выявляются факты, которые свидетельствуют о болезни Паркинсона, пациенту предлагается дальнейшее, более подробное, обследование или лечение.
Методы диагностики болезни Паркинсона при лечении в Германии:
Позитронно-эмиссионная томография мозга (ПЭТ) может использоваться для диагностирования болезни Паркинсона для оценки деятельности и функции головного мозга, принимающих участие в движении. Данный метод функциональной нейровизуализации позволяет выявить критерий заболевания болезни Паркинсона, а именно нехватку нервных клеток, продуцирующих дофамин. Благодаря ПЭТ можно регистрировать пресинаптические дофаминергические терминали, количество которых при болезни Паркинсона прогрессирующе уменьшается. Для этого перед процедурой исследования внутривенно вводится небольшого количества радиоактивного материала (индикатора). В ходе исследования ПЭТ-сканер регистрирует взаимодействие положительно заряженных частиц (позитронов) с отрицательно заряженными частицами (электронами) в вашем теле и выводит изображение определенных участков мозга для дальнейшего выявления потенциальных проблем. Исследование обычно длится 45-60 минут. После исследования пациенту требуется пить большое количество жидкости для выведения индикатора из организма. Поскольку при ПЭТ используются радиоактивные материалы, несмотря на низкий уровень их радиации, существует небольшой риск повреждения клеток и тканей организма. Результаты исследования могут быть готовы в течение 1-2 дней. По причине высокой стоимости не все клиники Германии используют метод ПЭТ для диагностики болезни Паркинсона.
Однофотонная эмиссионная компьютерная томография (ОФЭКТ) получила более широкое распространение для дополнительного подтверждениями диагноза болезни Паркинсона, чем ПЭТ. Благодаря точности в диагностике она также как и ПЭТ позволяет исключить прочие неврологические заболевания, которые способны вызвать симптомы, аналогичные тем, которые проявляются при болезни Паркинсона. ОФЭКТ может проводиться по методике IBZM SPECT или DaTSCAN. Считается, что по технологии DaTSCAN в 97% случаев можно провести различие между болезнью Паркинсона и тремором. Путем определения количества переносчика дофамина в синоптической щели процедура ОФЭКТ позволяет установить снижение активности выработки дофамина, как главного и определяющего критерия болезни Паркинсона. ОФЭКТ также как и ПЭТ является одним из видов ядерной медицинской томографии. Обычно перед проведением ОФЭКТ (за 3-4 часа до процедуры диагностики) пациенту внутривенно вводят радиофармпрепарат, необходимый для исследования соответствующего органа. В ОФЭКТ применяются меченные радиоизотопами радиофармпрепараты, ядра которых при радиоактивном распаде испускают лишь один фотон, в отличие от ПЭТ, где при диагностике используются радиоизотопы, которые испускают позитроны. В результате регистрации этого явления в специальных камерах создается трехмерное изображение, которые подробно показывает соответствующего органа пациента. Процедура ОФЭКТ длится от 30 до 90 минут.
Магнитно-резонансная томография (МРТ) - еще один способ визуализации работы головного мозга для установления диагноза болезни Паркинсона, широко применяемый в Германии. При МРТ для диагностики не используются рентгеновских лучи, а исследование проводится на основе генерации сильных магнитных полей, использования радиоволн и компьютерного моделирования. В результате получаются очень четкие слоистые изображения, превосходящие по точности изображения компьютерной томографии. Благодаря повышенной точности можно определить даже самые маленькие изменения в структуре головного мозга, что дает дополнительные преимущества для исключения других видов заболеваний. МРТ абсолютно безопасный и безвредный способ диагностики, но имеет ряд противопоказаний (наличие кардиостимулятора, протезов, металлических зажимов, металлических имплантатов и других медицинских электронных и металлических приборов, тяжелое заболевание легких). Некоторые МРТ исследования также требуют введения контрастного вещества. Это помогает выявить определенные анатомические структуры на сканированных изображениях. В большинстве случаев, эта процедура занимает от 45 до 60 минут, в течение которых могут быть получены несколько десятков необходимых для диагностики изображений.
Транскраниальная сонография (TКС, Doppler - сонография) – новый высокоинформативный метод преклинической и дифференциальной диагностики болезни Паркинсона, основанный на ультразвуковой регистрации гиперэхогенного сигнала, получаемого от черной субстанции, по причине повышенного в ней содержания железа. На начальных стадиях болезни Паркинсона у 90% больных гиперэхогенность обнаруживается на противоположной стороне двигательным нарушениям. Примерно у 40% родных пациентов с первой степенью болезни Паркинсона выявляется изменение при проведении ТКС. Однако статистика показывает, что у 9% клинически здоровых обследуемых может быть обнаружена гиперэхогенность черной субстанции. Большим преимуществом этого метода является его низкая стоимость, непродолжительное время проведения процедуры диагностики, неинвазивность, возможность многократно повторять диагностику в динамике.
Электроэнцефалограмма (ЭЭГ) – неинвазивный способ диагностики, путем регистрирования биоэлектрической активности, функционального состояния головного мозга. На электроэнцефалографии у людей с болезнью Паркинсона отмечается уменьшение a-активности и повышение мощности q- и d- медленных ритмов в двух полушариях мозга. Уже на ранних стадиях заболевания наблюдается уменьшение электрической активности головного мозга.
Электронейромиография и электромиография (ЭНМГ и ЭМГ). Электронейромиография представляет собой комплекс способов диагностики функционального состояния нервно-мышечной системы, который основан на выявлении биоэлектрической активности мышц, а также периферических нервов и их анализе. Этот метод редко используется для диагностики при лечении болезни Паркинсона в Германии. Диагностика ЭНМГ совершается с использованием компьютерного электронейромиографа. Она содержит стимуляционную, поверхностную и игольчатую электронейромиографию. Процедура проводится путем наложения на мышцу отводящих электродов и последующей стимуляцией нерва с мест, где нерв ближе всего подходит к телесной поверхности. При болезни Паркинсона наблюдается увеличение амплитуды М-ответа в мышцах стоп (на стороне где отмечались начальные двигательные нарушения) и кистей, а также фиксируется снижение скорости проведения импульса.
Электромиография – способ регистрации электрической мышечной активности, диагностическое исследование биоэлектрических потенциалов, которые возникают при возбуждении мышечных волокон в скелетных мышцах человека. Процедура диагностики проводится с помощью электромиографа. Результаты диагностики фиксируются на фотопленке в виде кривой исследования, на магнитных носителях или с помощью чернильно-пишущего осцилографа на бумаге. Проведение электромиографической диагностики с использованием накожных электродов дает возможность выявить ряд изменений на электромиографии у лиц с болезнью Паркинсона. Так, например, у обследуемых с дрожательной формой болезни фиксируется залповая активность с частотой от 4 до 8 раз в секунду с высоковольтными колебаниями биопотенциала мышц в состоянии покоя. Это отображает ритм тремора. По мере повышения мышечного тонуса на поздних стадиях болезни наблюдается подавление залповой активности. Изменения на ЭМГ могут обнаруживаться на ранних и субклинических стадиях болезни Паркинсона, что может облегчить раннюю диагностику заболевания.
Л-ДОФА тестирование. Этот метод диагностики при лечении болезни Паркинсона в Германии называется еще тест на леводопы. Как известно, болезнь Паркинсона является результатом дефицита дофамина в головном мозге. Леводопа (L-допа) является предшественником дофамина. Логично, что при восполнении недостатка дофамина симптомы болезни Паркинсона должны исчезнуть. Однако дофамин сам по себе не всасывается в мозг. Поэтому его вводят в виде связанного вещества (леводопы), которое попадает к нервным клеткам и превращается в аминокислоту медиатор дофамин. После приема леводопа наблюдается улучшение симптомов заболевания, что может означать наличие у пациента болезни Паркинсона. К сожалению, полностью подтвердить с помощью этого теста диагноз невозможно, но он широко применяется как дополнительный метод подтверждения болезни Паркинсона в Германии.
(495) 506-61-01 - срочная организация лечения в Германии
О.С. Левин 1,2 , А.В. Росинская 3
1 Российская медицинская академия последипломного образования;
2 Центр экстрапирамидных заболеваний (Москва);
3 Кабинет экстрапирамидных расстройств Приморской краевой клинической больницы №1 (Владивосток)
Болезнь Паркинсона (БП) – прогрессирующее нейродегенеративное заболевание, характеризующееся сочетанием гипокинезии с мышечной ригидностью и/или тремором покоя, а также с позднее развивающейся постуральной неустойчивостью и широким спектром немоторных нарушений, включая вегетативные, психические, диссомнические и сенсорные симптомы. В качестве основного звена патогенеза БП рассматривается формирование нейротоксических агрегатов небольшого пресинаптического белка альфа-синуклеина (основного компонента телец Леви) сопровождающееся гибелью пигментированных нейронов вентролатеральных отделов компактной части черной субстанции. Однако в последние годы установлено, что с поражением черной субстанции коррелируют лишь основные двигательные симптомы паркинсонизма, в то же время дегенеративный процесс при БП вовлекает и другие группы нейронов в различных зонах головного мозга, а также и в периферической нервной системе, что лежит в основе многочисленных немоторных проявлений болезни [1, 3].
Эпидемиология
По данным сплошного популяционного исследования, распространенность БП в России составляет 139 случаев на 100 000 населения, заболеваемость БП – 16 случаев на 100 000 населения в год. С увеличением возраста риск БП увеличивается, и выявляемость БП среди лиц старше 65 лет составляет уже около 1%. Большинство случаев заболевания возникают в возрасте 60–70 лет. Однако в 15% случаев БП дебютирует в возрасте до 45 лет.
Исходя из имеющихся данных и половозрастной структуры населения России, можно примерно оценить общую численность больных с БП в нашей стране в 210 тысяч, при этом ежегодно заболевание возникает примерно у 20 тысяч пациентов. Ориентировочные расчеты показывают, что, как минимум, четверть пациентов (то есть более 50 тысяч) оказываются вне сферы медицинской помощи, причем в большинстве своем это пациенты с ранней стадией заболевания [3].
Диагностика
Диагноз БП проводится в 2 этапа. На первом (синдромальном) этапе синдром паркинсонизма требуется отличить от других состояний, имитирующих его (таблица 1).
Таблица 1. Состояния, требующие дифференциальной диагностики с паркинсонизмом.
Начальным проявлением БП, особенно у лиц молодого возраста, может быть дистония стопы, появляющаяся или усиливающаяся при ходьбе, значительно реже – дистония иной локализации.
Дебютными проявлениями БП бывают также хронические болевые синдромы, чаще всего в спине и плечелопаточной области, связанные с повышенным мышечным тонусом, ограничением мобильности и постуральными нарушениями.
При неврологическом осмотре могут выявляться симптомы, атипичные для БП, требующие исключения иных заболеваний, вызывающих синдром паркинсонизма. Среди них можно выделить: симметричность, быстрое прогрессирование симптоматики с ранней утратой способности к передвижению в течние 5 лет, раннее развитие постуральной неустойчивости с падениями, отсутствие стойкого положительного эффекта адекватных доз препаратов леводопы, раннее развитие вегетативной недостаточности, быстрое присоединение деменции (в течении 1-го года), ограничение подвижности глазных яблок (особенно парез взора вниз), раннее развитие тяжелых псевдобульбарных синдромов, аксиальная дистония, пирамидные и мозжечковые знаки, наличие очаговых нарушений корковых функций.
Дополнительные методы исследования
В настоящий момент нет методов лабораторного или инструментального исследования, которые были бы обязательны у каждого пациента с подозрением на БП. В последние годы больным с БП часто проводят КТ или МРТ головного мозга, однако чаще всего в этом нет необходимости, и в большинстве случаев диагноз может быть установлен на основе клинических данных. Тем не менее, если клиническая картина у больного с синдромом паркинсонизма отклоняется от классического варианта, свойственного БП, в частности, отсутствует типичная реакция на дофаминергические средства, – необходимо проведение нейровизуализации.
При начале заболевания до 50 лет важно исключить гепатолентикулярную дегенерацию, о которой могут свидетельствовать роговичное кольцо Кайзера–Флейшера, низкий уровень церулоплазмина, повышение интенсивности сигнала от базальных ганглиев и мозжечка на Т2-взвешенных МРТ изображениях, повышенная экскреция меди с мочой.
Диагностическую значимость может иметь и транскраниальная сонография глубинных структур мозга, выявляющее при БП гиперэхогенные изменения в проекции черной субстанции, связанные с накоплением железа и установленные в 92% случаев клинически вероятной БП, однако его результаты можно интерпретировать лишь в клиническом контексте.
Общие принципы начала лечения
Поскольку на данный момент способность замедлять процесс дегенерации за счет нейропротективного эффекта (возможность защищать интактные клетки от повреждения) или нейрорепаративного эффекта (возможность восстанавливать активность частично поврежденных клеток) ни у одного из применяющихся средств убедительно не доказана, лечение основывается пока на симптоматическом действии. Тем не менее потенциальная возможность нейропротективного эффекта, подтверждаемая экспериментальными или клиническими данными, должна учитываться при назначении лечения.
В настоящее время широкое распространение получила концепция, подчеркивающая важность раннего назначения дофаминергической терапии – немедленно после установления диагноза – с тем, чтобы быстрее скорректировать нейрохимический дисбаланс в мозге и поддержать процессы компенсации.
Если ранее подчеркивалась необходимость возможно более длительного сохранения монотерапии, то в настоящее время преимущества такого подхода не представляются очевидными – по сравнению с ранним переходом к комбинации средств с разным механизмом действия. Вопрос о необходимости монотерапии или комбинированной терапии должен решаться индивидуально. В любом случае при выборе препаратов и их дозы следует стремиться не к полному устранению симптомов, а к существенному улучшению функций, позволяющему поддерживать бытовую и профессиональную активность. В то же время следует избегать внесения в схему лечения сразу нескольких изменений (например, повышения дозы сразу нескольких средств или добавления сразу нескольких препаратов), это позволяет оценить отдельно эффективность и безопасность каждого из назначаемых средств.
Принципы выбора противопаркинсонического препарата
Выбор препарата на начальном этапе лечения проводят с учетом возраста, выраженности двигательного дефекта, трудового статуса, состояния нейропсихологических функций, наличия сопутствующих соматических заболеваний, индивидуальной чувствительности пациента. Помимо достижения оптимального симптоматического контроля, выбор препарата определяется необходимостью отсрочить момент развития моторных флуктуаций и дискинезий (таблица 2).
Таблица 2. Выбор препарата для начального лечения болезни Паркинсона.
| Препараты | Возможность использования в качестве средства первого выбора | Степень симптоматического улучшения | Нейро-протективный потенциал | Риск побочного действия | |
| Флуктуации и дискинезии | Другие побочные эффекты | ||||
| Леводопа | + | +++ | +? | ↑ | ↑ |
| Агонисты дофаминовых рецепторов | + | ++ | +? | ↓ | ↑ |
| Ингибитор МАО В | + | + | +? | ↓ | ↑ |
| Амантадин | + | + | +? | ↓ | ↑ |
| Холинолитики | — | + | — | ? | ↑ |
У лиц моложе 50 лет при легкой или умеренной выраженности двигательных нарушений в отсутствие выраженных когнитивных нарушений назначают один из следующих препаратов: агонист дофаминовых рецепторов, ингибитор моноаминооксидазы типа В, амантадин. При более легком двигательном дефекте может быть назначен ингибитор МАО В, при более выраженном дефекте предпочтительнее начинать с лечения с одного из агонистов дофаминовых рецепторов. Неэрголиновые агонисты (например, прамипексол, ропинирол, ротиготин или проноран) ввиду более благоприятного профиля побочных эффектов предпочтительнее, чем эрголиновые (бромокриптин, каберголин). При недостаточной эффективности или плохой переносимости одного из агонистов дофаминовых рецепторов может быть испробован другой агонист дофаминовых рецепторов или препарат другой фармакологической группы. Рациональна комбинация агониста дофаминовых рецепторов, ингибитора МАО типа В и амантадина, к которой следует переходить постепенно, добавляя препарат новой группы, если ранее назначенное средство не обеспечило ожидаемого эффекта.
Антихолинергические средства (например, бипериден) показаны при наличии выраженного тремора покоя либо болезненной дистонии при условии сохранности нейропсихологических функций. Их целесообразно добавлять к комбинации агониста дофаминовых рецепторов с ингибитором МАО В и/или амантадином, если она у пациента относительно молодого возраста не обеспечила подавления тремора в той степени, в которой это необходимо для поддержания его трудоспособности.
Если указанные препараты в максимально переносимых дозах и их комбинация не обеспечивают адекватного состояния двигательных функций и социальной адаптации больных, назначают препарат леводопы в минимальной эффективной дозе [4].
У лиц в возрасте 50–70 лет при умеренном двигательном дефекте и относительной сохранности когнитивных функций лечение начинают с ингибитора МАО типа В (при легких симптомах паркинсонизма) или одного из агонистов дофаминовых рецепторов. В дальнейшем целесообразен постепенный переход к комбинации агониста дофаминовых рецепторов, ингибитора МАО типа В и амантадина (при условии хорошей переносимости). Больным после 60 лет антихолинергические средства, как правило, не следует назначать из-за риска ухудшения познавательных функций и других побочных эффектов. При недостаточной эффективности комбинации указанных выше препаратов добавляют препарат леводопы в минимальной эффективной дозе (200–400 мг в сутки).
У лиц в возрасте 50–70 лет при выраженном двигательном дефекте, ограничивающем трудоспособность и(или) возможность самообслуживания, а также при наличии выраженных когнитивных нарушений и необходимости получения быстрого эффекта лечение начинают с препаратов, содержащих леводопу. Если небольшие или средние дозы леводопы (300–500 мг леводопы в сутки) не обеспечивают необходимого улучшения, к ним последовательно могут быть добавлены агонист дофаминовых рецепторов, амантадин и ингибитор МАО В.
У пожилых лиц (старше 70 лет), особенно при наличии выраженного когнитивного снижения и соматической отягощенности, лечение следует начинать с препаратов леводопы. Указанные возрастные границы относительны, и общий принцип скорее заключается в том, что чем моложе больной, тем позже следует вводить препараты леводопы. Кроме того, решающее значение играет не столько хронологический, сколько биологический возраст больных.
Применение препарата прамипексола с длительным высвобождением на ранней стадии БП
Разработка новых лекарственных форм противопаркинсонических препаратов, обеспечивающих их длительное высвобождение и допускающих однократный прием в течение дня, не просто делает лечение более удобным, но и, улучшая приверженность пациентов лечению, повышает долгосрочную эффективность терапии. Кроме того, при медленном высвобождении препарата в течение суток достигается более стабильная его концентрация в крови, что может обеспечить его лучшую переносимость и эффективный контроль симптомов заболевания в течение всего дня (как в дневное, так и в ночное время).
Новая лекарственная форма прамипексола с длительным (контролируемым) высвобождением, предполагающая однократный прием в течение дня, применяется в европейских странах и США с 2009 года, а в нашей стране – с 2012 года. Она представляет собой матриксную таблетку, в которой активное вещество равномерно распределено в полимерном матриксе. В желудочно-кишечном тракте матрикс впитывает жидкость и превращается в гель, который равномерно высвобождает прамипексол в течение 24 ч. Поскольку прамипексол хорошо растворяется в жидкой среде, независимо от ее pH, активное вещество высвобождается из матрикса и всасывается на протяжении всего кишечника. Скорость опорожнения желудка и моторика кишечника не оказывают существенного влияния на действие препарата. Параметры всасывания не зависят также от того, принимается препарат натощак или после еды [2].
При разработке новой лекарственной формы была учтена возможность простого, одномоментного перехода от традиционной формы препарата к новой. Условием этого является то, что равные суточные дозы препарата с немедленным высвобождением (принимаемым 3 раза в день) и длительным высвобождение (принимаемым 1 раз в день) оказывают одинаковое противопаркинсоническое действие. Различие между новой и традиционной лекарственными формами прамипексола заключается лишь в скорости высвобождения активного вещества. Период полужизни прамипексола при применении обеих форм один и тот же, но благодаря контролируемому высвобождению обеспечивается более длительное поддержание терапевтической концентрации препарата в крови [5].
Эквивалентность действия равных суточных доз препаратов прамипексола с немедленным и длительным высвобождением была подтверждена в целом ряде клинических испытаний.
Следует подчеркнуть особое удобство новой лекарственной формы прамипексола, которую достаточно принимать один раз в день, для пациентов с ранней стадией БП, продолжающих работать. Во избежание побочного действия препарат назначается путем медленного титрования – по той же схеме, что и препарат с немедленным высвобождением. Для этого таблетки прамипексола с длительным высвобождением выпускаются в нескольких дозировках: 0,375, 0,75, 1,5, 3 и 4,5 мг. Лечение начинают с дозы 0,375 мг 1 раз в день, далее при условии хорошей переносимости каждые 7 дней переходят на следующий уровень дозы до достижения оптимального эффекта, максимально до 4,5 мг/сут (таблица 3). После достижения дозы 1,5 мг/сут титрование иногда целесообразно проводить медленнее, так как развитие полного лечебного эффекта может требовать нескольких недель. Рекомендуемая доза для поддерживающей терапии (как на ранней, так и на развернутой или поздней стадиях заболевания) может колебаться от 0,375 до 4,5 мг/сут. Наиболее часто применяемая доза – 3 мг/сут.
Таблица 3. Схема титрования прамипексола с длительным высвобождением.
| Неделя | Доза |
| 1-я | 0,375 мг 1 раз в день |
| 2-я | 0,75 мг 1 раз в день |
| 3-я | 1,5 мг 1 раз в день |
| 4-я | 2,25 мг 1 раз в день |
| 5-я | 3 мг 1 раз в день |
| 6-я | 3,75 мг 1 раз в день |
| 7-я | 4,5 мг 1 раз в день |
Лекарственные средства, эффективность которых при БП не доказана
В клинической практике широко применяют лекарственные средства, эффективность которых при БП не доказана и которые, следовательно, не могут быть рекомендованы к применению при этом заболевании. Прежде всего, к ним относятся так называемые ноотропные, нейрометаболические и вазоактивные препараты. Возможно, некоторые из этих средств оказывают определенное лечебное действие, но прежде, чем рекомендовать конкретный препарат, следует провести адекватную оценку его эффективности. Специалисты, занимающиеся лечением БП, прекрасно знают, что определенная часть больных хорошо реагирует на плацебо, причем этот эффект оказывается нестойким. Соответственно, затраты на подобное лечение оказываются бессмысленными.
Читайте также:


