Протокол лечения постгипоксической энцефалопатии
Согласно алгориму, разработанному Г.В.Алексеевой и соавторами [62, 63], в остром периоде постгипоксической энцефалопатии показана терапия, направленная на снижение энергетических потребностей мозга.
Недостаточная аналгоседация у этих пациентов приводит к повышению внутричерепного давления, дисциркуляторным изменениям, гипоксии, нарушению текучих свойств крови, жировой эмболии, ДВС-синдрому, отеку - набуханию мозга, истощению системы эндорфинов, диэнцефальным кризам [52].
Терапия первых 3 часов постгипоксического периода для всех больных, перенесших терминальное состояние, идентична (дозы и схема лечения приводятся для взрослого со средней массой тела 70-80 кг) и включает введение препаратов, снижающих энергетические потребности мозга: бензодиазепины или пропофол. Затем терапия проводится дифференцированно в зависимости от типа постгипоксической энцефалопатии.
Для пациентов с гиперреактивным типом постгипоксической энцефалопатии (катехоламиновые, адреналовые кризы, судороги, двигательное возбуждение) рекомендовано применять:
- при двигательном возбуждении: галоперидол – 2,5 - 5 мг в/в 1-2 раза в день под контролем артериального давления; в качестве гипнотика – пропофол.
Для пациентов с гипореактивным типом постгипоксической энцефалопатии рекомендовано применять:
Согласно американскому руководству по ведению пациентов с постгипоксической энцефалопатией вследствие травматического повреждения головного мозга рекомендовано назначение центральных агонистов альфа-2 рецепторов (дексмедетомидин) под контролем АД [64].
Всем пациентам в остром периоде постгипоксической энцефалопатии показана глубокая седация.
9. Ключевые рекомендации.
1. Первоочередной задачей интенсивной терапии в ОРИТ является адекватное обезболивание, которое всегда должно предшествовать любому виду седации (+1А).
2. Глубина седации и клинические исходы.
- Поддержание легкой степени седации у взрослых пациентов ОРИТ связано с лучшими клиническими исходами (меньшей длительностью ИВЛ и меньшим сроком пребывания в ОРИТ (В).
- Рекомендуется титровать седативные препараты для поддержания легкой, а не глубокой, степени седации у взрослых пациентов ОРИТ, если это не противопоказано клинически (+1В).
2. Контроль глубины седации и функции головного мозга
- Шкала возбуждения-седации Ричмонда (RASS) и шкала седации-возбуждения (SAS) – наиболее достоверные инструменты оценки седации у взрослых пациентов ОРИТ (В).
- Не рекомендуется использование объективных измерений функции мозга (например, слуховых вызванных потенциалов [AEPs], биспектрального индекса [BIS], индекса Narcotrend[NI], индекса состояния пациента(PSI), или состояния энтропии [SE]) в качестве основного метода контроля седации у тяжелобольных взрослых, не находящихся в коме и не парализованных, так как эти методы не могут считаться достаточной заменой субъективных систем оценки седации (-1B).
- При наличии возможности в условиях центра анестезиологии и реанимации или специализированных учреждений предлагается использовать объективные измерения функции мозга (AEPs, BIS, NI, PSI, или SE) в качестве дополнения к субъективной оценке седации у взрослых пациентов ОРИТ, получающих блокаторы нервно-мышечного соединения, так как субъективная оценка седации может оказаться невозможной у этих пациентов (+2В).
- При наличии возможности в условиях центра анестезиологии и реанимации или специализированных учреждений рекомендуется использовать ЭЭГ как для мониторинга несудорожной патологической активности у пациентов ОРИТ с риском развития синкопальных состояний, так для титрования дозы антиконвульсантов для подавления патологической активности у пациентов ОРИТ с повышенным внутричерепным давлением (+1А).
3. Выбор седативных средств
Предпочтительно использование стратегий седации с применением небензодиазепиновых средств (пропофола или дексмедетомидина) вместо бензодиазепинов (мидазолама, диазепама) для улучшения клинических результатов у взрослых пациентов ОРИТ, находящихся на ИВЛ (+2B).
В качестве альтернативного метода седации у пациентов на ИВЛ рекомендованы ингаляционные анестетики (изофлуран и севофлуран).
4. Стратегии седации и профилактики делирия для улучшения исходов у пациентов ОРИТ:
- Рекомендовано либо прерывать седацию ежедневно, либо использовать легкую седацию для взрослых пациентов ОРИТ, находящихся на ИВЛ (+1В).
- Рекомендовано сначала проводить анальгезию, а затем седацию (+2В).
- Рекомендовано обеспечивать сон у взрослых пациентов ОРИТ путем оптимизации условий пребывания, использования стратегий контроля освещения и шума, проведения лечебных мероприятий в одно время и уменьшения шумовых раздражителей в ночное время (+1С).
- Рекомендуется создавать протоколы для обеспечения эффективного применения рекомендаций по проведению седации у взрослых пациентов ОРИТ (+1В).
5. При лечении постгипоксического состояния в остром периоде показана терапия, направленная на снижение энергетических потребностей головного мозга. Рекомендовано назначение дексмедетомидина, пропофола, бензодиазепинов (мидазолам, диазепам). Показана глубокая седация без периодов пробного пробужденияв течение 7 – 8 суток (+1С).
Соблюдение основных принципов проведения седации в ОРИТ, в первую очередь, обеспечения адекватной аналгезии, а также разработка надежных алгоритмов и шкал оценки седации непосредственно у постели больного позволяют улучшить качество лечения пациентов. Современные методы оценки психоэмоционального статуса пациентов в ОРИТ дают возможность контролировать исходы, связанные с нефармакологическими и фармакологическими методами аналгоседации, осуществлять мониторинг и управление уровнем седации. У большинства пациентов ОРИТ обеспечение легкой степени седации связано с лучшими клиническими исходами.
Список литературы.
1. Fraser GL, Prato BS, Riker RR, Berthiaume D, Wilkins ML Evaluation of agitation in ICU patients: Incidence, severity, and treatment in the young versus the elderly. Pharmacotherapy, 2000, 20:75-82
2. Belda F.J.,Soro M., Meiser A. Sedation with Inhaled agents. Intensive Care Medicine. (Annual Update 2008).
3. Jones C, Griffiths R.D., Humphris G., Skirrow P.M. (2001). Memory, delusions, and the development of acute post-traumatic stress disorder-related symptoms after intensive care. Crit. Care Med 29:573-80
4. Scragg P., Jones A, Fauvel N. (2001) Psychological problems following ICU treatment. Anaesthesia 56: 9-14
5. Textbook of critical care. - 6 th ed. [edited by jean-Louis Vincent et al.].– 1698 p.
6. Barr J., Fraser G.L., Puntillo K. et al. Clinical practice guidelines for the management of pain, agitation and delirium in adult patients in intensive care unit //Critical Care, 2013. – Vol.41, №, 1, p. 263 - 306.
7. Ann. Fr. Anesth. Réanim. 2000; 19: 98-105 Recommandations SFAR-SRLF. 1999.
8. Holzman R.S. Kullen D.J., Eichham J.H., Phillip J.H. Guidilines for sedation for non-anesthesiologists during diagnostic and therapeutic procedures. The Risk management Committee of the department of Anaesthesia of Harvard Medical School //J. Clin. Anesth. 1994. Vol.6 (4). P.265 – 276.
9. Козлов И.А. Современные подходы к седации в отделениях реанимации и интенсивной терапии //Медицинский алфавит. Неотложная медицина, 2013, №1, с. 22 – 31.
10. Cohen D., Horiuchi K., Kemper M., et al: Modulating effects of propofol on metabolic and cardiopulmonary responses to stressful intensive care unit procedures. CritCareMed1996; 24:612–617
11. The San Diego Patient Safety Council.ICU Sedation Guidelines of Care. 2009
12. Retrieved November, 2009 from wwwmemory disoder.org/glossary terms.htm
13. Jakob S.M., Ruokonen E., Grounds R.M.et al. Dexmedetomidin vs midozalam or propofol for sedation during prolonged mechanical ventilation. JAMA, 2012. – Vol. 307, №11. – P. 1151 – 1160.
14. Keating G.M., Sheritan M.H., Williamson K.A. Dexmedetomidin: a guide to its use for sedation in the US. Clin. Drug Investig. 2012; 32 (8): 561 – 567.
15. Brown E.N., Lydic R., Schiff N.D. General anaesthesia, sleep and coma //N.Engl.J.Med. 2010. Vol. 363 [27].P. 2638 – 2650.
16. Yuan X., Wu J., Wmoang Q., Xu M. The antinociceptive effect of systemic administration of a combination of low-dose tramadol and dexmedetomidine in a rat model of bone cancer pain. Eur. J. Anaesthesiol., 2014; 31: 30 – 34.
17. Brumett C.M., Hong E.K., Janda A.M. et al. Perineural dexmedetomidine added to roopivacaine for sciatic nerve block in rats prolongs the duration of analgesia by blocking the hyperpolarization-activated cation current. Anesthesiology, 2011; 115: 836 – 843.
18. Ugur F., Gilcu N., Boyaci A. Intrathecal infusion therapy with dexmedetomidine-supplemented morphine in cancer pain. Acta Anaeshesiol. Scand., 2007; 51: 388.
19. Dexdor: public assessment report. London: European Medicines Agency, 2011, Oct.4.
20. Hoy S.M., Keating J.M. Dexmedetomidine: a review of its use for sedation in mechanically ventilated patients in an intensive care setting and for procedural sedation. Drugs, 2011; 71 (11): 1481 – 1501.
21. Reede M.S., O’Sullivan K., Bates S. et al. Dexmedetomidin versus galoperidol in delirious, agitated, intubated patients: a randomized open-label trial //Crit. Care, 2009. Vol. 13(3). P. R75 – R84.
22. Никода В.Б., Бондаренко А.В., Дубов В.А., Алешин М.А., Маячкин Р.Б. Клиническое применение дексмедетомидина у больных после торакоабдоминальных хирургических вмешательств. Анестезиология и реаниматология, 2014, №5, с. 16 – 21.
23. Никода В.В., Грицан А.И., Еременко А.А., Заболотских И.Б., Киров М.Ю., Лебединский К.М., Левит А.Л. Эффективность и безопасность применения дексмедетомидина для седации больных при проведении продленной ИВЛ в отделениях реанимации и интенсивной терапии. Анестезиология и реаниматология, 2015, №5, с. 47 – 55.
24. Martin Jörg, Parsch Axel, Martin Franck et al. Practice of sedation and analgesia in German intensive care units: results of a national survey. Critical Care, 2005, vol.9, №2, R117 – 123.
25. Cormack J.R., Orme R.M., Costello T.G. The role of α2-agonists in neurosurgery. Journal of Clinical Science, 2005, vol. 12, issue 4, p. 375–378
26. Mirski M.A., Hemstreet M.K. Critical care sedation for neuroscience patients. Journal of the neurosurgical science, 2007, 261, p.16 – 34.
27. McKeage K., Perry C.M: Propofol: A review of its use in intensive care sedation of adults. CNS Drugs2003; 17:235–272
28. Carson S.S., Kress J.P., Rodgers J.E., et al: A randomized trial of intermittent lorazepam versus propofol with daily interruption in mechanically ventilated patients. Crit. Care Med2006; 34:1326–1332.
29. Barr J., Egan T.D., Sandoval N.F., et al: Propofol dosing regimens for ICU sedation based upon an integrated pharmacokinetic-pharmacodynamic model. Anesthesiology, 2001; 95:324–333
30. Riker R.R., Fraser G.L.: Adverse events associated with sedatives, analgesics, and other drugs that provide patient comfort in the intensive care unit. Pharmacotherapy, 2005; 25(5 Pt 2):8S–18S
31. Walder B., Tramèr M.R., Seeck M.: Seizure-like phenomena and propofol: A systematic review. Neurology, 2002; 58:1327–1332
32. Iyer V.N., Hoel R., Rabinstein A.A.: Propofol infusion syndrome in patients with refractory status epilepticus: An 11.-year clinical experience. Crit. Care Med, 2009; 37:3024–3030.
33. Parviainen I., Uusaro A., Kälviäinen R., et al: Propofol in the treatment of refractory status epilepticus. Intensive Care Med, 2006; 32:1075–1079
34. Voss L.J., Sleigh J.W., Barnard J.P., et al: The howling cortex: Seizures and general anesthetic drugs. Anesth. Analg., 2008; 107:1689–1703.
35. Fong J..J., Sylvia I., Barnard J.P. et al. Predictors of mortality in patients with suspected propofol infusion syndrome. Crit. Care Med. 2008; 36:2281 – 2287.
36. Didrich D.A., Brown D.R.: Analytic revewes: Propofol infusion syndrome in ICU. J. Intensive Care Med., 2011; 26: 59 - 72.
37. Merz T.M., Regli B., Roten H.U., et al. Propofol infusion syndrome: A fatal case at a low infusion rate. Anesth. Analg., 2006; 103: 1050.
38. Chukwuemeka A., Ko R., Ralf-Edwards A. Short-term low-dose propofol anaesthesia associated with severe metabolic acidosis. Anaesth. Intensive Care, 2006; 34: 651 – 655.
39. Roberts R.J., Barletta J.F, Fong J.J., et al: Incidence of propofol-related infusion syndrome in critically ill adults: A prospective, multicenter study. Crit. Care2009; 13:R169.
40. Barr J., Zomorodi K., Bertaccini E.J. et al: A double-blind, randomized comparison of i.v.lorazepam versus midazolam for sedation of ICU patients via a pharmacologic model. Anesthesiology2001; 95:286–298
41. Shafer A: Complications of sedation with midazolam in the intensive care unit and a comparison with other sedative regimens.Crit Care Med, 1998; 26:947–956
42. Swart E.L., Zuideveld K.P., de Jongh J, et al: Population pharmacodynamics modelling of lorazepam- and midazolam-induced sedation upon long-term continuous infusion in critically ill patients. Eur. J. Clin. Pharmacol., 2006; 62:185–194
43. Swart E.L., de Jongh J., Zuideveld K.P., et al: Population pharmacokinetics of lorazepam and midazolam and their metabolites in intensive care patients on continuous veno-venous hemofiltration. Am. J. Kidney Dis.2005; 45:360–371.
44. Swart EL, Zuideveld K.P., de Jongh J., et al: Comparative population pharmacokinetics of lorazepam and midazolam during long-term continuous infusion in critically ill patients. Br. J. Clin.Pharmacol, 2004; 57:135–145.
45. Swart E.L., Zuideveld K.P., de Jongh J., et al: Comparative population pharmacokinetics of lorazepam and midazolam during long-term continuous infusion in critically ill patients. Br. J. Clin.Pharmacol., 2004; 57:135–145
46. Ariano R.E. Kassum D.A., Aronson K.J.: Comparison of sedative recovery time after midazolam versus diazepam administration. Crit. Care Med, 1994; 22:1492–1496.
47. Shruti B. Patel and John P. Kress "Sedation and Analgesia in the Mechanically Ventilated Patient", American Journal of Respiratory and Critical Care Medicine, Vol. 185, No. 5 (2012), pp. 486-497.
48. De Hert S.G., Van der Linden P.J., Cromheecke S., et al (2004). Cardioprotective properties of sevoflurane in patients undergoing coronary surgery with cardiopulmonary bypass are related to the modalities of its administration. Anesthesiology, 101:299-310
49. Hellstrom J., Owall A., V. Sackey P.V. Cardiac outcome after sevoflurane versus propofol sedation following coronary bypass surgery: a pilot study. Acta Anaesthesiol. Scand., 2011; 55: 460 – 467.
50. Soro M., Gallego L., Silva V. et al. Sevoflurane and propofol during anaesthesia and the postoperative period in coronary bypass graft surgery: a double-blind randomised study. Eur J Anaesthesiol 2012; 29: 1 – 9.
51. Bellgardt M., Bomberg H., Herzog-Niescery J. et al. Survival after long-term isoflurane sedation as opposed to intravenous sedation in critically ill surgical patients. Eur J Anaesthesiol 2015; 32:1–8.
52. Mesnil M, Capdevila X, Bringuier S et al. Long-term sedation in intensive care unit: a randomized comparison between i haled sevoflurane and intravenous propofol or midazolam. Intensive Care Med 2011; 37: 933–941.
53. Martin J.,Heymann A.,Basell K.et al. Evidence and consensus-based German guidelines for the management of analgesia, sedation and delirium in intensive care– short version. Ger Med Sci, 2010, 8: Doc02.
54. Soro M., Belda F.J., Badenes R., Alcantara M.J. Use of the AnaConDa (Anestesia Conserving Device) with sevoflurane in critical care patients. Eur J Anaesthesiol, 2004, 21 (suppl 32):708a
55. Meiser A., Sirtl C., Bellgardt M., et al. Desflurane compared with propofol for postoperative sedation in the intensive care unit. Br. J. Anaesth, 2003. 90:273-280.
56. Буров Н.Е. Представления о механизме анестезиологических и лечебных свойств ксенона. Анестезиология и реаниматология. 2011; 2: 58-62.
57. Стряпко Н.В., Сазонтова Т.Г., Потиевская В.И., Хайруллина А.А., Вдовина И.Б., Куликов А.И., Архипенко Ю.В., Молчанов И.В. Адаптационный эффект многократного применения ксенона. Общая реаниматология, 2014. Т.10, №2, V.10. – С. 50 – 56.
58. Liu W., LiuY., Chen H. et al.: Xenon preconditioning: molecular mechanisms and biological effects. Medical Gas Research 2013 3:3, p. 1 – 5.
59. Глумчер Ф.С., Стрепетова Е.В., Перебийнис М.В., Мухоморов А.Е. BIS-мониторинг лечебного ксенонового наркоза в клинике интенсивной терапии. Ксенон и инертные газы в медицине. Мат-лы третьей конференции анестезиолого-реаниматологов медицинских учреждений МО РФ. 27 апреля 2012 г. М.; 2012: 63 - 66.
60. Молчанов И.В, Потиевская В.И., Пулина Н.Н., Шебзухова Е.Х. Лечение больных с острым коронарным синдромом ингаляциями ксенона. Доктор. Ру. 2012; 10(78): 35 – 40.
61. Sandimenge A. Sedation of ventilated patients and analgesia. Clin. Pulm. Med.2010. Vol. 17(6): 290-9.
62. Алексеева Г.В., Гурвич А.М., Семченко В.В. Постреанимационная энцефалопатия (патогенез, клиника, профилактика и лечение). 2-е изд., доп. и перераб. Омск: Омская областная типография, 2002. – 152 с.
63. Алексеева Г.В., Молчанов И.В., Семченко В.В. Клиническая неврология и интенсивная терапия постреанимационного поражения нервной системы (острый период) Пособие для врачей (утв. Ученым Советом МЗ и СР РФ (2006), 26 с.
Перинатальная энцефалопатия – группа заболеваний, взаимосвязанных с повреждением мозгового вещества чаще гипоксически-ишемического генеза. Патология выявляется у новорожденных детей, это значит, что повреждающие факторы воздействуют на нервную ткань в период внутриутробного развития, родов или в первую неделю жизни младенца. В 90% случаев у матерей новорожденных с диагностированной ПЭП выявляется отягощенный анамнез (угроза прерывания беременности, токсикозы в I, II триместре, преждевременные роды).
Характеристика
Энцефалопатия – медицинский термин, который значит повреждение вещества головного мозга неинфекционного генеза. Перинатальный – это слово, которое означает, что к этому периоду времени относят промежуток от 22 недели гестации до 7 дня жизни грудничка. К перинатальному относят антенатальный (от 28 недели до родов), интранатальный (роды), неонатальный (от момента рождения до 7 дней жизни) периоды. В неонатальный период происходит адаптация новорожденного к новым внешним условиям.
Перинатальная энцефалопатия (ПЭП) у детей – это такая патология, которая отражает поражение мозгового вещества, что происходит на фоне разных патологических процессов. ПЭП у новорожденных – это группа заболеваний, подразумевающая структурно-морфологические или функциональные нарушения головного мозга.
Заболевание перинатальная энцефалопатия не выделяется отдельным кодом в МКБ-10. Однако подобный диагноз встречается в педиатрической практике в отношении детей до года, у которых наблюдаются неврологические расстройства, в том числе двигательные и психические. По истечении 1 месяца жизни новорожденного, невропатолог на основе неврологической симптоматики, опираясь на результаты инструментального обследования, ставит точный диагноз с указанием этиологической природы патологии.
Распространенность перинатальной энцефалопатии достигает около 700 случаев на 1 тысячу новорожденных. Детям грудного возраста, получающим стационарное лечение, в 90% случаев ставят основной или сопутствующий диагноз ПЭП. Клинические исследования показывают, что в большинстве случаев диагноз не соответствует действительности. Врач часто указывает эту патологию, если не выяснил причины синдрома двигательных и других неврологических нарушений.
Классификация
Классификация перинатальной энцефалопатии у новорожденных осуществляется с учетом этиологических факторов. В зависимости от доминирующего поражающего фактора выделяют формы:
- Гипоксическую, обусловленную кислородной недостаточностью.
- Травматическую, связанную с механическими повреждениями мозга плода.
- Токсико-метаболическую, коррелирующую с нарушением обмена веществ и токсическими воздействиями.
- Инфекционную, обусловленную инфекционно-воспалительными процессами.

Гипоксия занимает ведущую роль в структуре причин возникновения ПЭП. Токсические воздействия и инфекционные процессы кроме прямого повреждающего воздействия на нервную ткань провоцируют нарушение маточно-плацентарного кровообращения, что приводит к развитию внутриутробной гипоксии, протекающей в хронической форме. На фоне кислородного голодания развивается ишемия нервной ткани.
Травмы, полученные плодом во время родовой деятельности, ассоциируются с механическим повреждением мозговых структур и нередко приводят к нарушению кровообращения в вертебробазилярном бассейне, что сказывается усугублением гипоксическо-ишемических процессов. При неблагополучном течении беременности и родов, гипоксия становится универсальным повреждающим фактором, провоцирующим развитие ПЭП.
Причины возникновения
ПЭП у новорожденных – это такой диагноз, который характеризуется повреждением мозгового вещества, что негативно сказывается на функциях ЦНС. Основные причины заболевания связаны с повреждающим воздействием патологических факторов и процессов:
- Гипоксия плода (кислородная недостаточность) – внутриутробная, интранатальная.
- Механические травмы плода во время родов.
- Инфекционные и вирусные поражения плода.
- Токсическое воздействие на плод.
- Наследственная предрасположенность.
Чаще диагностируется ПЭП смешанного генеза, что предполагает участие в патологическом процессе нескольких факторов. Перинатальная патология гипоксического генеза – это часто встречающаяся форма, которая характеризуется повреждением тканей нервной системы вследствие кислородного голодания.
Гипоксия сопровождается комплексом расстройств, которые сказываются на реологических свойствах крови, гемодинамике и микроциркуляции, затрагивают метаболические процессы. В результате происходит повреждение нервной ткани, обусловленное геморрагическим инфарктом и ишемией.
На фоне ишемических процессов впоследствии развивается лейкомаляция – поражение белого мозгового вещества. Перинатальная энцефалопатия – это такая патология, которая возникает на фоне заболеваний и неблагоприятных воздействий, направленных на беременных женщин, что часто связано с причинами:
- Соматические заболевания, сопровождающиеся эффектами интоксикации, перенесенные матерью в период гестации.
- Инфекционные болезни (новые формы или обострение хронических инфекций), перенесенные матерью в период гестации.
- Незрелость организма женщины, вынашивающей плод.
- Неполноценное питание, провоцирующее дефицит витаминов и других нутриентов.
- Наследственные заболевания у матери.
- Нарушения метаболизма.
- Неблагоприятные экологические условия, вредные внешние воздействия (загрязнение воздуха и воды отравляющими веществами, ионизирующее излучение).

В числе факторов, провоцирующих развитие перинатальной гипоксически-ишемической энцефалопатии, стоит отметить патологическое протекание беременности (угроза прерывания, токсикозы) и родов (травмы ребенка вследствие применения вспомогательных инструментов, замедление родовой деятельности, стремительные роды).
Клинические проявления
Перинатальная энцефалопатия – это такая патология, которая проявляется характерными синдромами, что предполагает схожесть клинической картины независимо от ведущих этиологических факторов. Клинические синдромы:
- Усиление нервно-рефлекторной возбудимости.
- СДН – комплекс двигательных нарушений (парезы – слабость мышц центрального и периферического типа, экстрапирамидные нарушения, мозжечковые расстройства).
- Судорожный (внезапные приступы неконтролируемых мышечных сокращений).
- Гидроцефальный (нарушение ликвородинамики на фоне увеличения продукции и ухудшения абсорбции цереброспинальной жидкости с последующим повышением значений внутричерепного давления).
Диагноз ПЭП (расшифровка – перинатальная энцефалопатия) у ребенка – это такая патология, которая приводит к замедлению психического и физического развития, что проявляется медленным ростом и набором массы тела, нарушением формирования доречевых и речевых навыков, ухудшением становления корковых функций.
Симптомы ПЭП у новорожденных проявляются в зависимости от нозологической формы патологии. К примеру, при легкой форме церебральной ишемии наблюдается возбуждение или угнетение деятельности ЦНС, которое длится не больше 7 суток.
При церебральной ишемии умеренной степени клиническая картина дополняется признаками: судороги, повышение показателей внутричерепного давления, нарушения в работе автономного отдела ЦНС (нарушение дыхательной и сердечной деятельности). Если церебральная ишемия протекает в тяжелой форме, угнетение деятельности ЦНС носит прогрессирующий характер, продолжается дольше 10 суток. Тяжелая ишемия вариативно приводит к последствиям:
- Переходу в коматозное состояние.
- Трансформации в возбужденное состояние, сопровождающееся устойчивым судорожным статусом.
- Судорогам с последующей комой.
Возможно развитие эпилептического статуса с последующим нарушением деятельности стволовых структур мозга, которые регулируют витальные функции (дыхание, работу сердца). Процессы декортикации и децеребрации отражают деструктивно-атрофические изменения в нервной ткани. Симптомы перинатальной энцефалопатии, развивающейся на фоне внутричерепного кровоизлияния, ассоциированного с гипоксией, зависят от степени повреждения мозгового вещества. При легкой форме течения патология может не проявляться какими-либо признаками.
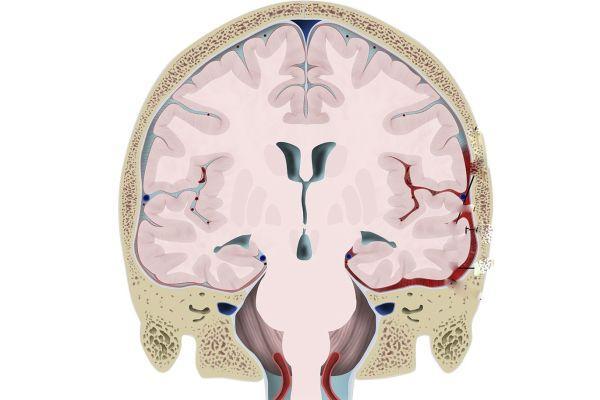
При умеренной форме наблюдаются признаки: шок, апноэ (кратковременные остановки дыхания), судорожный синдром, помрачение, угнетение сознания, развитие коматозного состояния, повышение показателей внутричерепного давления. Симптомы могут наблюдаться постоянно или носить транзиторный (преходящий) характер. Возникновение геморрагических очагов в мозге на фоне перинатальной постгипоксической энцефалопатии сопровождается признаками:
- Ухудшение общего самочувствия, которое проявляется внезапно и приводит к развитию состояния угнетенного сознания, чаще чередующегося с периодами психомоторного возбуждения.
- Выпячивание родничка.
- Глазодвигательные нарушения (аномальные движения, совершаемые глазными яблоками).
- Расстройство терморегуляции (гипотермия – переохлаждение, гипертермия – перегревание организма).
- Нарушения в работе вегетативной системы (частые срыгивания, тахикардия – увеличение числа сердечных сокращений, тахипноэ – учащенное, поверхностное дыхание, метеоризм, расстройство стула).
- Псевдобульбарные расстройства (дизартрия – нарушение произношения, дисфония – уменьшение силы и звучности голоса, дисфагия – нарушение функции глотания, насильственный плач или смех).
Постгипоксическая энцефалопатия, возникающая на фоне внутричерепных кровоизлияний, сопровождается анемией (дефицит гемоглобина), гипогликемией (пониженная концентрация глюкозы), ацидозом (смещение кислотно-щелочного баланса крови в сторону увеличения кислотности) и другими метаболическими расстройствами. Нередко к нарушениям в работе ЦНС присоединяются соматические заболевания – пневмония, сепсис, сердечная недостаточность.
Выраженные клинические проявления являются поводом для стационарного лечения. При наличии признаков легкого поражения мозгового вещества, ребенка выписывают из роддома, он попадает в группу риска и подлежит медицинскому наблюдению с периодичностью 1 раз в месяц. Такой подход часто приводит к отсутствию терапии в острый период. Лечение проводится с опозданием, в период, когда проявляются осложнения ПЭП, что понижает терапевтический эффект.
Диагностика
Сразу после рождения проводится физикальный осмотр ребенка, ставится оценка по шкале Апгар. Неблагоприятный прогноз коррелирует с сохранением на протяжении дольше, чем 5 минут оценки Апгар меньше 3 балла. Неблагоприятные прогностические критерии: появление судорог в первые 8 часов после рождения, устойчивое понижение мышечного тонуса.

У таких детей впоследствии часто развивается церебральный паралич, эпилепсия, умственная отсталость. Диагноз ставит врач-неонатолог или перинатальный невролог. Диагностическое обследование и лечение проводится в отделениях детской неврологии. Основные инструментальные методы обследования:
- Нейросонография (ультразвуковое исследование тканей центрального отдела нервной системы).
- Допплерография (определение состояния кровеносной системы, питающей мозг).
- МРТ, КТ (изучение морфологической структуры и особенностей функционирования ЦНС).
- Электроэнцефалография (изучение биоэлектрической активности мозга).
Ультразвуковая диагностика в формате ДЭГ показывает признаки гипоперфузии (ухудшение прохождения крови через нервную ткань). Исследование в формате МРТ показывает наличие очагового повреждения нервной ткани. В тяжелых случаях выявляется уменьшение плотности мозгового вещества. Перинатальная неврология предполагает проведение тщательной дифференциальной диагностики.
К примеру, гипотиреоидная энцефалопатия развивается как следствие гипотиреоза – снижения продукции гормонов щитовидной железы. Заболевание проявляется такими симптомами, как задержка физического и психического развития, снижение мышечного тонуса, вялость, отказ от приема пищи. У младенца долгое время сохраняется большой диаметр родничка. Подобная симптоматика может быть ошибочно истолкована как признаки ПЭП иного генеза.
Лечение
Современная медицина не дает точных клинических рекомендаций в отношении ПЭП. К примеру, доктор Комаровский утверждает, что протокол лечения перинатальной энцефалопатии не может быть разработан, потому что в цивилизованном мире не существует подобного диагноза. Чтобы устранить симптоматику, которая появилась у ребенка в послеродовой период, нужно выяснить точные причины нарушений и провести корректную терапию.
Лечение постгипоксической энцефалопатии у детей и взрослых предполагает соблюдение режима, в том числе уменьшение воздействия световых, звуковых раздражителей, организацию полноценного питания. Режимные мероприятия направлены на предотвращение переохлаждения, перегревания младенца. Если у новорожденного отсутствует аппетит, он отказывается от еды, назначают парентеральное (посредством внутривенного введения) питание. Постоянно осуществляется мониторинг витальных функций.
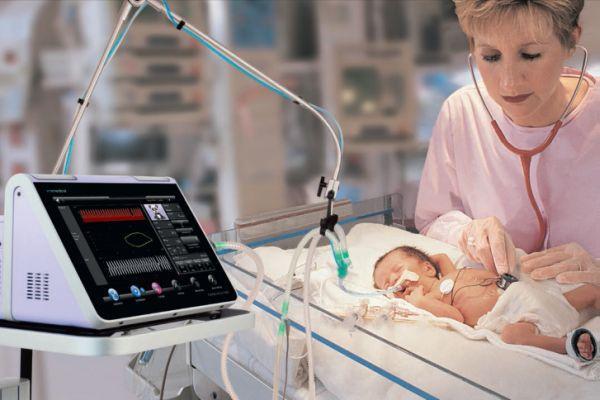
Новорожденных, у которых выявляется отек мозгового вещества, коматозное состояние, подключают к аппарату ИВЛ (аппаратная вентиляция легких). Им назначают Фенобарбитал (оказывает противосудорожный, противоэпилептический эффект). При отсутствии внутричерепного кровоизлияния показаны диуретики (Маннит, Лазикс). Если отек мозга прогрессирует, диуретики сочетают с кортикостероидами (Дексаметазон).
Параллельно назначают антигипоксанты (Пирацетам, Кокарбоксилаза), антиоксиданты (Альфа-токоферола ацетат). При наличии двигательных нарушений, изменении мышечного тонуса после завершения острого периода назначают массаж, лечебную гимнастику, физиопроцедуры, водные процедуры. Длительность восстановительного периода составляет 1-12 месяцев, у недоношенных младенцев продолжительность реабилитации может достигать 24 месяцев.
Последствия
Исходы ПЭП варьируются в зависимости от степени повреждения нервной ткани, тяжести течения, наличия адекватной терапии, индивидуальных особенностей организма младенца. Выздоровление сопровождается нормализацией физического и психического развития. В других случаях признаки задержки развития сохраняются, чаще в сочетании со слабо выраженной очаговой симптоматикой.
При патологическом варианте течения, последствия ПЭП проявляются во взрослой жизни, чаще выражаются в возникновении двигательного дефекта, обусловленного парезами, экстрапирамидными расстройствами, мозжечковыми нарушениями. Другие долговременные последствия перенесенной перинатальной энцефалопатии: развитие эпилепсии, нарушение корковых функций (мыслительная деятельность, интеллектуальные способности). Последствия ПЭП:
- Энцефаломиелопатия – прогрессирующее заболевание ЦНС, обусловленное нарушением обмена веществ.
- ДЦП – церебральный паралич, сопровождающийся нарушением моторной активности, ходьбы, невозможностью удерживать равновесие.
- Умственная отсталость, обусловленная органическим поражением мозгового вещества.
- Гидроцефалия – нарушение ликвородинамики с накоплением цереброспинальной жидкости в желудочковой системе мозга и субарахноидальных пространствах.
- Эпилепсия – возникновение повторных эпилептических приступов.
Выраженные постгипоксические нарушения нередко становятся причиной социальной дезадаптации, ограничения или утраты способности к профессиональной деятельности. Такие дети часто требуют постоянного ухода и медицинского наблюдения, у них поздно формируются (в тяжелых случаях отсутствуют) навыки речи.
Перинатальная энцефалопатия отражает нарушение функций ЦНС, обусловленное повреждением мозгового вещества разной этиологии. Степень выраженности нарушений коррелирует с объемом и характером поражения нервной ткани.
Читайте также:


