Что такое моноклональные антитела и рассеянный склероз
Моноклональные антитела – это чудо генной инженерии. Они помогают избавиться от многих патологий. Препараты на основе моноклональных антител считаются новейшими. Далее разберемся, что собой представляют эти элементы, какую пользу приносят.
Общие сведения
Использование моноклональных антител началось совсем недавно. Несколько десятков лет от некоторых патологий было невозможно избавиться. К ним, в частности, относят онкологические, аутоиммунные, инфекционные, сердечно-сосудистые болезни. Лечение моноклональными антителами осуществляется при воспалительных реакциях разного генеза, идиопатическом фиброзе легких, гепатите В, ревматоидном артрите, СПИДе. К недугам, при которых прибегают к помощи данных элементов, относят также системную красную волчанку, болезнь Альцгеймера, мышечную дистрофию, аллергические реакции. Эффективны моноклональные антитела при рассеянном склерозе, диабете и прочих патологиях.
Распространенность средств на фармацевтическом рынке
С середины девяностых годов прошлого столетия и до настоящего момента одобрено более 30 медикаментов, в состав которых входят моноклональные антитела. В первое время безопасность, надежность технологий и способов производства средств вызывали некоторые опасения у специалистов. Сейчас многие фармацевтические компании работают над созданием медикаментов, в состав которых будут входить моноклональные антитела. Отзывы ряда исследователей подтверждают эффективность и безопасность указанных средств. Это подтверждает и тот факт, что на сегодняшний день в мире в стадии разработки находится порядка 300 подобных медикаментов.
История открытия
Впервые моноклональные антитела стали изучать в конце XIX века. С того времени, более чем за сто лет, эти элементы успели совершить революцию в медицине. Они полностью перевернули представления специалистов о возможностях медикаментозного воздействия.
Первый этап исследований
В конце XIX – начале ХХ века была произведена иммунизация антителами животного происхождения. Исследователи с давнего времени интересуются различными механизмами, действующими в организме человека. Один из наиболее занимательных из них – процесс создания разнообразных антител. Эти элементы обладают уникальной особенностью по отношению к чужеродным веществам (антигенам). Исследования ученых были направлены на выявление механизма работы этих антител.
Одним из первых шагов в освещении данной проблемы стало открытие методов избавления от дифтерии. Этим вопросом была занята группа ученых Института инфекционных патологий Берлина. Надо отметить, что дифтерия в конце XIX в. считалась смертельно опасной. Эмиль Беринг (иммунолог-бактериолог) сделал предположение о том, что лечение данной патологии может быть успешным при проявлении естественной реакции защиты путем нейтрализации токсина, выделявшегося дифтерийными бактериями. Совместно с японским ученым Китасато Беринг установил, что для защиты неиммунизированных животных может вводиться антитоксин (сыворотка) иммунизированных зверей.
В 1894 году в Германии во время дифтерийной эпидемии, которая унесла жизни порядка 50 тысяч детей, были изготовлены первые 25 000 доз антитоксина. Беринг в 1901 году был награжден Нобелевской премией за разработку сыворотки. Однако на тот момент эффективность антитоксина являлась достаточно низкой. Это было связано с тем, что выработка антител осуществлялась организмом не человека, а животного. В связи с этим вырабатывался только пассивный иммунитет. Кроме того, вводить антитоксин было необходимо непосредственно после инфицирования, в противном случае это не являлось целесообразным и вообще не приносило никакого эффекта.
Антисывороточная терапия людей использовалась также Жюлем Эрикуром и Чарльзом Ричетом. Проводя иммунизацию животных тканью саркомы, они вводили сыворотку в организм людей, страдающих от онкологических заболеваний. К середине тридцатых годов ХХ в. практическое внедрение средств для формирования пассивного иммунитета прекратилось. Это было связано с открытием антибиотиков, обладавших широким спектром активности.
Расшифровка структуры МАТ
К тридцатым годам прошлого столетия стали появляться специальные центрифуги. Благодаря этим агрегатам достигалось разделение антител по размерам и электрическому заряду. Однако последующая расшифровка была весьма затруднена. Это объяснялось большими размерами антител, превышавшими габариты белковых молекул в двадцать раз. Структуры последних к тому времени были уже расшифрованы.
К 1962 году на основании многочисленных исследований, которые проводились разными научными деятелями, Родни Портером была описана основная структура антител. Стало известно, что они состоят из тяжелой и легкой цепи. Впоследствии была определена последовательность 1.3 тыс. аминокислот. Они входили в белковую цепь антитела, которые вырабатывались клетками миеломы (раковой опухоли). На тот момент это была максимальная расшифровка последовательности аминокислот. В 1972 за указанные исследования была присуждена Нобелевская премия Портеру и Эдельману – ученому, совместно с которым проводилась данная работа. По итогам исследований было определено, что форма антитела представлена в виде буквы Y. Нижняя ее часть – тяжелая цепь. Она обладает постоянной структурой для разных антител. Верхняя часть элемента – легкие цепи. За счет последних происходит связывание антигена и антитела, а также их последующая нейтрализация.

Разработка первичной технологии синтеза
К семидесятым годам прошлого века уже был известен ряд важных моментов механизма формирования и выработки антител у человека. Так, удалось выявить, что в процессе участвуют В-лимфоциты. При этом каждый из них мог выработать только одно антитело. В-лимфоцитам свойственна редупликация. За счет этого они производят идентичные по своей структуре моноклональные антитела, то есть произошедшие от одной клетки. Выработки элементов с такой же скоростью, но в лабораторных условиях, удалось достичь Келеру и Мильштейну в 1975 году. К тому времени была изучена способность клеток миеломы к быстрому производству идентичных себе структур. При этом существовала также возможность выделения антителопродуцирующих элементов из организма животных.
В технологии Келера и Мильштейна было несколько этапов. В качестве подопытного животного взяли мышь. Сначала у нее вырабатывался иммунитет к антигену. После этого из селезенки мыши выделялись антителопродуцирующие клетки. Они с использованием особой технологии соединялись с элементами миеломы. В результате получалась гибридома. Ее клетки в большом количестве и непрерывно синтезировали антитела, направленные на известный антиген. Данная методика стала революционной. Благодаря ей стало возможно получать антитела, которые удивительно точно соответствовали определенной структуре. Впоследствии эту технологию усовершенствовали.
В 1984 году Мильштейн, Келер и Ерне (иммунолог из Дании) получили Нобелевскую премию за проделанную работу и участие в производстве антител, которые можно применять в диагностических исследованиях и создании медикаментов. С течением времени были разработаны и прочие технологии. Они позволили усовершенствовать процесс синтеза антител за счет развития методов рекомбинации ДНК, клонирования клеток и иных достижений генной инженерии.
Моноклональные антитела: применение
Первые попытки осуществить внедрение элементов, синтезированных искусственным образом из животных клеток, были сопряжены с трудностями. Речь идет об исследованиях, проводимых в 1979 году Сташенко и Надлером. Они внедрили моноклональные антитела, синтезированные из клеток мышей. Элементы были направлены против антигенов, вырабатывавшихся на поверхности раковых структур. Но в ходе процесса было выявлено, что мышиные моноклональные антитела связывались с опухолевыми фрагментами в незначительной степени. Организм же воспринимал их как чужеродные. В 1986 году появилось новое лекарство. Моноклональные антитела, содержащиеся в нем, способствовали купированию реакции отторжения трансплантата почек. Это средство называлось "Ортоклон ОКТЗ". Оно обладало избирательным иммунноподавляющим воздействием. Медикамент отличался животным происхождением, синтезировался мышиными гибридомами, которые получались слиянием миеломы и В-лимфоцитов. Однако вскоре после того как медикамент вышел на рынок, стало понятно, что продолжительная терапия моноклональными антителами с течением времени теряет свою эффективность. Это было обусловлено тем, что белки животных для человека являются иммуногенными. Другими словами, они воспринимаются организмом как чужеродные. Из-за этого у больных, которым производится введение мышиных антител, начинают образовываться антимышиные элементы человеческой природы (НАМА). Они обладают нейтрализующим действием.
Создание химерных структур
С начала 90-х годов прошлого столетия стал использоваться новый метод производства моноклональных антител. На базе молекулярно-биологических технологий и рекомбинации ДНК были созданы химерные структуры. В них часть мышиной молекулы при помощи генно-инженерных методов заменялась участком человеческого происхождения. Оставшийся фрагмент оставался животным. В связи с тем, что белковая последовательность на 75% состояла из структур человеческого происхождения, у пациентов, которым вводились гуманизированные моноклональные антитела, НАМА появлялись значительно меньше. Впоследствии были выпущены такие средства, как "Ритуксан" и "Мабтера", которые назначались при раке, "Ремикейд" – при болезни Крона, "Симулект" – для предотвращения отторжения трансплантата почек острого характера, "Реопро" – для профилактики острого инфаркта и стенокардии. Все эти медикаменты содержали химерные моноклональные антитела.
При псориазе, раке желудка и молочной железы средства стали выпускаться чуть позже. После разработки химерных структур существенно снизилась необходимость прибегать к помощи животных элементов. Однако в ряде случаев медикаменты с мышиными антителами назначаются вполне оправданно.
На сегодняшний день существует три одобренных медициной средства, содержащих животные структуры. К ним, в частности, относят уже известный препарат "Ортоклон ОКТЗ", а также средства "Бексар" и "Зевалин". Последние два – радиоактивно меченые мышиные антитела. В их функции входит транспортировка радиоизотопов к структурам лимфомы. Присутствие радиоактивной метки дает возможность использовать эти моноклональные антитела в незначительных количествах. В связи с этим иммуногенность, которая обусловлена животными последовательностями, в данном случае не настолько значима. Кроме всего прочего, присутствие в медикаментах только мышиных антител делает их несколько эффективнее. Это объясняется тем, что химерные структуры могут связываться не только с элементами-мишенями, но и с нормальными клетками, и наносить им вред. Одобрен сегодня еще один медикамент на основе крысино-мышиных структур. Называется он "Реммоваб". Назначается препарат при злокачественном асците.
Новые медикаменты
К концу 90-х годов при помощи генно-инженерных методов исследователям удалось свести к минимуму объем животных последовательностей аминокислот в синтезируемых искусственным образом антителах. В результате были получены новые структуры, в еще меньшей степени вызывающие формирование НАМА у человека. С этого времени на фармацевтическом рынке появилось множество новых средств. В частности, к ним относятся такие медикаменты, как "Зенапакс" (рекомендован для предупреждения отторжения почечного трансплантата), "Герцептин" (назначается при раке в молочных железах и желудке), "Ксолар" (при аллергическом сезонном рините и атопической бронхиальной астме). В них используются новые моноклональные антитела. Препараты при псориазе стали еще одной новой разработкой исследователей. В частности, был выпущен такой медикамент, как "Раптива".
Разработки последнего десятилетия
В 2000-х годах методы генной инженерии были усовершенствованы еще больше. Благодаря этому удалось получить человеческие моноклональные антитела. При псориазе, раковых патологиях, атопической бронхиальной астме и прочих болезнях стали назначаться медикаменты нового поколения. Сегодня такие средства чаще всего разрабатывают при помощи технологии трансгенных животных. Речь в данном случае идет о мышах, которые выведены с фрагментами чужеродной ДНК. Также разработка осуществляется с помощью вирусов-бактериофагов.
Заболевания с тяжелым течением
Сложно переоценить значение, которое имеют для человечества моноклональные антитела. Препараты при псориазе стали настоящим прогрессом в медицине. Сегодня существует много медикаментов, направленных на устранение данной патологии. В настоящее время осуществляется лечение псориаза моноклональными антителами с помощью таких препаратов:
- "Даклизумаб" и "Базиликсимаб". Действие этих медикаментов направлено против СД25-молекулы.
- Средства h3D1 и h1F1. В их составе присутствуют гуманизированные антитела. Их действие направлено против молекул СД86 и СД80. В ходе клинических испытаний была отмечена высокая эффективность и достаточно хорошая переносимость этих препаратов.
- "Эфализумаб". Это моноклональное антитело направлено против молекулы СД11а.
- "Алефацепт" представляет собой растворимый белок. В его структуре присутствуют две молекулы, при взаимодействии которых появляется сигнал, активирующий лимфоцит.
- "Кленоликсимаб". Это средство направлено против СД4. Назначается не только при псориазе, но и при сахарном диабете.
- "Эпратузумаб". Препарат борется с В-лимфоцитами.
- "Анакинра" представляет собой созданный искусственным образом антагонист рецептора интерлейкина. При проникновении в организм связывается с ИЛ-1 и препятствует его соединению со своим рецептором. Это, в свою очередь, снижает воспалительную реакцию.
Еще одним распространенным заболеванием сегодня считается рассеянный склероз. Это хроническая аутоиммунная патология, которая появляется в среднем и юном возрасте – от 15 до 40 лет. Некоторые моноклональные антитела при рассеянном склерозе стали назначаться фактически случайно. Например, средство "Алемтузумаб". Указанный медикамент рекомендован пациентам с Т-клеточной лимфомой и лимфоцитарным лейкозом хронического течения. С течением времени врачи стали отмечать положительное влияние этого моноклонального антитела на больных рассеянным склерозом. Эффективность средства была позже подтверждена исследованиями, которые завершились в 2008 году. Однако медикамент обладает рядом серьезных побочных действий. Речь, в частности, идет об аллергических реакциях, инфекционных осложнениях, аутоиммунных патологиях, связанных в большинстве случаев с дисфункцией щитовидки. Вот почему, по мнению ряда специалистов, медикамент "Алемтузумаб" может использоваться лишь в качестве альтернативного средства для тех больных, которым не помогли стандартные меры. В крайне редких случаях его назначают в качестве базового.
Перспективные направления исследований
Ученые-разработчики поставили перед собой актуальную задачу – создать иммуномагнитный фильтр, своеобразный сорбент. Моноклональные антитела, привязанные к ферромагнитным микроструктурам и находящиеся в магнитном поле, способны с высокой специфичностью извлекать клетки, к примеру, из опухоли либо костного мозга. После этого фильтр отделяют, оставляют только извлеченные фрагменты. При помощи данного метода можно связывать и устранять злокачественные и получать здоровые клетки из костного мозга. При нарушениях кроветворения они вводятся в организм этого же пациента.
Актуальные проблемы
В России на настоящий момент порядка десяти препаратов на основе моноклональных антител находятся в стадии разработки. Однако перед учеными сегодня стоит множество важных задач. Одной из них является решение проблемы иммуногенности медикаментов. Многие препараты включают человеческие антитела. Они, безусловно, снижают иммуногенность, но не устраняют ее полностью. Это связано с тем, что защитная система людей способна вырабатывать антитела против любых терапевтических антител.
Еще одной проблемой является достаточно крупный размер молекул МАТ. В связи с этим они не способны проникать внутрь клеток либо глубоко в ткани. Медикаменты не предназначены для приема внутрь. Это обусловлено тем, что для достижения необходимого эффекта концентрация моноклональных антител должна превышать количество мишеней в несколько тысяч раз. Поэтому сегодня ученые озабочены разработкой медикаментов, которые соединили бы в себе все полезные свойства МАТ и мелкомолекулярных средств.
Важные открытия
Одной из последних разработок в области создания медикаментов на основе МАТ является формирование особенных аффител. Они обладают свойствами антител, однако имеют сравнительно небольшую молекулярную массу. Это позволяет им проникать глубже в ткани.
Еще одной разработкой являются нанотела. Такие средства отличаются высокой стабильностью. Это позволяет применять их как местно, так и внутрь.
Еще одним сверхсовременным направлением является деятельность по разработке доменовых антител. Они должны соответствовать разным отделам легкой и тяжелой цепи человеческих структур и быть меньше обычных в десять раз. Такие моноклональные антитела можно будет применять ингаляционно и внутрь.
Заключение
Существенным препятствием для применения моноклональных антител считается высокая стоимость и продолжительность производственного процесса. Тем не менее ученые не прекращают работу над созданием новых технологий, которые позволили бы выпускать медикаменты в ускоренные сроки и по доступной цене. В целом специалисты говорят о том, что в ближайшем будущем спектр патологий, которые можно будет лечить с помощью моноклональных антител, существенно расширится.
В настоящее время моноклональные антитела к CD20 антигену В-лимфоцитов очень широко применяются для лечения рассеянного склероза (РС). На основании накопленных данных об эффективности ритуксимаба (RTX; Rituxan, Genentech и Biogen) при лечении нейроиммунных заболеваний был создан препарат окрелизумаб (OCR; Ocrevus, Genentech), который применяется для терапии РС.
Джаганадха Авасарала, университет штата Южная Каролина, Гринвилл, США
Реферат
Окрелизумаб обладает избирательной активностью в отношении CD20-позитивных B- лимфоцитов; он воздействует на поверхностные антигены, присутствующие на предшественниках В-клеток, зрелых В-лимфоцитах и В-клетках памяти, однако отсутствующих на поверхности стволовых лимфоидных клеток и поверхности плазмоцитов. На основании ряда доказательств представляется, что устранение антигенпредставляющих способностей В-клеток, а также их антигеннеспецифических иммунных функций является ключевым моментом эффекта терапии с помощью моноклональных антител к CD20 антигену. Важнейшим вопросом в этом отношении является следующий: почему же препарат необходимо вводить через строго определенные промежутки времени вместо того, чтобы использовать измеряемый показатель – количество периферических В-клеток? Существует очень мало научных доказательств того, что введение препарата 1 раз в 6 месяцев является максимально эффективным, особенно если не принимается во внимание такой показатель, как число CD20- лимфоцитов в периферической крови.
История вопроса и введение
В марте 2017 года окрелизумаб (OCR) был одобрен FDA (Управление по контролю качества пищевых продуктов и лекарственных препаратов США) для лечения рецидивирующей и первично-прогрессирующей форм рассеянного склероза (РС). Этот препарат является гуманизированным моноклональным антителом, благодаря которому произошел прорыв в лечении РС моноклональными антителами. Более подробное знакомство со свойствами окрелизумаба поможет лучше понять не только его свойства и фармакодинамику, но и принципы дозирования.
Из опубликованной к настоящему времени научной литературы можно узнать, что ритуксимаб (RTX) является химерным моноклональным антителом (содержит белковые компоненты как человека, так и грызунов), активность которого направлена на молекулы человеческих клеток С20, что вызывает в них (клетках) эффект цитотоксичности и апоптоз. В 2006 году FDA разрешило применять ритуксимаб для лечения ревматоидного артрита (РА). Впоследствии ритуксимаб также стал первым химерным моноклональным антителом для истощения клеточного пула В-клеток, которое оказалось эффективным и для терапии РС.
Препараты, предназначенные для селективного воздействия на CD20-позитивные B-зрительного нерва/нейромиелит зрительного нерва со спектральным расстройством, системная красная волчанка, периферическая нейропатия, полинейропатия, ассоциированная с анти-MAG (миелин-ассоциированный гликопротеин), хроническая воспалительная демиелинизирующая полинейропатия, подострая атаксическая нейропатия без парапротеинемии, тяжелая псевдопаралитическая миастения (миастения гравис), опсо-миоклональный синдром и воспалительные миопатии. И окрелизумаб, и ритуксимаб связываются с внеклеточным эпитопом CD20 на поверхности В-клеток, сайт связывания которых перекрывает оба препарата.
Поскольку ритуксимаб обладает способностью влиять на результаты проточного цитометрического анализа, представляется целесообразным использовать для подсчета клетки CD19, которые обладают сходным профилем экспрессии. Подсчет числа клеток CD19 как суррогатных маркеров CD20 обычно используется для определения даты новой инфузии препарата.
В зависимости от того, какие участки мозга окажутся повреждены, у больного начинают страдать зрение, координация движений, нарушается равновесие при ходьбе, появляется слабость в конечностях. Со временем могут перестать двигаться ноги и руки. Возможно снижение интеллекта.
– Что сегодня считается главным прорывом в лечении рассеянного склероза?

Наталья Хачанова. Фото: YouTube
Например, есть моноклональные антитела, заточенные на контакт с CD20-рецепторами на поверхности В-лимфоцитов. Такие антитела истощают пул только определенного типа лимфоцитов (эти клетки гибнут). А общий показатель лимфоцитов в крови будет в норме. Также есть вид антител, которые, связываясь с определенными молекулами, не дают иммунным клеткам-убийцам проникать через гематоэнцефалический барьер в мозг. Благодаря этому мы защищаем от разрушения ткань мозга.
Что такое моноклональные антитела
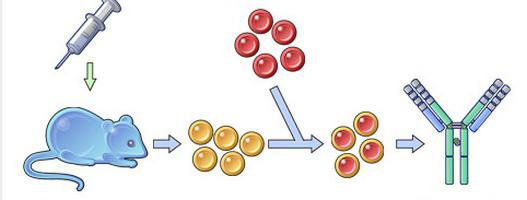
Исследователи берут какое-либо вещество, к которому нужно получить антитело. Это вещество вводят подопытному животному. Например, мыши. Начинается иммунная реакция, и в ответ на вторжение чужеродного вещества иммунная система животного производит клетки-антитела определенного типа. Они будут чувствительны именно к конкретному веществу. Антитела выделяют, очищают, и на их основе изготавливают лекарственные препараты (это очень упрощенное пояснение).
Моноклональными антитела называются потому, что они потомки-клоны одной (моно) клетки, размноженной в лаборатории (в пробирке).
ДВОЙНОЙ УДАР: ЭФФЕКТИВНО, НО… ОПАСНО
– Если появилось столько орудий, стреляющих точно в цель, то, казалось бы, борьба с рассеянным склерозом должна быть очень успешной. Можно ли, например, давать пациенту те самые препараты, блокирующие В-лимфоциты-убийцы, плюс моноклональные антитела, преграждающие путь опасным клеткам в мозг?
К тому же в принципе неизвестно, к чему может привести лекарственное взаимодействие различных типов антител. К сожалению, активных исследований комбинированной терапии моноклонов сегодня почти нет. А это действительно очень нужно.
В онкологии и ревматологии сейчас есть проверенные схемы, когда используют моноклональные антитела в комбинации с иммуносупрессорами. Это отработанный метод, более безопасный. Специалисты по лечению рассеянного склероза все больше склоняются к тому, что тоже нужно применять такую схему.
ЗАТОРМОЗИТЬ БОЛЕЗНЬ И ОТОДВИНУТЬ ИНВАЛИДНОСТЬ
– Вы сказали, что иммуносупрессоры более безопасны. При этом они, в отличие от моноклональных антител, снижают весь иммунитет в целом, не избирательно.
С другой стороны, те пациенты, которым удается избегать инфекций, чей организм менее ослаблен, благодаря новой терапии получают серьезные преимущества. Болезнь тормозится, и наступление инвалидности откладывается на годы.
Так что ситуацию каждого пациента с рассеянным склерозом нужно рассматривать очень индивидуально. Кому-то препараты нового поколения могут помочь и улучшить качество жизни, а кому-то – навредить.
ПЕРСПЕКТИВЫ
На помощь придут. гельминты?!
– В каком направлении сейчас ведутся разработки для лечения рассеянного склероза?
Также ведутся попытки разработать препараты, которые восстанавливали бы нервную ткань. Это называется ремиелинизация (то есть восстановление разрушенных иммунными клетками миелиновых оболочек нервных клеток. – Авт.). Один из препаратов показал хороший эффект на экспериментальных моделях, но о дальнейшем успехе пока не слышно.
– В Интернете можно найти сообщения, что, якобы, наличие гельминтов, или попросту глистов в организме человека едва ли не улучшает состояние при рассеянном склерозе.
– Да, такие работы есть. В одной из таких работ исследователи изучали наличие гельминтов и активность рассеянного склероза в двух группах пациентов: с гельминтами и без. Интересным оказался тот факт, что у больных из первой группы болезнь протекала более благоприятно. У пациентов без гельминтов рассеянный склероз развивался более активно. Попытка лечения гельминтов привела к активации болезни.
Разумеется, речь не идет о том, чтобы заражать людей гельминтами, эти паразиты не должны жить в нашем организме. Но, по всей видимости, гельминты выделяют какие-то вещества, модулирующие иммунитет и за счет этого влияющие на развитие рассеянного склероза. Все происходит в кишечнике, поэтому кишечный микробиом и вызывает такой пристальный интерес.
ЧИТАЙТЕ ТАКЖЕ
Сегодня они стали необходимым реагентом в биологических лабораториях. Продажи препаратов, в которых встречаются моноклональные антитела, направленные на терапию тяжелейших заболеваний (псориаз, рак, артрит, склероз), имеют многомиллиардный оборот. Хотя в 1975 году, когда была опубликована статья про метод получения гибридом, лишь единицы поверили в их практическое применение.
Что такое моноклональные антитела
Они вырабатываются иммунными клетками, происходящими от одной предшественницы, принадлежащими к одному клону. Это явление наблюдается при выращивании В-лимфоцитов в культуре. Такие антитела могут вырабатываться против почти любого природного антигена (к примеру, бороться с чужеродным белком и полисахаридами), который они будут специфически связывать. Далее они используются для обнаружения этого вещества или его очистки. Моноклоны широко применяются в биохимии, молекулярной биологии, медицине. Производить антитела нелегко, что напрямую влияет на их стоимость.
Получение моноклональных антител
Этот процесс начинается с иммунизации животных, как правило, мышей. Для этого вводят специфический антиген, который синтезирует антитела против него. Затем у мыши удаляется селезенка и гомогенизируется для получения суспензии клеток. Она содержит B-клетки, продуцирующее антитело. Затем их смешивают с миеломой (мышиной плазмоцитомы), которая имеет непрерывную способность синтезировать себе подобных в культуре (опухолевые клоны).
Благодаря слиянию образуются гибриды опухолевых и нормальных клеток (гибридомы), непрерывно растущие и способные производить смесь антител заданной специфичности. Следующий шаг после получения гибридом — клонирование и отбор. В каждую лунку специального планшета помещают около 10 слитых клеток и культивируют их, проверяя на выработку специфических иммуноглобулинов. Гибридомы из лунок, содержащих нужные идентичные антитела (парапротеины), клонируют и вновь проверяют. Так делают 1-2 раза.
В результате получают клетки, способные производить собственные иммуноглобулины только одной нужной уникальной специфичности. Далее клоны можно заморозить и сохранять. Или же культивировать, накапливать, привить мышам, где они также будут расти. Впоследствии полученные молекулы иммуноглобулина разными методами очищаются от посторонних примесей и используются для диагностики в лабораториях или терапевтического применения.
Важно отметить, что полученный с помощью гибридомы клеточный клон является мышиным иммуноглобулином, который при попадании в организм человека вызовет реакцию отторжения. Выход нашли благодаря рекомбинантным технологиям. Взяв фрагмент мышиного моноклона, соединили его с фрагментом человеческого иммуноглобулина. В результате были получены гибридомы, получившие название химерных, которые были уже более близкими для человека, но все равно провоцировали иммунные реакции организма, отличающиеся от требуемых.
- Как к компьютеру подключить wifi роутер
- Фаршированные перцы в мультиварке: рецепты
- Имплантационное кровотечение
Следующий шаг был сделан благодаря генной инженерии и связан с созданием, так называемых гуманизированных антител, на 90% гомологичных человеческому иммуноглобулину. От первоначального гибридомного мышиного моноклона осталась лишь маленькая часть от слияния клеток, которые отвечают за специфическое связывание. Они и используются в клинических испытаниях.
Применение
Для терапии псориаза тяжелых форм назначают прием системных глюкокортикостероидов (стероидные гормоны), влияющих на гормональный фон человека и подавляющих местный иммунитет. Моноклональные антитела при псориазе воздействуют исключительно на активные клетки псориатического воспаления, не подавляя иммунную систему полностью. Терапевтический эффект – снижение активности воспаления, нормализация деления клеток кожи и исчезновение псориазных бляшек.
Моноклональные антитела при ревматоидном артрите оказались эффективны в тех ситуациях, где другие средства не оказали лечебного действия. В европейских странах сегодня основным терапевтическим направлением при этом недуге являются такие препараты. Терапевтический курс длительный по времени, ведь лекарства действуют хоть и эффективно, но медленно. Из-за сложностей в диагностике артритов за лечебной помощью стоит обращаться как можно раньше, при первых же симптомах и подозрениях.
Для большого числа пациентов с онкологией фармпрепараты, в составе которых содержатся моноклоны, стали надеждой на выздоровление и возврат к нормальной жизни. Многие люди с крупными злокачественными опухолями тела, множеством опухолевых клеток и малоутешительными прогнозами после курса терапии почувствовала улучшение состояния. Моноклональные антитела для лечения рака имеют очевидные преимущества:
- Прикрепляясь к злокачественным клеткам, они не только делают их более заметными, но и ослабляют, нарушают их структуру. С ними человеческому организму бороться гораздо легче.
- Обнаружив свою цель, они способствуют блокировке рецепторов роста опухоли.
- Разработка антитела осуществляется в условиях лабораторий, где они намеренно соединяются с малым количеством радиоактивных частиц. Перенося эти частицы по организму, они доставляют их прямо к опухоли, где те и начинают действовать.
- Идеи для личного дневника своими руками: как красиво оформить
- Как ласково называть девушку: слова для любимой
- Микроблейдинг бровей - что это
Принцип лечения
Действие моноклонов простое: они распознают определенные антигены и связываются с ними. Благодаря этому иммунная система быстро замечает проблему и вступает с ней в борьбу. Они помогают организму человека самостоятельно справиться с антигенами. Еще одно их огромное преимущество – воздействие исключительно на патологически измененные клетки, не нанося при этом вреда здоровым.

Препараты с моноклональными антителами
Хотя изобретены гибриды нормальных и опухолевых клеток такого типа были не очень давно, спектр препаратов, содержащих их в своем составе, уже выглядит внушительно. Новинки фармацевтики появляются регулярно. Такие препараты, как и большинство лекарственных средств, имеют различные побочные эффекты. Нередко после применения моноклональных веществ поступают жалобы на проявление аллергических реакций в виде зуда, сыпи. Изредка терапия сопровождается тошнотой, рвотой или кишечным расстройством. Далее об эффективных препаратах подробнее.
Используется при терапии тяжелых форм бляшечного псориаза. Фармпрепарат состоит из моноклонов человека, что сводит риск возникновения побочных эффектов к минимуму. Форма выпуска – раствор для подкожного введения во флаконе или в шприце. Рекомендованная дозировка составляет 45 мг в сутки. Вторую инъекцию вводят через 4 недели после первой, далее уколы делают 1 раз в 12 недель. Терапевтический эффект от Стелара проявится уже через 15-20 дней. Поддерживающее лечение обеспечивает продолжительность ремиссии. После 2 инъекций кожа очищается на 75%.
Представляет собой химерные антитела на основе моноклонов мыши и человека. Препарат снижает воспаление эпидермиса, регулирует деление кожных клеток. Форма выпуска – порошок лиофилизированный для приготовления парентерального раствора или во флаконах 20 мл. Состав для инфузий вводят внутривенно на протяжении 2-х часов со скоростью до 2 мл в минуту. Дозировка зависит от степени тяжести болезни. Повторные инъекции делают через 2 и 6 недель после первой. Для поддержки эффекта терапию повторяют каждые 1,5-2 месяца.
Рекомбинантный моноклон с пептидной последовательностью, идентичной человеческой. Препарат эффективен при терапии сложных форм псориаза, тяжелом активном ревматоидном и псориатическом артрите. Применяется в виде подкожных инъекций в область живота или переднюю бедренную поверхность. Форма выпуска – раствор для подкожного введения. Уколы по 40 мг вводятся 1 раз в 2 недели.
Составляющие фармпрепарата — моноклоны человека. Применяется при прогрессирующем псориатическом или ревматоидном артрите, анкилозирующем спондилите. Это средство помогает уменьшить симптомы при псориазе ногтей и кожи. Форма выпуска – раствор для подкожных инъекций (шприц или автоинжектор). Симпони требуется вводить подкожно один раз в месяц.
Читайте также:


