Новартис для рассеянного склероза
Безусловно, самые дорогие препараты — те, которые создаются для людей с неизлечимыми или смертельными заболеваниями со сложной морфологией. Например, компания Novartis при описании стоимости своих препаратов делает акцент на их клиническом значении, влиянии на пациентов и систему здравоохранения в целом, а также на существенном улучшении качества жизни.
Симптомы рассеянного склероза существенно варьируются. Некоторые люди с тяжелым течением заболевания могут потерять способность ходить и есть, в то время как другие могут испытывать длительные периоды ремиссии без каких-либо новых симптомов.
Ремиттирующий рассеянный склероз — наиболее распространенное течение заболевания. Он характеризуется четко выраженными приступами новых или нарастающих неврологических симптомов. Эти приступы, также называемые рецидивами или обострениями, сопровождаются периодами частичного или полного выздоровления (ремиссиями). Во время ремиссий, все симптомы могут исчезнуть, или некоторые симптомы могут становиться постоянными. Однако явного прогрессирования заболевания в периоды ремиссии не наблюдается. Приблизительно у 85% людей с РС первоначально диагностируется именно РРС.
Большинство людей с диагнозом РРС в срок от 3–5 лет с появления первых симптомов приходят к вторичному прогрессирующему течению болезни, при котором со временем происходит ухудшение неврологических функций и инвалидизация пациента.
В 2010 году FDA одобрило препарат Gilenya, ставший широко применяемым для лечения РС. Месячный курс данного препарата стоит $2500.
Novartis даже подала иск в прошлом году, пытаясь заблокировать продажи непатентованных версий Gilenya после истечения срока действия основного патента на препарат в августе. Однако пока судебная тяжба ни к чему не привела.
В США около миллиона человек живут с РС, в России — порядка 150 тыс. человек с подтвержденным диагнозом РС, а во всем мире этим недугом страдают 2,3 млн человек. Последним методом лечения РС, одобренным FDA, был окрелизумаб в 2017 году. Это анти-CD20 моноклональное антитело, поражающее зрелые B-лимфоциты, являясь иммуносупрессором. Он вышел на рынок с заявленной стоимостью $65 000 за год лечения.
По сравнению с естественным течением болезни, пациенты, которых лечили препаратом, демонстрировали значительные улучшения моторного развития — дети смогли держать головку и самостоятельно сидеть.
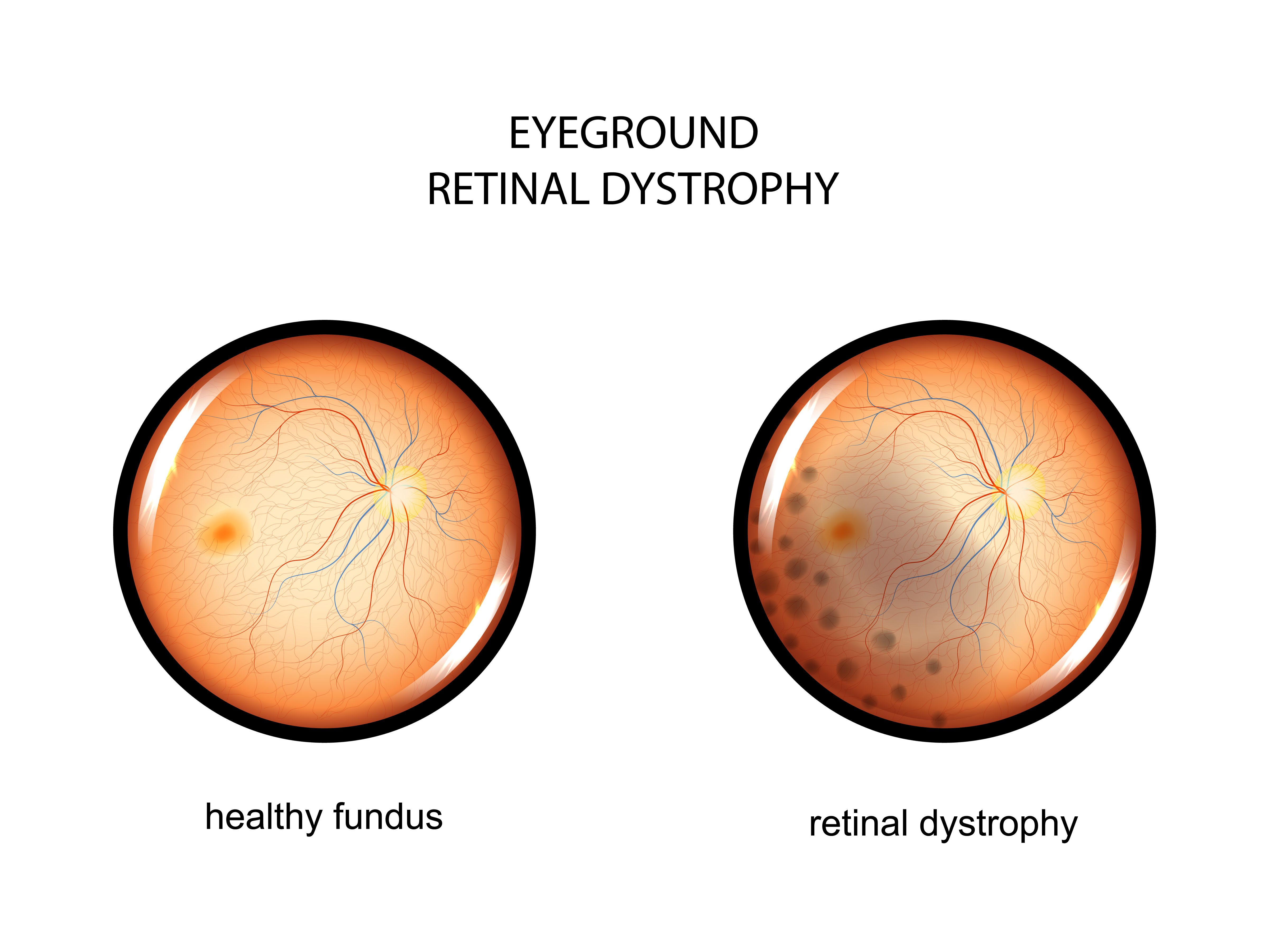
Ген RPE65 кодирует специфичный фермент клеток сетчатки глаза, участвующий в регенерации светочувствительного пигмента, который необходим для палочек и колбочек, чтобы обеспечить человеку нормальное зрение. Мутации в этом гене приводят к снижению или отсутствию уровней активности фермента, блокируя зрительный цикл и приводя к ухудшению зрения. Существует несколько типов наследственных заболеваний сетчатки, связанных с вышеназванным геном. Наиболее распространенными считают врожденный амавроз Лебера и пигментный ретинит. Из-за биаллельных мутаций гена RPE65 (генных мутаций обоих родителей) страдающие этими заболеваниями часто сталкиваются с никталопией (ночной слепотой) из-за снижения светочувствительности в детском или раннем взрослом возрасте и нистагмом (непроизвольными движениями зрачков). По мере прогрессирования заболевания происходят потеря периферического зрения, развитие туннельного зрения и, в конечном итоге, потеря центрального зрения, что означает полную слепоту.
Ретинальная дистрофия или наследственные дегенеративные заболевания сетчатки — это целый ряд болезней, которые отличаются по своей патологии, симптомам, а также последствиями. Очень трудно предсказать, насколько сильно ухудшится зрение, и как быстро будет прогрессировать заболевание, но во многих случаях люди с наследственной дистрофией сетчатки могут полностью потерять свое зрение.
Врожденный амавроз Лебера (ВАЛ) — редкое наследственное заболевание, которое приводит к нарушению деятельности сетчатки глаза и ухудшению зрения в раннем детстве, часто прямо с рождения. Из всех заболеваний, связанных с дегенерацией сетчатки, ВАЛ начинается раньше всего и может иметь наиболее тяжкие последствия. Уровень потери зрения при ВАЛ различается от случая к случаю, но остается стабильным в 75% случаев. У примерно 15% детей отмечается прогрессирующая потеря зрения, а у 10% может отмечаться некоторое незначительное, часто временное, улучшение.
Но FDA уже одобрило его для лечения двух редких заболеваний — хронического гранулематозного заболевания и тяжелого злокачественного остеопороза.
Хроническое гранулематозное заболевание — наследственное заболевание, при котором иммунная система отсутствует или не функционирует должным образом.
Синдром Хантера представляет собой рецессивное наследственное заболевание, вызванное недостаточным уровнем в организме лизосомального фермента. Проще говоря, необходимый для правильного углеводного обмена фермент не вырабатывается в нужных количествах и полисахариды (естественные сахара) неправильно усваиваются. В связи с отсутствием или наличием дефектного фермента у пациентов с синдромом Хантера полисахариды накапливаются в лизосомах клеток, приводя к клеточному перенасыщению, органомегалии, разрушению тканей и нарушению функций внутренних органов. Частота заболевания в мире составляет один человек на 100 тысяч. В России зарегистрировано около 150 пациентов.
Наследственный ангионевротический отек (HAE) — очень редкое и потенциально смертельное заболевание, которое встречается примерно у одного из 10 тыс. человек в мире. Главный симптом HAE — отеки в различных частях тела. У пациентов часто бывают приступы мучительной боли в животе, тошнота и рвота, вызванные отеком кишечной стенки. Отек дыхательных путей особенно опасен и может привести к смерти от удушья.
У пациентов с НАЭ имеется дефект в гене, который контролирует белок крови, называемый ингибитором С1. Генетический дефект приводит к выработке либо неадекватного, либо нефункционального белка C1-Inhibitor. Нормальный C1-Inhibitor помогает регулировать сложные биохимические взаимодействия систем на основе крови, участвующих в борьбе с болезнями, воспалительной реакцией и коагуляцией. Поскольку дефектный C1-Inhibitor не выполняет надлежащим образом свою регуляторную функцию, может возникнуть биохимический дисбаланс и продуцировать нежелательные пептиды. Они побуждают капилляры высвобождать жидкость в окружающую ткань, вызывая тем самым отек.
Стоимость жизненно важных препаратов зависит от множества исходных данных, но и их польза неоспорима. Обеспечить идентичную замену дефектным клеткам или способствовать выработке нужных для больного ферментов, зачастую могут только сложные разработки, в которых задействованы большое количество специалистов. В России, к большому сожалению, еще не все эти лекарства одобрены или выдаются по квоте всем нуждающимся. Но однажды мы к этому придем.

При ASCLEPIOS I и II офатумумаб (OMB157) достигал первичных конечных точек, чтобы снизить годовую частоту рецидивов по сравнению с Aubagio ® * (терифлуномидом) у пациентов с рецидивирующими формами РС.
- Ключевые вторичные конечные точки задержки времени для подтверждения прогрессирования инвалидности также были достигнуты; дополнительные вторичные конечные точки будут представлены на ECTRIMS
- Ofatumumab, мощное, полностью человеческое антитело, нацеленное на CD20-позитивные B-клетки, обеспечивает устойчивую эффективность с благоприятным профилем безопасности
- Novartis планирует начать подачу документов в органы здравоохранения к концу 2019 года. В случае одобрения офатумумаб потенциально станет лечением для широкой популяции RMS и первой B-клеточной терапией, которую можно будет проводить самостоятельно в домашних условиях.
Базель, 30 августа 2019 г. – Novartis, мировой лидер в области неврологии, сегодня объявил о положительных результатах применения офатумамаба (OMB157) в исследованиях III фазы ASCLEPIOS I и II. В обоих непосредственных исследованиях офатумумаб продемонстрировал превосходство над Aubagio ® * (терифлуномидом) у пациентов с рецидивирующими формами рассеянного склероза (RMS) [1]. В исследованиях ASCLEPIOS была изучена эффективность и безопасность ежемесячного подкожного введения 20 мг офатумумаб по сравнению с однократным ежедневным пероральным приемом Абаджио ® 14 мг у взрослых с RMS [2], [3].
Оба исследования соответствовали первичным конечным точкам, в которых офатумумаб показал очень значительное и клинически значимое снижение числа подтвержденных рецидивов, оцениваемых как годовой уровень рецидивов (ARR) [1]. Ключевые вторичные конечные точки задержки времени для подтверждения прогрессирования инвалидности также были выполнены [1]. Основные результаты исследований ASCLEPIOS Фазы III будут представлены на 35- м заседании. Конгресс Европейского комитета по лечению и исследованиям рассеянного склероза (ECTRIMS), проходящий 11–13 сентября 2019 г. в Стокгольме, Швеция. В целом офатумаб, сильное человеческое антитело, нацеленное на CD20-позитивные В-клетки, обеспечивало устойчивую эффективность с благоприятным профилем безопасности [1]. Профиль безопасности офатумумаба, как видно из исследований ASCLEPIOS, согласуется с результатами наблюдений, полученными на этапе II [1], [4]. Novartis планирует начать подачу документов в органы здравоохранения к концу 2019 года.
Об ASCLEPIOS
Исследования ASCLEPIOS I и II (NCT02792218 и NCT02792231) являются двойными, идентичного дизайна, гибкой продолжительностью (до 30 месяцев), двойными слепыми, рандомизированными, многоцентровыми исследованиями фазы III, оценивающими безопасность и эффективность ежемесячного подкожного введения офатумумаб по 20 мг. инъекции по сравнению с пероральными таблетками Aubagio ® по 14 мг, принимаемыми один раз в день у взрослых с подтвержденным диагнозом RMS [2], [3]. В исследованиях приняли участие 1882 пациента с РС в возрасте от 18 до 55 лет с расширенной шкалой статуса инвалидности (EDSS) от 0 до 5,5 [2], [3]. Исследования проводились на более чем 350 участках в 37 странах.
Первичной конечной точкой обоих исследований было продемонстрировать, что офатумумаб превосходит Абаджио ® в снижении частоты подтвержденных рецидивов по оценке ARR у пациентов, получавших лечение до 30 месяцев [2], [3]. Вторичные конечные точки включали время до прогрессирования инвалидности, подтвержденное через три и шесть месяцев, соответственно, подтвержденное улучшение инвалидности через 6 месяцев, гадолиний-увеличивающие поражения T1, количество новых или увеличивающихся поражений T2, сывороточные уровни легкой цепи нейрофиламента (NfL) и скорость объема мозга потеря [2], [3]. Безопасность и фармакокинетические свойства офатумумаба также измерялись на протяжении всего периода лечения [2], [3].
Офатумумаб (OMB157) – это полностью человеческое моноклональное антитело против CD20 (mAb), которое вводится один раз в месяц подкожной инъекцией, которая находится в стадии разработки для РС. Офатумумаб работает, связываясь с молекулой CD20 на поверхности B-клеток и вызывая мощный лизис и истощение B-клеток. Положительные результаты фазы IIb у пациентов с РС были представлены в 2014 году и показали заметное значительное уменьшение числа новых поражений головного мозга в первые 24 недели после введения офатумумаба [4]. Novartis инициировала программу фазы III для офатумумаба в RMS в августе 2016 года. Novartis получила права на офатумумаб от Genmab по всем показаниям, включая РС, в декабре 2015 года.
В настоящее время на различных стадиях клинических исследований находятся десятки новых методов лечения рассеянного склероза. Российские Центры включены во многие международные исследовательские программы, позволяющие пациентам получать терапию самыми новыми и перспективными препаратами. В то же время, информация о проводимых в Российской Федерации исследованиях не всегда доступна и понятна для пациентов, не являющихся врачами-специалистами.
Задачей данного раздела является наиболее полное информирование Российских пациентов об исследованиях, проводимых в Российской Федерации, сроках проведения, особенностях протокола и требованиях к пациентам.
Обращаем Ваше внимание, что при возникновении конкретных вопросов, Вы можете обращаться к более подробному описанию новых методов лечения или к нашим специалистам.
Список исследований
- Оценка эффективности, безопасности и переносимости препарата ЕК-12 по сравнению с интерфероном-бета-1а (Ребиф) у пациентов с ремиттирующим РС.
- Исследование фармакокинетических, фармакодинамических свойств, безопасности и иммуногенности препарата BCD-132 у пациентов с ремиттирующим РС.
- Оценка эффективности и безопасности препарата Фампридин у пациентов с РС.
- Оценка эффективности, безопасности и переносимости препарата Ублитуксимаб (TG-1101; UTX) по сравнению с Терифлюномидом у пациентов с рецидивирующим РС.
- Сравнение эффективности и безопасности офатумумаба с терифлуномидом у пациентов с рецидивирующими формами рассеянного склероза.
- Сравнение эффективности и безопасности понесимода и терифлюномида при лечении пациентов с РС
- Оценка эффективности препарата RPC1063 по сравнению с интерфероном-бета-1а (Авонекс) при лечении пациентов с рецидивирующим РС
- Оценка эффективности и безопасности препарата Cипонимод (BAF312) у пациентов с вторично-прогрессирующим РС
- Оценка эффективности и безопасности препарата FTY720 у пациентов с РС
- Оценка эффективности, переносимости и безопасности препарата ACT-128800 у пациентов с РС

Многоцентровое, международное, рандомизированное, с заслепленным оценщиком, в параллельных группах исследование по оценке эффективности, безопасности и переносимости комбинации нейропептидов метэнкефалина и тридекактида в сравнении с интерфероном бета-1а (РЕБИФ) у пациентов с ремиттирующим рассеянным склерозом.
Фаза исследования: III
Код исследования: RAP-CS-01
Спонсор: "АО Босналек"
Исследуемый препарат: Энкортен (EK-12, метэнкефалина ацетат + тридекактида ацетат)
Задача исследования: Оценить эффективность, безопасность и переносимость препарата ЕК-12 по сравнению с интерфероном бета-1а (РЕБИФ) у пациентов с ремиттирующим рассеянным склерозом.
Продолжительность исследования: 31 месяц
Начало исследования: 2018г,
Окончание исследования: 2021г.
Страны, в которых проходит исследование: Россия.
Число пациентов: 120
Набор пациентов открыт.
Статус: Исследование продолжается.
Основные критерии включения:
• Возраст: 18 - 55 лет
• Тяжесть заболевания по шкале EDSS от 0 до 4,5 баллов
• Отсутствие тяжелых сопутствующих заболеваний
Многоцентровое открытое несравнительное исследование фармакодинамики, фармакокинетики, безопасности и иммуногенности препарата BCD-132 в возрастающих дозах у пациентов с ремиттирующим рассеянным склерозом.
Фаза исследования: I
Код исследования: BCD-132-1
Исследуемый препарат: BCD-132
Задача исследования: Определить основные показатели фармакодинамики, фармакокинетики и иммуногенность исследуемого препарата, а также оценить эффективность, безопасность и переносимость препарата BCD-132 у пациентов с ремиттирующим рассеянным склерозом.
Продолжительность исследования: 6 месяцев
Начало исследования: февраль, 2018г,
Окончание исследования: февраль, 2019г.
Страны, в которых проходит исследование: Россия
Число пациентов: 40
Набор пациентов закрыт.
Статус: Исследование продолжается.
Основные критерии включения:
• Возраст: 18 - 60 лет
• Тяжесть заболевания по шкале EDSS от 0 до 5,5 баллов
• Наличие антител класса IgG к вирусу Varicella-Zoster
• Отсутствие тяжелых сопутствующих заболеваний
Двойное слепое рандомизированное плацебо-контролируемое многоцентровое исследование по оценке клинической эффективности и безопасности препарата Фампридин, таблетки пролонгированного действия, покрытые пленочной оболочкой, 10 мг в качестве препарата симптоматической терапии у пациентов с рассеянным склерозом.
Фаза исследования: III
Код исследования: №ФМП-03-01-2016 № ФМП-03-01-2016
Спонсор: ПАО "Валента Фармацевтика"
Исследуемый препарат: Фампридин
Задача исследования: Оценить эффективность и безопасность препарата Фампридин (таблетки пролонгированного действия) у пациентов с рассеянным склерозом.
Продолжительность исследования: 39 месяцев
Начало исследования: май, 2016г,
Окончание исследования: декабрь, 2019г.
Страны, в которых проходит исследование: Россия.
Число пациентов: 138
Набор пациентов закрыт.
Статус: Исследование продолжается.
Основные критерии включения:
• Возраст: 18 - 60 лет
• Тяжесть заболевания по шкале EDSS от 4 до 6,0 баллов
• Отсутствие тяжелых сопутствующих заболеваний
Рандомизированное, многоцентровое, двойное слепое, активно-контролируемое исследование для оценки эффективности, безопасности и переносимости препарата Ублитуксимаб (TG-1101; UTX) по сравнению с Терифлюномидом у пациентов с рецидивирующим рассеянным склерозом.
Фаза исследования: III
Код исследования: TG1101-RMS301
Спонсор: TG Therapeutics, Inc.
Исследуемый препарат: Ублитуксимаб
Задача исследования: Оценить эффективность, безопасность и переносимость препарата Ублитуксимаб у пациентов с рецидивирующим рассеянным склерозом.
Продолжительность исследования: 2 года
Начало исследования: февраль, 2018г,
Окончание исследования: сентябрь, 2021г.
Страны, в которых проходит исследование: Россия, США
Число пациентов: 440
Набор пациентов закрыт.
Статус: Исследование продолжается.
Основные критерии включения:
• Возраст: 18 - 55 лет
• Тяжесть заболевания по шкале EDSS от 0 до 5,5 баллов
• Отсутствие тяжелых сопутствующих заболеваний
РАНДОМИЗИРОВАННОЕ, ДВОЙНОЕ СЛЕПОЕ, С ДВОЙНОЙ МАСКИРОВКОЙ, ПРОВОДИМОЕ В ПАРАЛЛЕЛЬНЫХ ГРУППАХ ИССЛЕДОВАНИЕ С ЦЕЛЬЮ СРАВНЕНИЯ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ОФАТУМУМАБА С ТЕРИФЛУНОМИДОМ У ПАЦИЕНТОВ С РЕЦИДИВИРУЮЩИМИ ФОРМАМИ РАССЕЯННОГО СКЛЕРОЗА.
Фаза исследования: III
Код исследования: COMB157G2302
Спонсор: "Novartis Pharmaceuticals"
Исследуемый препарат: Офатумумаб (ОМВ157)
Задача исследования: Продемонстрировать более высокую эффективность офатумумаба в сравнении c терифлуномидом в отношении снижения числа обострений у пациентов с рецидивирующим РС.
Продолжительность исследования: 30 месяцев.
Начало исследования: август, 2016г,
Окончание исследования: июнь, 2019г.
Страны, в которых проходит исследование: Россия, США.
Статус: Исследование продолжается.
Набор пациентов закрыт.
Основные критерии включения:
• Возраст: от 18 до 55 лет
• Тяжесть заболевания по шкале EDSS от 0 до 5,5 баллов
• Отсутствие тяжелых сопутствующих заболеваний
Многоцентровое рандомизированное, двойное слепое исследование с применением препарата сравнения, проводимое в параллельных группах больных рецидивирующим рассеянным склерозом с целью подтверждения превосходства понесимода над терифлуномидом по результатам сравнения эффективности и безопасности этих препаратов.
Фаза исследования: III
Код исследования: АС-058B301
Спонсор: "Actelion"
Исследуемый препарат: понесимод или терифлуномид
Задача исследования: Подтверждение более высокой эффективности понесимода в сравнении c терифлуномидом в отношении снижения числа обострений у пациентов с рецидивирующим РС.
Продолжительность исследования: 108 недель.
Начало исследования: апрель, 2015г,
Окончание исследования: май, 2018г.
Страны, в которых проходит исследование: Аргентина, Белоруссия, Босния и Герцеговина, Болгария, Великобритания, Венгрия, Германия, Греция, Грузия, Израиль, Испания, Италия, Канада, Латвия, Литва, Мексика, Польша, Португалия, Россия, Румыния, Сербия, США, Турция, Украина, Финляндия, Франция, Хорватия, Чехия, Швеция.
Города России, в которых проходит исследование: Архангельск, Барнаул, Белгород, Брянск, Великий Новгород, Волгоград, Красноярск, Казань, Кемерово, Курск, Москва, Нижний Новгород, Новосибирск, Пенза, Пермь, Пятигорск, Ростов-на-Дону, Санкт-Петербург, Смоленск, Тверь, Ярославль.
Статус: Исследование продолжается.
Набор пациентов закрыт.
Основные критерии включения:
• Возраст: от 18 до 55 лет
• Тяжесть заболевания по шкале EDSS от 0 до 5,5 баллов
• Наличие антител к вирусу varicella-zoster
• Отсутствие тяжелых сопутствующих заболеваний
Многоцентровое, двойное слепое, рандомизированное исследование III фазы с применением лекарственного препарата сравнения и двух плацебо, проводимое в параллельных группах пациентов, страдающих рецидивирующим рассеянным склерозом, с целью оценки эффективности и безопасности перапарата RPC1063, принимаемого перорально.
Фаза исследования: III
Код исследования: RPC01-301
Спонсор: "Рецептос Инкорпорейтед"
Исследуемый препарат: RPC1063
Задача исследования: Оценить клиническую эффективность препарата RPC1063 по сравнению с интерфероном-бета-1а (Авонекс) с точки зрения снижения частоты рецидивов у пациентов с рецидивирующим рассеянным склерозом.
Продолжительность исследования: 30 месяцев.
Начало исследования: ноябрь, 2014г,
Окончание исследования: ноябрь, 2017г.
Страны, в которых проходит исследование: Беларусия, Бельгия, Болгария, Босния и Герцеговина, Венгрия, Греция, Грузия, Испания, Италия, Канада, Молдавия, Польша, Россия, Румыния, Сербия, Словакия, США, Украина, Хорватия, Южная Африка
Статус: Исследование продолжается.
Набор пациентов закрыт.
Основные критерии включения:
• Возраст: от 18 до 55лет
• Тяжесть заболевания по шкале EDSS от 0 до 5,0 баллов
• Отсутствие тяжелых сопутствующих заболеваний
Краткое описание исследования.
Селективный блокатор сфингозиновых рецепторов RPC1063 относится к одному из наиболее перспективных и быстроразвивающихся направлений в лечении рассеянного склероза и других аутоиммунных заболеваний. Основным механизмом действия препарата является блокирование определенного рецептора в лимфатических узлах, что приводит к невозможности выхода из них аутоагрессивных лимфоцитов в кровь и, соответственно, остановке аутоиммунного процесса.
Первым препаратом из группы блокаторов сфингозиновых рецепторов является Гилениа (финголимод), которая была разрешена к применению в сентябре 2010 года. С этого момента препарат получали более 117 тысяч пациентов во всем мире. Гилениа продемонстрировала высокую эффективность в сочетании с безопасностью и удобством применения (1 капсула в день). Вместе с тем, Гилениа блокирует сфингозиновые рецепторы не избирательно, что может приводить к развитию побочных эффектов со стороны сердечно сосудистой и дыхательной систем, глаз, снижению иммунитета. Новые селективные препараты (в том числе RPC1063) лишены данных недостатков.
Дополнительные вопросы по участию в клиническом исследовании RPC01-301 можно задать Никифоровой Ирине Григорьевне
Многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое, проводимое в параллельных группах, с различной продолжительностью лечения исследование по оценке эффективности и безопасности препарата Сипонимод (BAF312) у пациентов с вторично-прогрессирующим рассеянным склерозом.
Фаза исследования: III
Код исследования: CBAF312A2304
Спонсор: Novartis
Исследуемый препарат: Сипонимод (BAF312)
Задача исследования: Оценить эффективность, безопасность и переносимость препарата BAF312 (по сравнению с плацебо) у пациентов с вторично-прогрессирущим рассеянным склерозом.
Продолжительность исследования: 23-42 месяца, максимальная продолжительность - 60 месяцев.
Начало исследования: февраль, 2013г,
Окончание исследования: сентябрь, 2016г.
Страны, в которых проходит исследование: Аргентина, Австралия, Австрия, Бельгия, Болгария, Великобритания, Венгрия, Германия, Греция, Египет, Ирландия, Израиль, Испания, Италия, Канада, Латвия, Литва, Нидерланды, Польша, Португалия, Румыния, Россия, Словакия, США, Чехия, Швеция, Швейцария, Турция.
Число пациентов: 1530
Статус: Исследование продолжается.
Набор пациентов закрыт.
Основные критерии включения:
• Возраст: 18 - 60 лет
• Тяжесть заболевания по шкале EDSS от 3,0 до 6,5 баллов
• Отсутствие тяжелых сопутствующих заболеваний
Исследование, являющееся продолжением многоцентрового 24-месячного двойного слепого, рандомизированного, плацебо-контролируемого, проводимого в параллельных группах исследования с целью сравнения эффективности и безопасности препарата FTY720, применяемого внутрь в дозах 1,25 мг и 0,5 мг один раз в сутки, и плацебо у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом.
Фаза исследования: III
Код исследования: CFTY720D2301E1
Спонсор: Novartis
Исследуемые препараты: Финголимод (Производитель: Новартис Фарма АГ)
Задача исследования: Оценить эффективность и безопасность препарата FTY720 по сравнению с плацебо у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом.
Продолжительность исследования: 2 года
Начало исследования: февраль, 2008г,
Окончание исследования: август, 2011г.
Страны, в которых проходит исследование: Австралия, Бельгия, Великобритания, Германия, Греция, Израиль, Канада, Литва, Нидерланды, Польша, Россия, Словакия, Турция, Финляндия, Франция, Чехия, Швеция, Швейцария, ЮАР.
Число пациентов: 1250
Статус: Исследование продолжается.
Набор пациентов закрыт.
Основные критерии включения:
• Возраст: 18 – 58 лет
• Пациенты, успешно завершившие двойное слепое плацебо-контролируемое исследование CFTY720D2301
Многоцентровое, рандомизированное двойное слепое плацебо-контролируемое в параллельных группах дозозависимое исследование эффективности, безопасности и переносимости трех различных доз перорального препарата ACT-128800, применяемого в течение 24 недель, у больных с ремиттирующим рассеянным склерозом.
Фаза исследования: II
Код исследования: AC-058B201
Спонсор: Actelion Pharmaceuticals
Исследуемый препарат: ACT-128800
Задача исследования: Оценить эффективность, переносимость и безопасность ACT-128800 по сравнению с плацебо у пациентов с ремиттирующим рассеянным склерозом.
Продолжительность исследования: 24 недели
Начало исследования: октябрь, 2009г,
Окончание исследования: март, 2011г.
Страны, в которых проходит исследование: Болгария, Великобритания, Венгрия, Германия, Израиль, Италия, Польша, Россия, Румыния, Сербия, США, Финляндия, Чехия, Швеция, Швейцария.
Число пациентов: 400
Статус: Исследование продолжается.
Набор пациентов закрыт.
Основные критерии включения:
• Возраст: 18 - 55 лет
• Тяжесть заболевания по шкале EDSS от 0 до 5,5 баллов
• Отсутствие тяжелых сопутствующих заболеваний

- статья

Минздрав Украины планирует закупить ремдесивир для лечения больных COVID-19

Глава Нацбанка Яков Смолий подал в отставку: какими будут последствия для бизнеса?

США выкупили почти весь ремдесивир на три месяца вперед

Минздрав добавил дексаметазон в национальный протокол лечения COVID-19

ВОЗ вновь остановила клинисследования гидроксихлорохина при COVID-19
Novartis — транснациональная фармацевтическая корпорация, состоящая на сегодняшний день из шести бизнес-дивизионов: Pharma (инновационные рецептурные препараты), Alcon (весь спектр продукции для охраны зрения), Sandoz (высококачественные дженерики и биосимиляры), OTC (безрецептурные средства), Vaccines and Diagnostics (вакцины и тест-системы), Animal Health (препараты для животных).
Основными направлениями научно - исследовательских разработок компании Novartis (Новартис) являются онкология, сердечно - сосудистые заболевания, офтальмология, неврология, билогические препараты.
Также компании развивает инновационные направления, такие ка имуноонкология, профилактика старения, регенеративная медицина и инфекционные заболевания.
Штаб-квартира находится в г. Базель, Швейцария. В компании работает около 120 000 сотрудников в более чем 140 странах мира.
Представительство компании "Novartis" в Украине было открыто в 1993 году.

Как заявили в Novartis, до 80% пациентов с рецидивирующим ремиттирующим рассеянным склерозом, наиболее распространенной формой РС, перейдут в более тяжелую стадию заболевания – вторично-прогрессирующего РС, которая характеризуется значительным ухудшением симптомов и инвалидностью.
Сипонимод, модулятор рецептора сигнальной молекулы сфингозин-1-фосфата, является первым подобным одобренным лекарственным средством для лечения вторичного прогрессирующего рассеянного склероза. Посредством воздействия на рецепторы сфингозин-1‑фосфата средство снижает численность Т-лимфоцитов, атакующих центральную нервную систему. Предварительные исследования молекулы продемонстрировали ее способность предотвращать нейродегенерацию при РС.
Таким образом Mayzent открывает для Novartis перспективную нишу в сегменте РС, где некоторые из блокбастеров в ближайшие несколько лет вылетят из топа в результате потери патентной защиты.
Однако есть один момент, который может негативно повлиять на продажи Mayzent: медицинские ограничения. На самом деле, сегодня достаточно трудно определить, когда пациент перешел от рецидивирующей ремиттирующей формы РС к вторично-прогрессирующему РС – таким образом им не меняют схему терапии.
Читайте также:


