Баринов а н невропатическая боль клинические рекомендации и алгоритмы
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В статье приведены алгоритмы диагностики и лечения невропатической боли при поражении периферической нервной системы
Для цитирования. Баринов А.Н., Ахмеджанова Л.Т., Махинов К.А. Алгоритмы диагностики и лечения невропатической боли при поражении периферической нервной системы // РМЖ. 2016. № 3. С. 154–162.
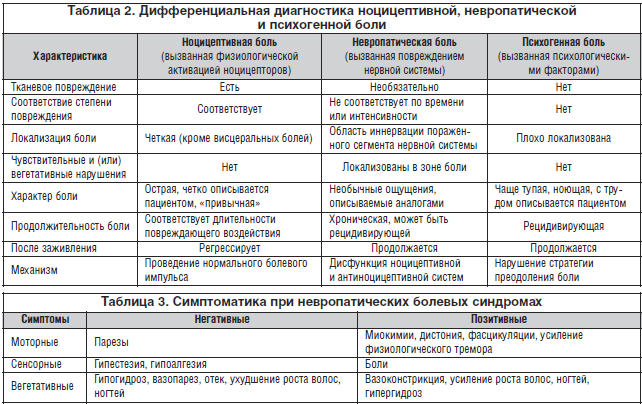
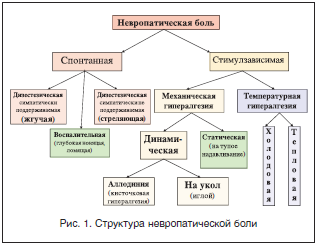
Сенсорная позитивная симптоматика подразделяется на неболевую и болевую. К первой относятся: онемение, стягивание, зябкость, зуд, парестезии. Болевая позитивная симптоматика, или собственно невропатическая боль, представлена 2 основными компонентами: спонтанной (стимул-независимой) болью и вызванной (стимул-зависимой) гипералгезией (рис. 1).
Аллодиния – возникновение болевого ощущения при воздействии неболевых раздражителей различной модальности (тактильных или температурных).
Гиперпатия – выраженная реакция на болевые воздействия с сохранением ощущения боли после прекращения болевой стимуляции.
Болевая анестезия – ощущение боли в зонах, лишенных болевой чувствительности.
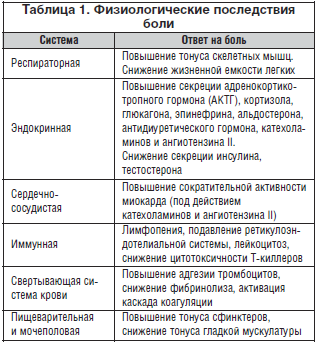
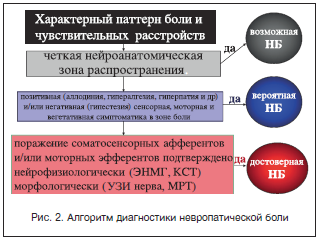
Причинами развития невропатического болевого синдрома могут быть различные этиологические факторы, приводящие к поражению чувствительных афферентов ЦНС и ПНС. Выделяют центральный и периферический уровни поражения нервной системы, приводящие к возникновению невропатической боли (табл. 4). Однако не каждое поражение ПНС или ЦНС приводит к формированию невропатических болевых синдромов, а лишь те, которые сопровождаются аномальной нейрональной пластичностью, приводящей к гипервозбудимости воспринимающих боль ноцицептивных структур и подавлению активности антиноцицептивных систем. В настоящее время накапливается все больше свидетельств того, что в основе этих процессов лежит индивидуальная генетически обусловленная предрасположенность [1, 6, 8].


3. Наркотические анальгетики (фентанил, бупренорфин) и синтетические опиоиды (трамадол, буторфанол) блокируют проведение боли на уровне задних рогов спинного мозга, воздействуя через сегментарные и нисходящие ингибиторные нейроны желатинозной субстанции, а также подавляя высвобождение альгогенного нейромедиатора – субстанции Р. Целесообразность использования наркотических анальгетиков для лечения невропатической боли продолжает оставаться дискуссионной – анальгетическая эффективность этих препаратов существенно выше при ноцицептивной боли, а выраженные побочные эффекты (когнитивные нарушения, атаксия, нарушение перистальтики ЖКТ, зуд, усугубление сонных апноэ за счет угнетения дыхательного и сосудодвигательного центра и т. д.) и развитие лекарственной зависимости ограничивают их применение в лечении невропатических болевых синдромов. Возможно применение трансдермальных систем с медленным высвобождением наркотических анальгетиков для паллиативного лечения паранеопластических болевых синдромов в тех случаях, когда все остальные возможности неинвазивных и интервенционных методов аналгезии исчерпаны.
4. Местные анестетики. Трансдермальные системы анестезии (пластыри и гели с 2,5- и 5-процентным содержанием лидокаина), как и антиконвульсанты, оказывают анальгетическое воздействие за счет блокады натриевых каналов, но уже на уровне периферических ноцицепторов. Препараты наносят местно на кожу в области боли и гипералгезии. Данный вид аналгезии у пожилых больных наиболее безопасен. Из острых побочных эффектов помимо аллергических реакций может наблюдаться раздражение кожи в области нанесения; чаще оно незначительное и быстро проходит. Если площадь зоны невропатической боли не очень большая и находится в доступном для использования анестетика месте, применение лидокаина в большинстве случаев помогает купировать боль при периферических невропатиях – таких, как диабетическая полиневропатия, опоясывающий герпес, постмастэктомические боли, комплексный регионарный болевой синдром. Продолжительность действия трансдермальных систем с лидокаином составляет около 12 ч, что приводит к высокой стоимости лечения хронических болевых синдромов.
5. Агонисты ваниллоидных рецепторов подавляют активность периферических ноцицепторов за счет селективной стимуляции тонких немиелинизированных С-волокон периферических нервов, вызывающей высвобождение в концевых терминалях субстанции Р и других алгогенных нейротрансмиттеров. Последовательное истощение запасов субстанции Р приводит к уменьшению болевой афферентации в ЦНС и десенситизации ваниллоидных рецепторов. Однократное местное применение 8% капсаицина в виде трансдермальной системы (Кутенза) на 1 ч эффективно на срок до 3 мес. в лечении локализованной невропатической боли, например, при постгерпетической невралгии, не вызывает при этом выраженных системных побочных эффектов. Усиление болевого синдрома во время аппликации (60 мин на туловище, 30 мин на стопах) трансдермальной системы с капсаицином предотвращается нанесением крема, содержащего местный анестетик (эмла) на участок кожи за 1 ч до аппликации трансдермальной системы с капсаицином, а возникающее ближе к концу аппликации жжение можно купировать приложением контейнера со льдом.
6. Интервенционные методы лечения боли включают в себя эпидуральные и периневральные инфильтрации (блокады) периферических нервов и сплетений растворами местных анестетиков и глюкокортикоидов. В случаях частых рецидивов болевого синдрома на фоне успешного купирования невропатического болевого синдрома местными анестетиками может применяться высокочастотная денервация сенсорных нервов. Как альтернативная схема, например, при постгерпетической невралгии, может использоваться ботулинотерапия. Оперативное нейрохирургическое лечение назначается больным с моторными формами радикулопатий и тоннельных синдромов, а также при безуспешности консервативных методов лечения боли.
Клинические особенности (фенотип) поражения ПНС, вызвавшего невропатическую боль, определяют эффективность симптоматической терапии (рис. 3). Так, невропатическая боль при распространенных поражениях ПНС (полиневропатии, множественные мононевропатии и плексопатии) чаще уменьшается при применении антидепрессантов, если у больного преобладает аллодиния, а антиконвульсанты – блокаторы кальциевых каналов (габапентиноиды) более эффективны в случае преобладания спонтанной жгучей, стреляющей боли. У пациентов с локальным поражением (радикулопатии, мононевропатии) более эффективными оказываются интервенционные методы лечения боли, а также блокаторы натриевых каналов – лечение тригеминальной, языкоглоточной и прочих невралгий рекомендуется начинать с карбамазепина или окскарбазепина.

Наличие локализованной невропатической боли, например, при постгерпетической невралгии (кроме лица) или ВИЧ-индуцированной полиневропатии является основанием для применения локальных аппликаций трансдермальных систем с капсаицином, при этом системная терапия невропатической боли отменяться не должна (по крайней мере в течение 1-й нед. после аппликации). Назначение комбинации из 2 и более симптоматических препаратов, по-разному воздействующих на механизмы формирования невропатической боли, целесообразно только при резистентных к монотерапии невропатических болевых синдромах [1, 5, 6] ввиду возможности усугубления побочных явлений у пожилых и соматически отягощенных больных.
Применение симптоматической анальгетической терапии у пожилых больных имеет ряд особенностей [1, 3]:
• Путь введения препарата должен быть наименее инвазивным: парентеральные пути введения не дают преимуществ по безопасности со стороны желудочно-кишечного тракта, зато чреваты инфекционными осложнениями (абсцессами, флебитами) в местах введения.
• Предпочтительно применение анальгетиков с быстрым наступлением эффекта и коротким периодом полувыведения для предотвращения кумуляции препарата.
• Лечение необходимо начинать с минимальных доз препарата, постепенно увеличивая дозу, следует избегать высоких доз НПВП и их длительного применения; комбинировать между собой средства для симптоматической терапии боли целесообразно лишь при резистентности болевого синдрома к монотерапии.
• При необходимости длительного применения антиконвульсантов, антидепрессантов и НПВП рекомендуется периодически мониторировать побочные эффекты (желудочно-кишечные кровотечения, функцию печени и почек, артериальную гипертензию и гипергликемию).

Общие сведения
Ортопедическая патология стоп в условиях индустриального общества имеет тенденцию к увеличению, о чем свидетельствует частота обращений больных. Это обусловлено резко увеличившейся нагрузкой на стопу, являющуюся сложным анатомическим образованием, включающим 26 костей, 33 сустава, 19 мышц, 107 связок и сосудисто-нервный аппарат, объединённых с голеностопным суставом в единую систему, что позволяет эффективно обеспечивать локомоторную, рессорную и балансировочную функции в процессе ходьбы, бега и прыжков.
Одной из частых причин нарушения функции стопы является болезнь Мортона (синонимы — неврома Мортона, метатарзалгия Мортона, синдром Мортона, межпальцевая неврома, периневральный фиброз, неврома стопы, синдром мортоновского пальца). Межпальцевая неврома представляет собой локальное ограниченное утолщение (образование) оболочки подошвенного нерва вытянутой, веретенообразной формы на уровне прохождения нерва между головками плюсневых костей. Средний размер невромы составляет 0,95–1,40 см в длину и 0,15–0,55 см в ширину. Считается, что заболевание манифестирует при локальном утолщении нерва от 5 мм в диаметре. По сути, неврома Мортона является одним из проявлений туннельного синдрома на стопе, то есть, является туннельной (компрессионной) нейропатией межпальцевого нерва стопы.
Патогенез
В основе патогенеза болезни Мортона лежит повторяющееся/постоянное механическое давление межплюсневой поперечной связки на анастомоз медиального/латерального плантарного нервов (ветви большеберцового нерва) во втором/третьем, реже четвертом межплюсневом промежутке (пространстве). Сдавливание поперечной межплюсневой связки механическим путем постепенно травмирует анастомоз плантарных нервов, что приводит первоначально к сдавлению стволов нервов, а позже — к реактивному перерождению нервных волокон с постепенным формированием спиралей Перрикончито и колб роста, а также к периневральному разрастанию соединительной ткани. Именно постоянная травматизация приводит к формированию воспалительных инфильтратов и сращению эпиневральной соединительной ткани с прилежащей костью/окружающими мышцами.
Классификация
Как таковая классификация отсутствует. Различают лишь односторонние и двусторонние невромы.
Причины
Болезнь Мортона относится к полиэтиологическим заболеваниям, в формировании которых важную роль играют как генетическая предрасположенность, так и воздействие различных экзогенных/эндогенных факторов. Среди основных этиологических факторов развития тоннельных невропатий можно выделить: повышенную нагрузку/перенагрузку переднего отдела стопы, обусловленную чаще всего постоянным ношением слишком тесной обуви или на высоких каблуках, использованием обуви, вызывающей поперечное плоскостопие, деформации стопы различного рода, в том числе , плоскостопие, гематомы в зоне локализации нервных волокон, острые травмы стопы (ушибы, переломы, вывихи), походка с подворачиванием стопы вовнутрь, избыточная масса тела, длительная ходьба, облитерирующие заболевания сосудов ног, аутоиммунные/инфекционные заболевания, липомы различных типов на стопе, изменения в строении нерва и др.
К группе риска относятся лица, профессиональная деятельность которых связана с длительной ходьбой, пребыванием в положении стоя, поднятием тяжестей, а также спортсмены, занимающиеся силовыми видами спорта, прыжками, бегом и пациенты с плоскостопием и с различными разновидностями деформации стопы. О наличии такой проблемы свидетельствует и форум спортсменов. Значимыми провоцирующим факторам являются и бурсит/ тендовагинит стопы, облитерирующий эндартериит ног/облитерирующий атеросклероз, наличие доброкачественной опухоли (плексиформная неврома).
Симптомы невромы Мортона
Симптомы невромы стопы во многом зависит от ее размеров: при диаметре невромы менее 5 мм чаще наблюдается бессимптомное течение. По мере прогрессирования заболевание начинает манифестировать вначале ноющими, стреляющими болями с локализацией в области 3-4-го пальца стопы на фоне физической нагрузки или после нее. Указанные симптомы невромы Мортона могут сочетаться с парестезиями и другими расстройствами чувствительности. С течением времени интенсивность/частота болей увеличиваются, а временной промежуток от начала нагрузки до появления болевого синдрома сокращается.
В конечном итоге боли приобретают жгучий острый характер, появляются в состоянии покоя, при этом изменений конфигурации в стопе не наблюдается. Иногда у пациентов формируется ощущение наличия чужеродного предмета в обуви. При пальпации стопы (клинической пробе со сжатием во фронтальной плоскости) болевой синдром усиливается и появляется иррадиация в пальцы, которая соответствует иннервации пораженного нерва. С прогрессированием болевого синдрома возможно параллельное нарастание сенсорных расстройств (до анестезии). Двигательные расстройства не являются нехарактерными.
Анализы и диагностика
Клиническая диагностика невромы несложна и основывается на наличии болевого синдрома характерной локализации. Наличие сенсорных расстройств подтверждают невральное поражение. Регресс болевого синдрома после проведения местным анестетиком лечебно-диагностической блокады межплюсневого нерва также является признаком невромы.
Из инструментальных методов наибольшую диагностическую ценность имеет ультразвуковое исследование структур стопы. Также для уточнения диагноза может назначаться рентгенограмма стопы, МРТ и КТ.
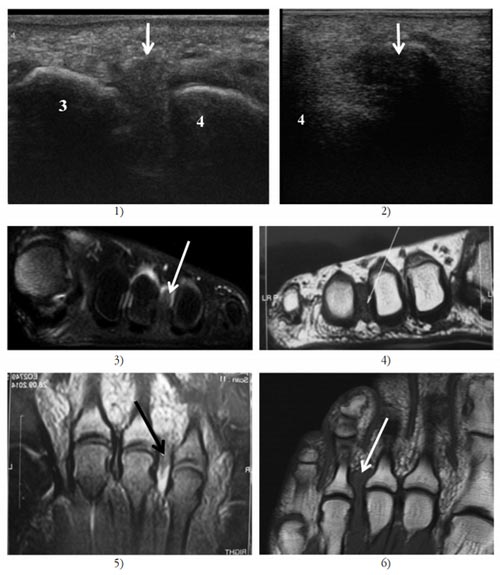
1) и 2) Сонограмма правой/левой стопы 3-го межплюсневого промежутка.
3) и 5) МРТ невромы Мортона правой стопы.
4) и 6) МРТ невромы Мортона левой стопы.
Дифференциальная диагностика проводится с артритом плюснефаланговых суставов, синовитом плюснефалангового сустава, стресс-переломами плюсневых костей, остеонекрозом головок плюсневых костей, а также злокачественными поражениями кости и заболеваниями поясничного отдела позвоночного столба с иррадиацией боли в зону межплюсневых промежутков.
Лечение невромы Мортона
На начальных этапах проводится консервативная терапия:
- ношение удобной обуви с невысоким каблуком или плоской подошвой, имеющей широкий носок;
- ношение стелек, которые подбираются индивидуально, разгружающих передний отдел стопы, уменьшающих боли;
- применение плюсневых прокладок и подъемников;
- лечебная физкультура;
- физиотерапевтическое лечение;
- массаж голеней и стоп;
- инъекции стероидных препаратов в межплюсневое пространство.
При данном заболевании применяются супинаторы-подушечки, которые надевают на пальцы и носят в обуви.
Прорезиненная лента фиксирует приспособление на трех пальцах. Мягкий материал впитывает влагу, эластичные резинки выпрямляют пальцы, а мягкие подушечки снимают нагрузку со стопы.
Цель применения стелек, подушечек, супинаторов — снижение давления на нервный ствол. Они уменьшают нагрузку на переднюю часть стопы, приводят в нормальное состояние поперечный свод, уменьшают давление связок и костей на нерв. Так или иначе, они значительно уменьшают боль и приостанавливают прогрессирование болезни.
Если болевой синдром не очень выраженный местно применяются компрессы и мазь (крем) на основе нестероидных противовоспалительных средств. Параллельно могут назначаться мышечные релаксанты и курсы мануальной терапии. Учитывая то, что неврома стопы сопровождается болевым синдромом, выраженность которого значительно варьирует у разных больных (иногда они испытывают боли годами), необходимо устранять его. Самый действенный метод устранения боли — медикаментозная блокада. При стойкой боли в область невромы (межплюсневый промежуток с тыла стопы в каналы, в ткани, окружающие нерв или канал нерва) вводится раствор Дипроспана с новокаином или лидокаином. В 50% случаев это приводит к улучшению состояния, а 30% — к выздоровлению. Инъекции глюкокортикоидов — это метод патогенетической терапии тоннельных невропатий, к которым относится неврома Мортона. Блокады уменьшают отек и воспаление в зоне компрессии нерва, а следовательно, значительно уменьшают боль. Если у больного имеются явления деформирующего артроза, к лечению добавляют хондропротекторы.
Альтернативной методикой, которую больные могут применять в домашних условиях, является местное лечение компрессами. Они могут быть многокомпонентными и включать:
Компресс прикладывают к области повреждения на 30 минут. В какой-то степени помогают уменьшить боль теплые ванночки с отваром полыни (и компрессы с запаренной травой полыни), компрессы с настойкой прополиса и сабельника, местное применение настойки сабельника и настойки цветков акации. Однако нужно отметить, если не помогают блокады и введение глюкокортикоидов, то не стоит ждать большой эффективности от народных методов лечения. Никакие примочки и растирки на могут повлиять на опухоль. В целом эффективность консервативной терапии составляет меньше 80%. Радикальным методом лечения является хирургическое удаление этого доброкачественного образования.
А.Н. Баринов
Невропатическая боль (НБ) является одним из самых распространенных видов боли в неврологической практике и достаточно сложно поддается лечению. Наиболее часто НБ доминирует в клинической картине при полиневропатии (в первую очередь – диабетической, алкогольной, хронической воспалительной демиелинизирующей и т.п.), тригеминальной и постгерпетической невралгии, комплексном регионарном болевом синдроме. Однако весь спектр неврологических заболеваний, при которых возникает НБ, намного шире. НБ может возникать при поражении периферических нервов (периферическая НБ) или участка выше дорзального ганглия, а также проводников болевой чувствительности на уровне спинного или головного мозга (деафферентационная – центральная НБ). Такое разнообразие мест поражений, формирующих НБ, подразумевает очень большой набор неврологической патологии, при которой подобная боль возникает и требует лечения.
Невропатический болевой синдром является основной причиной снижения качества жизни больных при многих формах невропатий , как локальных, так и генерализованных (полиневропатий), и может доминировать в их клинической картине [1,2]. Традиционно считается, что лечение НБ должно в первую очередь воздействовать на этиологические факторы (например, компенсацию сахарного диабета или выведение из крови токсинов или восполнение недостающих в крови веществ и так далее), однако этиологическая терапия часто не прекращает хроническую НБ. Кроме того, имеется необходимость максимально быстро избавить больного от мучительных болей, что недоступно для этиологической терапии, при которой для этого необходим продолжительный период времени. В связи с этим современный подход к лечению НБ подразумевает назначение препаратов и нефармакологических методов лечения, воздействующих в первую очередь на патофизиологические механизмы боли независимо от этиологической природы их развития [16]. Однако назначение фармакологических препаратов для симптоматической терапии НБ сопряжено с возникновением целого ряда серьезных побочных эффектов (тошнота, головокружение, атаксия, задержка мочеиспускания,ортостатическая гипотензия и даже лекарственная зависимость), что ограничивает их использование.
Препараты капсаицина .
Ключевым направлением в местном лечении хронических дизестезических невропатических болевых синдромов (жгучие, стреляющие боли, парестезии, аллодиния) является десенситизация ваниллоидных рецепторов, играющих ключевую роль в развитии периферической сенситизации терминалей ноцицепторов (т.е. снижения уровня деполяризации мембран аксонов, необходимого для генерации потенциала действия) [1,2,9,16]. Более 150 лет применяются препараты красного жгучего перца [13], механизм действия которых заключается в селективной стимуляции немиелинизированных С–волокон, вызывающей высвобождение субстанции Р и, возможно, других нейротрансмиттеров из терминалей. Последовательное истощение запасов субстанции Р приводит к уменьшению ноцицептивной афферентации в центральную нервную систему и десенситизации ваниллоидных рецепторов. Местное применение капсаицина (алкалоида жгучего перца) в виде кожных мазей и кремов оказалось эффективным в лечении поверхностных жгучих болей и аллодинии, не вызывая при этом серьезных побочных эффектов при таких патологиях, как диабетическая полиневропатия [12], постгерпетическая невралгия [15], болевые дистальные полиневропатии [7], при послеоперационныхневропатических болевых синдромах [4,14].
Препараты лидокаина .
Клинический опыт применения показывает эффективностьпрепаратов лидокаина при таких невропатических болях, как диабетическая полиневропатия, опоясывающий герпес, постмастэктомические боли, комплексный регионарный болевой синдром.
Нестероидные противовоспалительные препараты .
К местным методам лечения НБ можно отнести и физиотерапевтические методики , однако необходимо проявлять осторожность в выборе физиотерапевтических средств лечения, так как наличие гипестезии и вегетативных расстройств предрасполагает к образованию ятрогенныхтрофических язв и ожогов. К наиболее безопасным и эффективным при НБ методам физиотерапии относится чрескожная электронейростимуляция (ЧЭНС). Принцип действия ЧЭНС при НБ основан на стимуляции хорошо миелинизированных афферентных волокон постоянно изменяющимися пачками высокочастотных низкоамплитудных электрических импульсов, что приводит к активации ядер желатинозной субстанции задних рогов спинного мозга и других антиноцицептивных структур, ингибирующих восходящую болевую афферентацию по палеоспиноталамическому пути. Эффективность и безопасность метода ЧЭНС в лечении НБ при диабетической полиневропатии (как наиболее распространенной модели НБ) показаны рядом авторов [5,6,11].
Ключевые слова: габапентин, прозопалгия, невропатическая боль, экстероцептивная супрессия, электронейромиография.
Для цитирования: Грибова Н.П., Кореневская И.А., Страчунская Е.Я. Влияние габапентина на состояние экстероцептивной супрессии при различных вариантах прозопалгий // РМЖ. 2018. №4(II). С. 66-68
Smolensk State Medical University
The article deals with the problem of prosopalgia as a facial pain syndrome which has various classifications, different causes and a large number of treatment options. Particular attention is paid to prosopalgia with a neuropathic component of pain. The relevance of the study is due to the difficulties in choosing the treatment for the patients with different types of prosopalgia and the need to objectify the results of the treatment.
Aim: to evaluate the state of the first and second periods of exteroceptive suppression (ES1 and ES2) in patients with prosopalgia before and after treatment with gabapentin.
Patients and Methods: patients with prosopalgia of various etiologies were included in the study, 23 people in total. We used the clinical method and electroneuromyographic (ENMG) method, namely the method of exteroceptive suppression (ES) with evaluation of the duration of ES1 and ES2 before and after treatment with gabapentin.
Results: the role of exteroceptive suppression in the pathophysiology of neuropathic pain in prosopalgia was determined. The clinical outcome of using gabapentin was a decrease in the severity of pain syndrome. All patients reported a decrease in the pain syndrome after 2-3 days from the start of the gabapentin therapy; the pain attacks also became shorter and less frequent. Stabilization of ES parameters was achieved after gabapentin treatment.
Conclusion: the results of the study showed that the drug gabapentin can be used for the treatment of prosopalgia with a neuropathic nature of pain by improving the control of pain on the stem and suprasegmental structures.
Key words: gabapentin, prosopalgia, neuropathic pain, exteroceptive suppression, electroneuromyography.
For citation: Gribova N.P., Korenevskaya I. A., Strachunskaya E.Ya. The effect of gabapentin on the state of exteroceptive suppression in various types of prosopalgia // RMJ. 2018. № 4(II). P. 66–68.
В статье обсуждается проблема прозопалгий – болевых синдромов в области лица, особое внимание уделено прозопалгиям с невропатическим компонентом. Показано, что препарат габапентин может быть использован в качестве лекарственного средства при лечении пациентов с прозопалгиями невропатического характера за счет улучшения контроля боли на стволовом и надсегментарном уровне.
Проведено обследование 23 пациентов с прозопалгиями различного генеза, в возрасте от 34 до 76 лет. Среди обследуемых были больные с одонтогенными и миогенными прозопалгиями, прозопалгиями герпетической и эндокринной этиологии. Клиническая картина прозопалгий характеризовалась постоянными ноющими, жгучими болями в области лица, преимущественно в зоне иннервации второй ветвью V пары черепных нервов, с отсутствием курковых зон, не связанными с приемом пищи, туалетом лица и временем суток. У 4-х пациентов имела место истинная невралгия тройничного нерва, этиологическим фактором которой явился доказанный МРТ-исследованием нейроваскулярный конфликт между артерией мозжечка и корешком тройничного нерва на пирамиде височной кости. У 4-х пациенток наблюдались психогенные прозопалгии. Данные этих пациентов в рассматриваемое исследование не включены.
Во всех остальных случаях были проведены общеклинические и нейровизуализационные исследования, консультации узких специалистов и ЭНМГ. Акцент был сделан на изучении параметров ЭС в норме, у больных с прозопалгиями до и после лечения. Полученные данные сравнивались с контрольной группой здоровых лиц (n=20).
Был использован метод ЭС – электрофизиологический метод, позволяющий оценить активность тормозных интернейронов стволового уровня, регулирующих деятельность антиноцицептивной системы. Впервые рефлекс открывания рта в ответ на боль был описан в 1917 г. английским физиологом Ч.С. Шерингтоном. При проведении ЭС активный электрод (катод) накладывают на височную мышцу, референтный (анод) – на уровне козелка. Стимуляцию проводят при максимальном сжатии зубов в области красной каймы губ, при этом сила тока электрического импульса должна быть такой, чтобы сам стимул был немного болезненным. ЭС состоит из двух периодов подавления произвольной мышечной активности (рис. 1), оценивается латентность обоих периодов, а также длительность собственно самих периодов подавления мышечной активности. 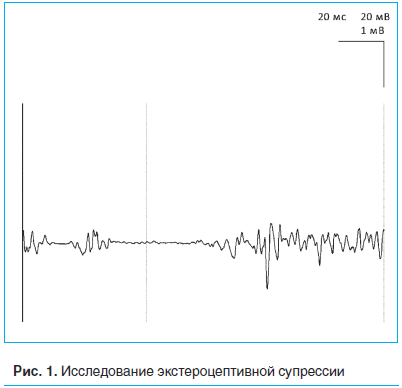
ЭС позволяет оценить состояние антиноцицептивной системы у пациентов с болевыми синдромами различного генеза. В литературе имеются данные об изменении параметров ЭС, в частности длительности периодов ЭС при различных патологиях: у пациентов с эндогенной депрессией, паркинсонизмом, хронической поясничной болью, межреберной невралгией [9].
В нашей работе анализировались параметры ЭС у пациентов с различными вариантами прозопалгий до и после лечения. Параметры ЭС вариабельны при изменении силы тока и его частоты. Мы делали замеры одиночными стимулами с силой тока 20 мА и частотой 0,1 Гц. В качестве сравнения мы использовали средние показатели 20 здоровых лиц: длительность ЭС1 – 13,71 мс, длительность ЭС2 – 33,84 мс.
Пациенты получали препарат габапентин в дозе 300 мг 3 р./день в течение месяца.
При анализе ЭС1 и ЭС2 у пациентов с невропатическим характером боли в лице до лечения было выявлено статистически достоверное уменьшение (p
При анализе ЭС1 и ЭС2 после лечения препаратом габапентин было выявлено статистически достоверное (p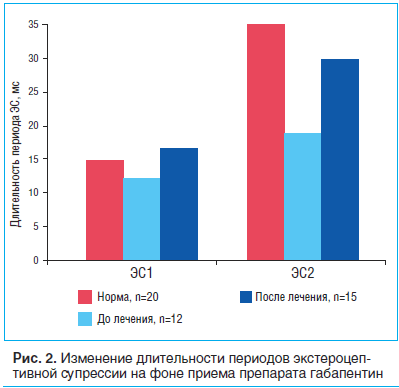
У всех больных отмечено уменьшение болевого синдрома на фоне приема габапентина на 2–3-е сутки после начала приема препарата, укоротились также и стали реже эпизоды обострения болевого синдрома.
Препарат габапентин улучшает клиническое состояние у пациентов с невропатической лицевой болью, улучшает состояние антиноцицептивной системы, что электронейромиографически выражается в удлинении периодов ЭС1 и ЭС2 после лечения. Данный препарат может быть использован как один из эффективных методов обезболивания при невропатических прозопалгиях.
Читайте также:


