Цинк и болезнь альцгеймера
Известно, что болезнь Альцгеймера занимает одно из лидирующих мест среди заболеваний, которые чаще всего являются причиной смерти людей в пожилом возрасте. Несмотря на это, причины данной формы приобретенного слабоумия до сих пор изучены крайне неудовлетворительно. Впрочем, во всем мире продолжаются активные изыскания в области исследования этой болезни. На данный момент времени ученые, которые занимаются исследованием причин заболеваний головного мозга, доподлинно установили два основных типа невральных (мозговых) повреждений или аномалий, которые можно связать с появлением болезни Альцгеймера и ее прогрессированием. Благодаря генетическим исследованиям удалось пролить немного света и на некоторые другие возможные причины, вызывающие болезнь Альцгеймера, однако потребуется еще не один десяток дополнительных исследований, чтобы расставить все точки над "и". К примеру, гипотеза о том, что алюминий и цинк способны вызывать эту форму слабоумия, вызывает немало споров в научном мире, а значит окончательные открытия еще впереди. Итак, возможные причины болезни Альцгеймера.
Спутанные отростки нейронов (нейрофибриллярные клубки)
Микроскопическое исследование мозга умерших от болезни Альцгеймера людей позволило ученым обнаружить так называемые нейрофибриллярные клубки (спутанные нервные волокна, которые являются отростками нейронов) в определенных областях головного мозга. Эти нервные волокна находятся, главным образом, внутри самих нервных клеток. По мере спутывания отростков, в поврежденной клеточной ткани накапливаются так называемые бляшки, которые образуются там из-за отложений белка. Сам белок, который обнаруживают в сплетениях отростков нейронов, называется тау. Пока исследователям не удалось до конца разобраться, как именно образуются эти нейрофибриллярные клубки, однако ученые уверены, что подобные сплетения весьма типичны для болезни Альцгеймера.
Сенильные или нейритические бляшки
Речь идет о пораженных участках, которые расположены вне нервных клеток. Эти участки буквально окружены умершими нейронами (нервными клетками). Сами бляшки содержат липкий белок, который называется бета амилоид. Это белок приводит к неудовлетворительной работе нервных клеток, что выражается в конечном итоге в их гибели. Кроме всего прочего, нейритические бляшки состоят из молекул так называемого белка-предшественника амилоида, которые являются, главным образом, основной составляющей головного мозга. Эти нейритические бляшки образуются тогда, когда определенный фермент разбивает молекулу белка-предшественника амилоида, приводя к тому, что часть ее оседает на определенных участках, а другие фрагменты (включая белок бета амилоид) остаются в тканях мозга, где и образуют аномальные зоны. Ученые предполагают, что наличие нейритических бляшек может быть связано со снижением уровня такого вещества, как ацетилхолин – важнейший элемент, ответственный за передачу информации в мозге.
Генетические причины
Как известно, хромосомы являются неотъемлемой частью каждой клеточки человеческого тела, неся при этом важнейшую наследственную информацию, запечатанную в генах. Связь между синдромом Дауна и болезнью Альцгеймера навела исследователей на мысль поискать генетические факторы на 21-ой хромосоме, которая, собственно, и ответственна за болезнь Дауна. Помимо этого, ученые изучили и другие хромосомы, которые имеют отношение к болезни Альцгеймера (включая 19-ую и 14-ую хромосомы). Как оказалось, наиболее значимым было изучение 19-ой хромосомы. Именно на этой хромосоме исследователи обнаружили ген ApoE-e4, известный тем, что указывает на заболевания сердца, которые обычно обнаруживают у людей, страдающих от болезни Альцгеймера со своего 65-тилетия. Вероятность обнаружить этот же ген у людей, которые не страдают от болезни Альцгеймера, крайне мала. На основании результатов своих исследований, ученые пришли к выводу, что данный ген вполне может отвечать за предрасположенность человека к болезни Альцгеймера. Впрочем, далеко не во всех случаях наличие данного гена является предшественником этой распространенной формы слабоумия.
Алюминий
Некоторым исследователям удалось обнаружить повышенный уровень алюминия, ртути и других металлов в мозге людей, которые пали жертвами болезни Альцгеймера. Благодаря данному открытию, в ученом мире возникла весьма спорная гипотеза, согласно которой попадание данных веществ (в особенности, алюминия) в организм через органы пищеварения способно привести к развитию болезни Альцгеймера. Однако для того чтобы доказать, на самом ли деле этот металл способен вызывать данную форму слабоумия, необходимо проделать еще множество исследований, которые дадут возможность, помимо всего прочего, лучше понять роль не только этого, но и других металлов в развитии данной болезни.
Цинк стал камнем преткновения ученых, когда речь зашла о другой спорной теории, объясняющей очередную причину развития болезни Альцгеймера. Но обо всем по порядку. В результате одного из многочисленных исследований, в рамках которого пожилым людям, страдающим от болезни Альцгеймера, давали пищевые добавки на основе цинка, ученые якобы обнаружили связь между этим металлом и улучшением умственных способностей больных людей. Однако спустя всего лишь два дня умственные способности пациентов, участвовавших в данном эксперименте, резко ухудшились. Об этом опыте сообщалось еще в 1991 году. Спустя несколько лет очередные лабораторные исследования помогли ученым обнаружить тот факт, что цинк способен стимулировать белки формировать образования, аналогичные тем бляшкам, которые были обнаружены в мозгу людей, страдающих от болезни Альцгеймера. Как и в случае с алюминием, эти данные являются предварительными и также нуждаются в дополнительных исследованиях, так как ученые не могут с уверенностью утверждать, действительно ли бляшки вызывают болезнь Альцгеймера, или они сами являются продуктом этого заболевания.
Спусковым крючком патогенного молекулярного процесса, приводящего к болезни Альцгеймера, служат ионы цинка.
Впрочем, в последнее время появляются данные, которые говорят о том, что вред от патогенных амилоидов проявляется ещё до того, когда они начинают вываливаться в осадок, что главный токсический эффект производят крупные объединения пептидов, которые до поры до времени остаются растворимыми, свободно плавая в цитоплазме.
Как бы то ни было, сейчас уже известно, как амилоидные пептиды слипаются, разрастаясь во всё более крупные комплексы – однако с чего всё начинается, до сих пор остаётся загадкой. Что заставляет две самые первые свободные молекулы соединиться друг с другом? Разобраться в этом попытались исследователи из Института молекулярной биологии им. Энгельгардта и факультета фундаментальной медицины Московского государственного университета, опубликовавшие результаты своих экспериментов в Scientific Reports.
По словам Владимира Польшакова, ведущего научного сотрудника факультета фундаментальной медицины МГУ и одного из соавторов статьи, важную роль в инициализации молекулярных процессов, с которых начинается развитие синдрома Альцгеймера, играют ионы переходных металлов, прежде всего цинка.
Цинк играет важную роль в жизни любой клетки – например, некоторые белки, управляющие активностью генов, не смогут работать, если их структуру не скрепить цинковыми ионами – однако его взаимодействие с бета-амилоидами ни к чему хорошему, по-видимому, не приводит. Но вот как именно он с ними связывается и что именно тут происходит, до сих пор остаётся неясным.
Чтобы узнать это, нужно изучить структуру молекулярных комплексов – фрагментов амилоидных пептидов, взаимодействующих с ионом металла. Эксперименты проводили как с нормальным бета-амилоидным пептидом, так и с мутантным, в котором одна из аминокислот была заменена на другую, а также с изомеризованным пептидом, не отличавшимся по аминокислотному составу от нормального, но в котором в одной из аминокислот атомы располагались иначе (то есть она была изомером такой же аминокислоты, что находилась в том же положении в нормальном бета-амилоиде).
Про пептид-изомер было известно, что он появляется спонтанно, без участия ферментов, что его накопление усиливается с возрастом, и что у мышей он вызывает стремительное формирование альцгеймерических бляшек в мозге – в присутствии же цинка такие пептиды слипались друг с другом едва ли не мгновенно.
Нарастание амилоидов во всех трёх случаях – с нормальным пептидом, с изомеризованным и с мутантным – имеет свои особенности. Однако, как показал анализ молекулярных комплексов, проведенный с помощью ядерно-магнитного резонанса и ряда других методов, начальные стадии в каждой случае абсолютно одинаковы: во всех трёх вариантах всё начинается с того, что ион цинка скрепляет два пептида.
Скорость дальнейшей агрегации зависит от того, какой конкретный вид амилоидных пептидов участвует в процессе, насколько он склонен к слипанию, однако, как бы ни повернулись дальнейшие события, в начальной точке всегда будет димер с цинком в качестве межмолекулярной скрепки.

Цена:
Авторы работы:
Научный журнал:
Год выхода:
БИОХИМИЯ, 2014, том 79, вып. 5, с. 501 - 508
РОЛЬ ИОНОВ ЦИНКА И МЕДИ В МЕХАНИЗМАХ ПАТОГЕНЕЗА БОЛЕЗНЕЙ АЛЬЦГЕЙМЕРА И ПАРКИНСОНА
2 Московский государственный университет им. М.В. Ломоносова, НИИ физико-химической биологии им. А.Н. Белозерского, 119992 Москва, факс: (495)939-3181, электронная почта: isaev@genebee.msu.ru
Поступила в редакцию 07.10.13 После доработки 21.01.14
Дисбаланс ионов цинка (/п2+) и меди (Си2+) в центральной нервной системе вовлечен в патогенез многих нейродегенеративных заболеваний, таких как мультисистемная атрофия, боковой амиотрофический склероз, болезни Крейтцфельдта—Якоба, Вильсона—Коновалова, Альцгеймера (БА), Паркинсона (БП). Последние две разновидности церебральной патологии являются наиболее распространенными возрастными заболеваниями, в механизмах патогенеза которых нарушения гомеостаза /п2+ и Си2+ играют важную роль. В данном обзоре предпринята попытка суммировать и систематизировать имеющиеся в настоящее время данные исследований по этой проблеме. Рассмотрены взаимодействия /п2+ и Си2+ с АРР, бета-амилоидом (Абета), белком тау, металлотионеинами, 08К3бета и их роль в генерации свободных радикалов при БА и БП. Проведенный анализ литературы позволяет заключить, что основные патогенетические факторы БА и БП (окислительный стресс, нарушение структуры и агрегация белков, дисфункция митохондрий, энергетический дефицит), которые инициируют каскад реакций, приводящих, в конечном счете, к дисфункции нейронных сетей, опосредуются дисбалансом /п2+ и Си2+.
КЛЮЧЕВЫЕ СЛОВА: ионы меди, ионы цинка, болезнь Альцгеймера, болезнь Паркинсона, митохондри-ально-адресованные антиоксиданты.
В патогенезе многих нейродегенеративных заболеваний, к которым относят мультисистем-ную атрофию, боковой амиотрофический склероз, болезни Крейтцфельдта—Якоба, Вильсона-Коновалова, Альцгеймера, Паркинсона, важная роль отводится дисбалансу ионов различных металлов и, в первую очередь, цинка и меди [1]. В индустриально развитых странах болезнь Альцгеймера (БА) и болезнь Паркинсона (БП) являются самыми распространенными возрастными нейродегенеративными заболеваниями,
Принятые сокращения: БА — болезнь Альцгеймера; БП — болезнь Паркинсона; АФК — активные формы кислорода; NMDA — N-метил-В-аспартат; GABA — гамма-аминомасляная кислота; Абета — бета-амилоид; MPTP — 1-метил-4-фенил-1,2,3,6-тетрагидропиридин; 6-OHDA — 6-гидроксидопамин; MPP(+) — 1-метил-4-фенилпиридин; GSK3бета — гликоген синтаза киназа 3-бета; АСН — аль-фа-синуклеин.
* Адресат для корреспонденции.
терапия которых в настоящее время является симптоматической и не способна обеспечить остановку развития патологических процессов [2]. Поэтому исследование механизмов патогенеза БА и БП с целью поиска новых мишеней для создания эффективных нейропротекторных лекарственных средств является актуальным направлением современной экспериментальной и клинической неврологии. В последние годы показано, что в эти механизмы вовлечены ионы цинка и меди, однако их участие в патогенетических процессах в настоящее время трактуется неоднозначно [3, 4]. Известно, что в норме 2п2+ и Си2+ являются структурными элементами большого количества белков. Без этих металлов невозможна жизнедеятельность клеток организма и нормальная работа клеточных орга-нелл, так как 2п2+ входит в состав молекул ряда транскрипционных факторов, а Си2+ является необходимым компонентом цитохром с-окси-
дазы — фермента, который катализирует конечный этап переноса электронов на кислород в процессе окислительного фосфорилирования в митохондриях. Кроме того, оба этих металла содержатся в молекуле такого важнейшего анти-оксиданта, как супероксиддисмутаза, а Си2+ входит в состав церулоплазмина, белка плазмы крови, вовлеченного в механизмы ряда проок-сидантных и антиоксидантных реакций. С другой стороны, ионы меди необходимы для нормальной реализации процессов памяти и обучения, так как в гиппокампе в глутаматергических синапсах при нейрональной деполяризации они высвобождаются из синаптических везикул в синаптическую щель, где их концентрация достигает 0,015 мМ, и они могут инактивировать ММБА-комплекс, тем самым предохраняя нейроны от эксайтотоксического действия глутама-та [5, 6].
Для нормального функционирования нервной системы особое значение имеет 2и2+, значительные запасы которого содержатся в синап-тических везикулах глутаматергических нейронов и достигают там миллимолярных концентраций. Выброс глутамата из везикул в синапти-ческую щель происходит совместно с ионами цинка, где они взаимодействуют с ММБА- и ОАБА-рецепторами, регулируя проницаемость ионных каналов и модулируя тем самым как возбуждающую, так и тормозную синаптичес-кую передачу [7]. В отличие от синаптических везикул, содержание 2и2+ в цитоплазме нейронов очень низкое и измеряется в пикомолях, а его большая часть связана с белками металлотио-неинами. Цинксодержащие нейроны находятся в основном в коре и лимбических структурах головного мозга, поэтому полагают, что 2и2+ может играть важную роль в поведении и эмоциях [8].
Поддержание гомеостаза 2и2+ и Си2+ в мозге очень важно, и отклонения от него могут быть фатальными для нейронов [9—12]. Нарушение регуляции этого гомеостаза играет одну из первостепенных ролей в механизмах патогенеза многих нейродегенеративных заболеваний, в том числе болезней Альцгеймера и Паркинсона.
Болезнь Альцгеймера (БА) — нейродегенера-тивное заболевание с прогрессирующей картиной когнитивных нарушений, которое сопровождается дегенерацией синапсов и значительной потерей нейронов в коре головного мозга и холинергических базальных ядрах. В настоящее время предполагается, что основными триггера-
ми этих нарушений являются бета-амилоид (Абета) и гиперфосфорилированный внутриклеточный белок тау, накопление которых сопровождается дисбалансом вне- и внутриклеточного содержания и распределения ионов цинка и меди, а, возможно, также и железа. Роль цинка в развитии БА в настоящее время оценивается неоднозначно. Например, связываясь с Абета, 2и2+ экранирует участки протеолитического расщепления молекулы и, тем самым, ингиби-рует деградацию Абета с участием металлопро-теаз. В то же время, цинк подавляет активность гамма-секретаз, которые принимают участие в образовании Абета [12]. Ионы цинка при БА взаимодействуют с Абета и накапливаются внутри амилоидных бляшек. Захват цинка бляшками и олигомерами Абета приводит к снижению внутринейронного уровня цинка, а в некоторых случаях — к его избытку в близлежащих к амилоидным бляшкам нейронах [9]. Связываясь с тау-белком, 2и2+ индуцирует его агрегацию и формирование внутриклеточных нейрофибрилляр-ных клубков, что в дальнейшем приводит к нарушению транспортной системы нейрона и ухудшению когнитивных функций [13, 14].
Как было отмечено выше, в головном мозге цинк является синаптическим модулятором такого важнейшего нейромедиатора, как глутамат, и, таким образом, участвует в механизмах когнитивных процессов. Уровень синаптического везикулярного цинка контролируется специфическим белком, цинковым транспортером-3 (2иТ3). Показано, что при БА в коре головного мозга пациентов в возрасте 73 ± 13 лет уровень 2иТ3 снижен на 36% по сравнению со здоровыми людьми [9]. По этой причине, а также в результате связывания 2и2+ олигомерами Абета происходит значительное ослабление взаимодействия синаптического цинка с его постси-наптическими мишенями. Нарушение передачи сигналов ионами цинка приводит к снижению экспрессии постсинаптических мишеней, таких как МЯ2Б (субъединицы ММБА-подтипа глута-матного рецептора), и ухудшению когнитивных функций [15]. Следует отметить, что в сыворотке крови пациентов с БА содержание 2и2+ значительно снижено [15, 16], хотя другими авторами [17] отмечено увеличение его содержания в цереброспинальной жидкости. Некоторый дефицит 2и2+ распространен и у пожилых людей, но в настоящее время еще недостаточно данных, чтобы заключить, полезны ли добавки цинка для профилактики и лечения БА, и являются ли дефицит цинка или его избыток факторами риска развития БА [18].
Роль меди в патогенезе БА в настоящее время гораздо менее ясна, чем роль цинка, хотя об-
наружено, что ионы меди, как и ионы цинка, колокализованы в мозге с бляшками Абета [19]. В одном из ранних исследований показано повышение уровня меди в сыворотке крови пациентов с БА [20]. Более того, достоверное повышение уровня меди было показано и в цереброспинальной жидкости [17], тогда как в гиппо-кампе и амигдале обнаружено его снижение [21]. Однако позднее были опубликованы данные, что при БА у пациентов с низким содержанием меди в плазме крови когнитивные нарушения выражены сильнее, чем у больных со средним ее содержанием [22].
Одним из белков, влияющих на уровни меди и цинка в мозге при БА, является Абета, который способен связывать ионы этих металлов, причем цинк конкурирует с медью за места связывания [23]. Медь, связанная с Абета, становится более токсичной для нейронов, причем степень цитотоксичности комплекса медь-Абе-та прямо коррелирует с уровнем меди [12]. Если цинк при связывании с Абета большей частью способствует образованию фибрилл, то при связывании меди с амилоидом образуются олиго-меры, которые могут проникать внутрь клеток. Предполагается, что токсичность меди при БА опосредована ингибированием цитохром с-ок-сидазы ионами меди, связанными с Абета, и их способностью стимулировать фосфорилирова-ние и агрегацию тау-белка [12]. Бревер [24] предполагает, что в сочетании с потреблением пищи с высоким содержанием жира медь может быть важным фактором риска развития БА. Однако показано, что возрастание внутриклеточной концентрации меди в клетках линии SH-SY5Y вызывает дозозависимое ингибирование про-апоптотического белка GSK3бета посредством фосфорилирования [25], а связывание медихе-латором на фоне окислительно
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
- МИТОХОНДРИАЛЬНО-АДРЕСОВАННОЕ ПРОИЗВОДНОЕ ПЛАСТОХИНОНА АНТИОКСИДАНТ SКQR1 ОКАЗЫВАЕТ ПОЛОЖИТЕЛЬНОЕ ВЛИЯНИЕ НА ПАМЯТЬ КРЫС
ИСАЕВ Н.К., КАПАЙ Н.А., ОЛЬШАНСКИЙ А.С., ПОПОВА О.В., СКРЕБИЦКИЙ В.Г., СТАВРОВСКАЯ А.В., СТЕЛЬМАШУК Е.В., ХАСПЕКОВ Л.Г., ЯМЩИКОВА Н.Г. — 2015 г.
ЗОРОВ Д.Б., ИСАЕВ Н.К., КАПАЙ Н.А., ПОПОВА О.В., СКРЕБИЦКИЙ В.Г., СКУЛАЧЕВ В.П., СТЕЛЬМАШУК Е.В. — 2011 г.
Но лучше всего, конечно, вообще избежать болезни. Поэтому наряду с разработками лекарств ученые и врачи ищут методы предотвращения заболеваний. Эксперты анализируют образ жизни, состояние здоровья больших групп людей по всему миру и показатели их заболеваемости тем или иным недугом. Недавно в авторитетном международном научно-медицинском журнале Frontiers in neurology вышел обзор данных о профилактике болезни Альцгеймера и деменции (слабоумия). Работу провела крупная группа ученых из Китая , США , Великобритании , Израиля и Канады .
ЧТО ТАКОЕ ПРОФИЛАКТИКА НА САМОМ ДЕЛЕ
Чтобы понять, на каком этапе и кому может помочь соблюдение правил (см. ниже), важно знать, что такое профилактика на самом деле, поясняют авторы работы. Всемирная организация здравоохранения выделяет три вида профилактики:
- первичная профилактика направлена на то, чтобы избежать возникновения болезни;
- вторичная предназначена для того, чтобы распознавать болезнь на ранних стадиях, когда еще даже не появились симптомы. Задача — остановить или замедлить развитие болезни. Этот вид профилактики включает в себя, в том числе, скрининги. То есть проверки и обследования людей из групп риска развития той или иной болезни;
- третичная профилактика применяется, когда человек уже заболел. В данном случае стоит цель избежать прогрессирования болезни, тяжелых осложнений и инвалидности.
Итого: в отличие от бытующих представлений профилактика возможна и тогда, когда человек уже болен. Скажем, ему поставлен диагноз болезнь Альцгеймера. А это значит, что правила, о которых рассказывается ниже, способны помочь абсолютно любому человеку. Если не избежать болезни, то как минимум снизить риск тяжелых осложнений.
ТРИ СТАДИИ АЛЬЦГЕЙМЕРА
Национальный институт исследований старения (США) и Альцгеймеровская ассоциация в 2011 году разработали модель, выделяющую три стадии болезни. На первой стадии у пациента нет ни малейших внешних признаков заболевания, в то время как в мозге уже появляются предшественники грядущей катастрофы. Стартует процесс накопления амилоидных бляшек и деформированного тау -белка, которые впоследствии буквально душат клетки мозга нейроны. Справедливости ради отметим: для исследователей еще остается немало загадок. В частности, амилоидные сгустки-бляшки с помощью метода позитронно-эмиссионной томографии мозга можно найти у многих людей уже с 40 лет. Но, к счастью, болезнь Альцгеймера при этом развивается далеко не у всех. Потому-то ранняя диагностика недуга по-прежнему остается одной из главных проблем.
СПАСИ СЕБЯ САМ
1. Отказаться от курения.
4,7 миллионов случаев заболевания болезнью Альцгеймера во всем мире связаны в первую очередь с курением, посчитали исследователи. Как такое может быть? Если пояснять упрощенно, то вредные токсины, которые попадают в организм при курении, вызывают воспаление стенок кровеносных сосудов. В том числе в головном мозге. Из-за этого ускоренно накапливаются те самые опасные амилоидные бляшки, из-за которых гибнут нервные клетки нейроны.
Если сократить уровень курения в мире на 25%, то удалось бы спасти от Альцгеймера примерно 1 миллион людей, уверяют ученые.

2. Избавиться от лишнего веса и ожирения в среднем возрасте (после 40 лет).
Речь идет о тех, у кого индекс массы тела (ИМТ) выше 30, уточняют ученые. Напомним: чтобы посчитать ИМТ, берем свой рост в метрах, возводим в квадрат. А потом массу тела в кг делим на полученную цифру.
Около 677 000 случаев болезни Альцгеймера в мире связаны главным образом именно с избыточным весом, говорится в исследовании.
В том числе из-за снижения такой защиты начинают ускоренно развиваться процессы, вызывающие болезнь Альцгеймера.
3. Заниматься физическими упражнениями, не вести сидячий образ жизни.
4,3 млн случаев болезни Альцгеймера связаны с недостатком физнагрузок, ужасаются ученые. Из-за этого страдает кровообращение в мозге. А значит — выше риск накопления опасных веществ, которые могли бы вымываться с током крови.
Совет: золотым международным стандартом на сегодня считается минимум 150 минут двигательной активности в неделю, или не менее чем по 30 минут 5 дней в неделю. А лучше — по 40 — 60 минут каждый день. Самый безопасный вид физнагрузок — кардиологическая ходьба, то есть максимально быстрым шагом, но так, чтобы не было одышки.
4. Повышать свое образование.
Низкий уровень образования способствует развитию болезни Альцгеймера у 6,5 млн человек во всем мире, утверждают ученые (как оценивать свой уровень образования — не уточняется).
- Для профилактики болезни Альцгеймера важно создавать так называемый когнитивный резерв. Этого можно добиться с помощью занятий, которые ведут к образованию новых связей между нейронами и стимулируют образование новых нервных клеток (у взрослого человека их появляется очень мало, но тем не менее), - поясняет профессор Яшин . - А самое мощное средство для создания когнитивного резерва — это как раз получение незнакомых навыков и знаний. Например, изучение иностранного языка, посещение увлекательных образовательных лекций или их просмотр по телевизору, овладение компьютерными навыками в пожилом возрасте, обучение танцам, рисованию, лепке — все, что требует от нас запоминания и вспоминания, творческого подхода — все это помогает создавать и укреплять связи между нейронами.
5. Вовремя диагностировать и лечить сахарный диабет.
Примерно 825 000 случаев развития болезни Альцгеймера ассоциируется с сахарным диабетом, пишут авторы исследования.
6. Уделять внимание лечению депрессии.
Это заболевание провоцирует не менее 3,6 млн случаев болезни Альцгеймера во всем мире, предупреждают ученые.
Наличие депрессии само по себе уже сигналит, что в мозге какие-то неполадки, из-за которых нейроны могут оказаться более беззащитны перед повреждающими процессами. Долговременные наблюдения за большими группами людей показывают, что депрессия является важным фактором риска, повышающим вероятность болезни Альцгеймера.
7. Нормализовать давление и не допускать усугубления гипертонии в среднем возрасте (после 40 лет).
По данным авторов исследования из-за нелеченой гипертонии зарабатывают себе Альцгеймер 1,7 млн пациентов. Повышенное давление грозит не только инфарктами и инсультами, но и развитием деменции, подчеркивают ученые.
В ТЕМУ
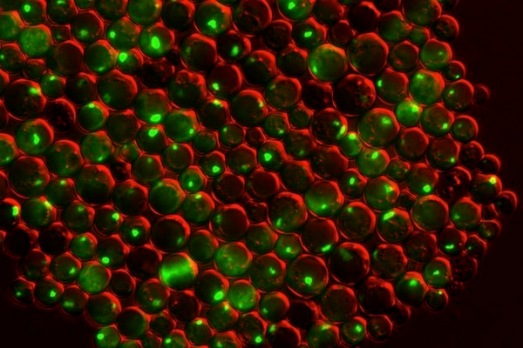
Зеленые пятна сверху – скопления белков внутри дрожжевых клеток с дефицитом как цинка, так и белка, предотвращающего образование агрегатов. Ученые Висконсинского университета в Мэдисоне изучают, как дефицит цинка может способствовать развитию заболеваний. (Фото: Colin MacDiarmid and David Eide/ The Journal of Biological Chemistry )
Ученые Висконсинского университета в Мэдисоне ( University of Wisconsin-Madison ) провели исследование, которое, если его результаты будут воспроизведены на человеческом организме, позволяет признать деструктивную роль дефицита цинка в развитии таких нейродегенеративных заболеваний, как болезнь Альцгеймера и болезнь Паркинсона , причина которых связывается с дефектными белками, образующими скопления в головном мозге.
Структура белка – это его всё. Правильный фолдинг позволяет одним белкам переносить атомы или молекулы, другим – обеспечивать жизненно важную для клетки внутреннюю архитектуру, третьим – выявлять вторгшиеся бактерии и атаковать их. При нарушении структуры – из-за высокой температуры или химических взаимодействий – белки перестают выполнять свои функции и могут начать образовывать агрегаты, что является признаком болезни Паркинсона и болезни Альцгеймера.
Ионы необходимого организму металла цинка играют одну из ключевых ролей в организации и поддержании правильной структуры белков. Американские ученые открыли еще один стрессовый фактор, снижающий стабильность белков и вызывающий их агрегацию,– нехватку этого элемента.
Для простоты эксперименты проводились на дрожжах Saccharomyces cerevisiae – одноклеточных грибах. Дрожжи могут приспособиться как к дефициту, так и к избытку цинка. Гомеостатический и адаптивный ответы на дефицит цинка регулируются в их клетках транскрипционным фактором Zap1 . Один из генов-мишеней Zap1 кодирует пероксиредоксин Tsa1 – белок с функцией как пероксидазы, так и шаперона.
В исследовании, только что опубликованном в он-лайн издании журнала The Journal of Biological Chemistry , Колин Мак-Дайермид (MacDiarmid) и Дэвид Эйде (David Eide) показали, что, удерживая белки в растворе, Tsa1 предотвращает события, которые в противном случае могут стать причиной гибели клетки.
Клетки с низкой концентрацией цинка вырабатывают белки, противостоящие стрессу. Одним из таких белков является Tsa1.
Ученым известно, что пероксиредоксин Tsa1 может снижать уровень вредных оксидантов в клетках, которым не хватает цинка: он может избавлять их от опасных активных форм кислорода, повреждающих белки. Но у него есть и совершенно другая функция – шаперона, предотвращающего их агрегацию. Как следует из результатов экспериментов, функция шаперона более важна.
Если значение этого открытия для медицины еще предстоит оценить, то явное сходство между дрожжевыми и человеческими клетками отрицать нельзя.
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Общие положения
- Болезнь Альцгеймера характеризуется прогрессирующим поражением мозговой ткани.
- Является самой распространённой формой слабоумия у пожилых людей и влечёт за собой окончательную потерю памяти, утрату способности мыслить и двигаться.
- Изначально болезнь прогрессирует медленно и её можно принять за естественный процесс старения.
- Эта болезнь неизлечима.
- Целью лечения является замедление прогрессирования болезни и облегчение симптомов.
Описание
Болезнь Альцгеймера является четвёртой по значимости причиной смерти в мире (после болезней сердца, рака и инсульта).
Это неизлечимое заболевание головного мозга было открыто в 1907 году немецким учёным Алоисом Альцгеймером и было названо в его честь.
В первую очередь этой болезни подвержены люди старше 65 лет. В таких случаях говорят о болезни Альцгеймера с поздним началом. Кроме того, были зарегистрированы случаи среди людей в возрасте 50, 40 и редко 30-ти лет (раннее начало). Почти у всех пациентов с синдромом Дауна, если они доживают до 40 лет, развивается это заболевание. В конечном счёте, люди, страдающие болезнью Альцгеймера, теряют способность мыслить, рассуждать и координировать движения и становятся недееспособными в течение 5 - 8 лет. Начиная с 60 лет, риск развития болезни Альцгеймера или слабоумия удваивается каждые 5 лет. В возрасте 60 лет риск составляет примерно 1%, в 65 - лет 2%, в 70 лет – 5% и т.д. В возрасте 85 лет и старше примерно 2 из 5 человек имеют некоторую форму слабоумия.
Причины
Причины болезни Альцгеймера ещё не полностью известны и находятся на стадии изучения. Не так давно были обнаружены два основных вида нейрональных повреждений или отклонений, которые могут быть связаны с развитием заболевания и его прогрессированием.
Генетические исследования пролили новый свет на возможные причины болезни Альцгеймера, но они пока недостаточно изучены. Исследования того факта, что алюминий и цинк являются причинами заболевания очень противоречивы, и поэтому эта теория меньше обсуждается.
Сплетённые волокна нервных клеток (нейроволоконные сплетения)
Старческие или нервные бляшки
Генетическое исследование
Связь между синдромом Дауна и болезнью Альцгеймера заставила учёных искать генетические дефекты на 21 хромосоме, которая поражена при синдроме Дауна. Хромосомы находятся в каждой клетке организма и несут наследственную информацию (гены). Кроме того, учёные изучили 14 и 19 хромосомы, также поврежденные при синдроме Дауна. Более значительным стало исследование 19 хромосомы. Именно на этой хромосоме научные работники обнаружили ген АроЕ-4. Это известный маркер сердечно-сосудистых заболеваний у людей, у которых болезнь Альцгеймера развилась в возрасте 65 лет или позже. Согласно этим открытиям, учёные считают, что люди с этим геном могут быть более восприимчивыми к болезни Альцгеймера. Но это неточный показатель.
Алюминий
Некоторые исследователи обнаружили в мозге людей, страдающих болезнью Альцгеймера, повышенный уровень содержания алюминия, ртути и других металлов. Это привело к развитию противоречивой теории, согласно которой, употребление мелких частиц одного из этих металлов, особенно алюминия, может привести к развитию болезни Альцгеймера. Тем не менее, необходимо провести гораздо больше исследований, чтобы выяснить, являются ли отложения алюминия причиной или результатом болезни Альцгеймера, а так же чтобы лучше понять истинную роль этого и других металлов в развитии этого расстройства.
Цинк
В центре внимания другой теории о возможных причинах развития болезни Альцгеймера находится цинк.
Исследования, предполагающие связь между этим микроэлементом и улучшением умственной активности у пожилых людей, натолкнули учёных на мысль назначать цинк пациентам, страдающим этой болезнью. Было проведено 1991 исследование. Тем не менее, всего через два дня умственные способности пациента ухудшались. Несколько лет спустя лабораторные тесты выявили, что цинк влияет на белки таким образом, что они образуют сгустки похожие на бляшки, найденные в мозге людей, страдающих болезнью Альцгеймера. Необходимо провести дальнейшие исследования, чтобы выяснить являются ли бляшки истинно причиной заболевания или, они всего лишь стали её результатом.
Симптомы

Симптомы болезни Альцгеймера значительно отличаются у разных людей, но из них можно выделить несколько общих. Симптомы тесно связаны с различными стадиями заболевания.
Ранняя стадия
В этот период (обычно первые 2 – 4 года) симптомы развиваются медленно и могут ошибочно быть приняты за естественный процесс старения. Этот период времени характеризуется ранними признаками потери памяти: забывание имён или событий. Больные люди также могут трудно ориентироваться в пространстве. Отмечаются изменения в личности пациентов и в их поведении. Они больше не в состоянии выполнять повседневные дела.
Поздняя стадия
В эмоциональном плане люди, страдающие болезнью Альцгеймера, становятся всё более подозрительными и превращаются в параноиков. Они больше не в силах контролировать свой гнев, разочарование или плохое поведение и становятся всё более сварливыми, раздражительными и взволнованными. Также они могут странно одеваться и пренебрегать собственным внешним видом.
Конечная стадия
Конечная стадия болезни характеризуется тяжёлыми нарушениями интеллектуальных способностей. Ухудшается физическое состояние, и появляется симптом недержания физиологических процессов (больные не в состоянии контролировать опорожнение кишечника и мочеиспускание). Они больше не способны участвовать в разговоре, невнимательны, допускают много ошибок и отказываются от сотрудничества. На заключительном этапе они не могут заботиться о себе, прикованы к постели или к инвалидной коляске. Часто пациенты не способны питаться самостоятельно и нуждаются в чужой помощи. Смерть, как правило, наступает вследствие пневмонии или другой болезни в момент, когда состояние здоровья значительно ухудшается.
Частота заболевания
Частота заболевания болезнью Альцгеймера тесно связана с возрастом больного и с годами резко увеличивается. 10% всех людей старше 65 лет страдают болезнью Альцгеймера. 50% пациентов - старше 85 лет.
Продолжительность
Средняя продолжительность болезни составляет от шести до восьми лет, но она может прогрессировать в течение нескольких месяцев или продолжаться до 20 лет.
Факторы риска
Основным фактором риска развития болезни Альцгеймера является пожилой возраст. К другим факторам риска относятся зарегистрированные случаи слабоумия в семье больного и предыдущие травмы головы.
Когда обращаться к врачу?
Если у члена семьи или друга появляются симптомы болезни Альцгеймера, необходимо отвести его к врачу. Человек может не понимать, что он или она болен и часто отвергает помощь других людей. Таким образом, больного, возможно, придётся уговаривать обратиться к врачу за помощью.
Диагностика
Важной задачей врача становится диагностирование болезни Альцгеймера среди других излечимых заболеваний со схожими симптомами (такими как гипотиреоз, авитаминоз, гипогликемия, анемия и депрессия). Причиной заболеваний со сходной симптоматикой могут явиться побочные эффекты от назначенных лекарств или опасные сочетания препаратов.
Чтобы проверить есть ли у человека болезнь Альцгеймера, врач сначала должен провести тест на память, а затем физическое обследование, чтобы исключить другие возможные причины психических нарушений пациента. Поэтому клинический диагноз болезни Альцгеймера ставится путём исключения. Следующий шаг включает устные тесты, а также собеседование с членами семьи, хотя эти методы не дают окончательных результатов.
Другие методы исследования включают:
- Анализы крови;
- Сканирование мозга;
- Электрокардиограмму (ЭКГ);
- Электроэнцефалограмму (ЭЭГ).
Сканирование мозга может дать ценную информацию о состоянии мозга. К нему относятся:
Компьютерная томография (КТ) – для исключения заболеваний со схожими симптомами. Компьютерная томография способна выявит изменения, характерные для болезни.
Магнитно-резонансная томография (МРТ) – этот вид сканирования позволяет получить более подробную информацию о структуре и состоянии более глубоких слоёв мозга вблизи кости и может добавить важную диагностическую информацию. Функциональная магнитно-резонансная томография может дать информацию о функционировании мозга, включая участки, подверженные изменениям.
Позитронно-эмиссионная томография (ПЭТ) – новое исследование, которое позволит лучше изучить мозг. Может предоставить информацию о мозговом кровотоке, метаболической активности и распределении специфических рецепторов в мозге. Совсем недавно она стала использоваться для выявления и количественной оценки нервных сплетений и бляшек при помощи радиоактивных веществ, которые связываются с ними.
Однофотонная эмиссионная компьютерная томография (ОФЭКТ) – ещё один метод исследования для выявления нарушений, типичных для болезни Альцгеймера.
Лечение
Болезнь Альцгеймера неизлечима. Некоторые лекарства могут улучшать память и замедлять прогрессирование заболевания на ранних стадиях, другие – могут контролировать изменения настроения и поведенческие проблемы, связанные с болезнью. Цель лечения при болезни Альцгеймера заключается в облегчении симптомов, насколько это возможно.
Медикаментозное лечение
Арисепт (донепезила гидрохлорид), Экселон (ривастигмин) и Реминил (галантамин) действуют путём замедления распада ацетилхолина, химического вещества, которое осуществляет связь между нервными клетками. Эти препараты могут в некоторой степени улучшить память больных с лёгкой или средней формой заболевания.
Абикса (мемантин) блокирует в мозге NMDA-рецепторы глутамата, защищая нейроны от токсического воздействия этого вещества. Были отмечены замедление процесса прогрессирования болезни и улучшение повседневной жизни.
Ряд препаратов может облегчить специфические симптомы. Можно назначит антидепрессанты, успокаивающие, препараты, улучшающие настроение, и другие лекарства (например, антипсихотические).
Домашний уход

Важную роль играет ближайшее окружение человека, страдающего болезнью Альцгеймера. Оно может помочь ему или ей справится с болезнью. Важно, чтобы члены семьи, которые заботятся о человеке в конечной стадии заболевания, принимали это во внимание. Им необходимо изменять окружающую обстановку таким образом, чтобы уберечь больного от стресса из-за изменяющихся факторов среды.
Члены семьи могут сделать следующее:
- Обеспечит сбалансированное питание и достаточное питьё;
- Прятать лекарства и яды;
- Разговаривать с больным посредством простых и коротких предложений;
- Обеспечивать чувство безопасности, сохранять окружающую обстановку знакомой и стабильной, придерживаясь рутинной жизни;
- Необходимо иметь визуальные предметы, которые подсказывают время и место, такие как календари, часы, картины, на которых изображено время года;
- Если Вам надо уйти из дома, то оставьте записки с простыми напоминаниями и указаниями, которым легко сможет следовать Ваш родственник;
- Прикрепляйте этикетки к различным предметам;
- Людям, страдающим болезнью Альцгеймера, необходимо носить идентификационный браслет с номером телефона, так как они склонны блуждать и теряться.
На ранних стадиях заболевания долговременная память сохранена лучше, чем кратковременная, поэтому человек часто наслаждается приятными воспоминаниями из прошлого. Воспользуйтесь семейными фотоальбомами, старыми журналами и любимыми семейными историями, чтобы воскресит эти воспоминания.
Уход за человеком с болезнью Альцгеймера сплачивает членов семьи. Если Вы ухаживаете за больным, то с ухудшающимся состоянием любимого человека Вам поможет справиться занятие обычными делами в доме. В этом отношении неоценима роль группы поддержки и социальных работников.
Профилактика
Предупредить развитие болезни Альцгеймера очень трудно, так как неизвестна причина, которая её вызывает. Хотя возможная причина заключается в генетических дефектах, это не значит, что если у кого-то из членов семьи есть болезнь Альцгеймера, то и у всех остальных родственниках она обязательно будет развиться.
Если Вы беспокоитесь о том, что можете заболеть этим недугом, то лучшее, что Вы можете сделать – это вести здоровый образ жизни. Придерживайтесь сбалансированной диеты и регулярно занимайтесь спортом, чтобы держать своё тело, в том числе и нервные клетки, в форме. Исследования показывают, что у высокообразованных и психически активных пожилых людей риск заболеть этой изнурительной болезнью намного меньше. По возможности не дышите табачным дымом и загрязнённым воздухом. Если Вы постараетесь избежать этих факторов риска, то свёдёте к минимуму воздействия на Ваш организм свободных радикалов (высоко реактивных молекул), которые участвуют в образовании бляшек.
В настоящее время уже не рекомендуется применять высокие дозы витамина Е и Гинкго Билоба.
В целях профилактики болезни Альцгеймера можно принимать Омега-3 жирные кислоты.
Согласно теории о том, что существует связь между уровнем содержания цинка и развитием болезни Альцгеймера, необходимо ежедневно включать в свой рацион продукты, содержащие это вещество. Цинк является важным минералом, однако его передозировка скорее принесёт больше вреда, чем пользы, поэтому ограничивайте его употребление ниже рекомендуемой нормы (15 мг для мужчин и 12 мг для женщин).
Общественная жизнь тоже может защитить Вас от этой болезни.
Не рекомендуется употреблять алкоголь, особенно в избыточных количествах, так как он оказывает нейротоксическое действие.
Последние исследования рекомендуют тем, кто уже в раннем возрасте жалуется на проблемы с кратковременной памятью, выполнять умственные упражнения. Было обнаружено, что у тех, кто регулярно упражняется, увеличивается размер гиппокампа (важной области памяти в мозге). Учёные связывают это с увеличением уровня мозгового нейротрофического фактора - важного химического вещества для нормального функционирования мозга.
Читайте также:


