Имплантация стимулятора диафрагмального нерва







Не удалось дозвониться?
Государственное бюджетное учреждение здравоохранения города Москвы
«Научно-практический центр специализированной медицинской помощи детям имени В.Ф. Войно-Ясенецкого
По рабочим дням с 8.30 до 16.30
Платные услуги: консультации, госпитализация, иные вопросы
По рабочим дням с 8.30 до 16.30
Приёмное отделение стационара
По рабочим дням с 8.30 до 16.30
Колл-центр филиала №2 (КДЦ)
По рабочим дням с 8 до 20
По выходным дням с 9 до 14
+7 (495) 735-09-57
(Канцелярия, ул. Авиаторов, д. 38);
+7 (499) 638-35-00 (Регистратура КДЦ)
+7 (499) 730-98-74
Справочный телефон по вопросам плановой госпитализации
 | +7 (495) 934-17-53, +7 (495) 439-27-10, +7 (495) 539-30-00 |
 | info@npcmed.ru |
 | Москва, ул. Авиаторов, д. 38 |
- Руководство центра
- Общая информация о центре
- Информация о медицинской деятельности
- Сведения о медицинских работниках, включая филиалы
- Немедицинские подразделения
- Попечительский совет
- Учредительные документы. Правовая информация. Патенты
- Контакты
- Вакансии
- Охрана труда

В НПЦ хирурги восстановили дыхательный процесс девушке, установив стимулятор диафрагмального нерва
В НПЦ специализированной медицинской помощи детям ДЗМ выполнена уникальная операция. 07.02.2018 бригада врачей в составе хирурга проф. Заричанского В.А., челюстно-лицевого хирурга Сулейманова А.Б., Саидовой Г.Б. Егиазарян А. К. и анестезиолога Быстровой И.А. провели имплантацию стимуляторов диафрагмальных нервов 17-летней пациентке, страдающей центральным гиповентиляционным синдромом.


По характеру заболевания девушка переставала дышать во время сна, и для спасения жизни ей ежедневно приходилось подключать аппарат искусственного дыхания. Имплантация диафрагмальных стимуляторов позволит ей устранить зависимость от искусственной вентиляции легких и вернуться к полноценной жизни. В настоящее время состояние нашей пациентки удовлетворительное, 12.02.2018 она была выписана домой. Надо подчеркнуть, что это уже пятая операция подобного рода, проведенная в стенах нашего Центра, и первая, которую провёл профессор Заричанский В. А. без участия и консультаций с зарубежными специалистами.


КДЦ (приемная), ул. Авиаторов, д. 22:
+7 (495) 934-17-51
Регистратура КДЦ:
+7 (499) 638-35-00
Канцелярия, ул. Авиаторов, д. 38:
+7 (495) 735-09-57
Любое копирование и размещение материалов сайта на сторонних ресурсах допускается только с прямой ссылкой на материал или на главную страницу сайта.
17 ноября 2016 г. в Научно-практическом центре специализированной медицинской помощи детям ДЗМ им. В.Ф. Войно-Ясенецкого (Москва) была проведена операция по имплантации стимулятора диафрагмального нерва девочке в возрасте 6 лет с центральным гиповентиляционным врожденным синдромом (ЦГВС), или синдромом проклятия Ундины. Это редчайшее (орфанное) генетическое заболевание, при котором отсутствует автономный контроль над процессом дыхания и снижена чувствительность к гипоксии и гиперкапнии. Предположительная распространенность этого состояния составляет 1 случай на 200 тыс. живых новорожденных.
Установка стимулятора диафрагмального нерва поможет ребенку, Марии Б., дышать без помощи аппарата искусственной вентиляции легких (ИВЛ). Технология стимуляции диафрагмального нерва позволяет пациенту стать независимым от ИВЛ, создаёт потенциальную возможность для снятия трахеостомической трубки, повышает мобильность человека и шансы на нормальную продолжительную жизнь.
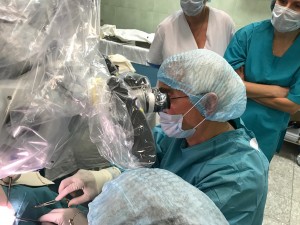
Операцию выполняли хирурги НПЦ: директор Центра, д.м.н., профессор, академик РАЕН, заслуженный врач РФ Андрей Георгиевич Притыко руководил бригадой врачей в составе главного научного сотрудника, д.м.н., профессора, руководителя группы черепно-лицевой области и пластической хирургии ЛОР Владимира Адамовича Заричанского, врача-челюстно-лицевого хирурга, к.м.н. Александра Бекировича Сулейманова. Геннадий Германович Прокопьев, к.м.н., руководитель группы анестезиологии, интенсивной терапии отвечал за респираторную поддержку пациента. Российские врачи работали в сотрудничестве с доктором Доном Хэдли (Don B. Headley, США), одним из самых опытных специалистов в мире по хирургическому восстановлению дыхания. Доктор Хэдли работает отоларингологом в госпитале Святого Иосифа и медицинском центре города Финикс, штат Аризона, и является доцентом кафедры внутренних болезней (Assistant Professor of Internal Medicine) и доцентом кафедры хирургии (Assistant Professor of Surgery) медицинской школы Университета Крейтон Creighton University Medical School) в г. Омаха, штат Небраска.
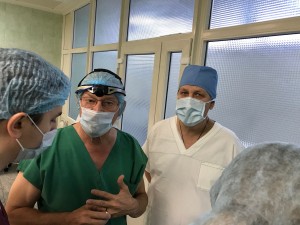




Если ребенку с ЦГВС требуется только ночная вентиляция легких, переход на стимулятор диафрагмального нерва будет эффективен в 100% случаев. Если же необходима круглосуточная поддержка дыхания, переход зависит от возраста и состояния пациента. В том случае, если у пациента сохранены в рабочем состоянии диафрагмальный нерв и дыхательный центр, т. е. по сути весь механизм дыхания, причин для неудач быть не должно.
БАС — боковой амиотрофический склероз — тяжелое заболевание, приводящее к инвалидности и смерти. Болезнь поражает моторные нейроны — клетки нервной системы, отвечающие за двигательные функции. В результате гибели нейронов у пациента с БАС развиваются прогрессирующие параличи и атрофия мышц. На поздних стадиях происходит отказ двигательной мускулатуры, и пациент нуждается в искусственной вентиляции легких. До недавнего времени лечение БАС заключалось в лекарственной терапии, замедляющей прогресс заболевания. Новое изобретение — диафрагмальный стимулятор — позволяет пациентам с боковым амиотрофическим склерозом сохранить способность к самостоятельному дыханию и предупредить развитие респираторной недостаточности. Система диафрагмальной стимуляции одобрена к применению в США и в Израиле. Клиника Шиба — единственный израильский медицинский центр, в котором успешно выполняются имплантации диафрагмальных стимуляторов . Имплантация стимулятора у больных БАС увеличивает продолжительность жизни и значительно улучшает ее качество.
Боковой амиотрофический склероз
Боковой амиотрофический склероз — тяжелое и неизлечимое заболевание, поражающее моторные нейроны передних рогов спинного мозга и коры головного мозга. В результате нарушается иннервация мышц, и человек теряет способность контролировать свои движения. БАС постепенно прогрессирует, поэтому со временем у пациента наступает полный паралич и мышечная атрофия. Дыхательная мускулатура, в том числе диафрагма, также перестает функционировать, и развивается острая респираторная недостаточность. Для поддержания жизни пациент нуждается в подключении к аппарату искусственной вентиляции легких.
Болезнь отнимает у пациентов с БАС по-настоящему ценные моменты жизни: возможность находиться в привычной и уютной домашней обстановке, принимать участие в семейных праздниках, наслаждаться общением с родными и близкими, путешествовать. Новое слово в лечении БАС — диафрагмальный стимулятор NeuRX DPS — приносит в жизнь пациента положительные эмоции, дарит ему независимость. Пациент снова может получать удовольствие от новых впечатлений и приятных запоминающихся событий.
Имплантация диафрагмального стимулятора
- увеличивает продолжительность жизни и помогает сохранить функцию самостоятельного дыхания на более длительный период
- способствует продуктивному сокращению диафрагмальной мышцы
- отодвигает на более поздний срок необходимость в подключении к аппарату искусственной вентиляции легких
- улучшает качество сна
Легкие — часть дыхательной системы. В легких происходит процесс газообмена: кислород из вдыхаемого воздуха всасывается в кровь, а углекислый газ, наоборот, выводится из организма. Кровь, обогащенная кислородом, поступает от легких в сердце, а оттуда по системе артерий распределяется по всем органам тела. Живые клетки нуждаются в кислороде, важном элементе метаболизма. Конечный продукт обмена веществ — углекислый газ — поступает из клеток в венозную кровь, которая притекает к сердцу и легким.
Диафрагма — наиболее важная часть дыхательной мускулатуры. Диафрагма представляет собой мышечную перегородку, отделяющую грудную клетку от полости живота. В момент вдоха головной мозг продуцирует сигнал, вызывающий сокращение диафрагмы. Этот сигнал передается по диафрагмальному нерву. Вследствие сокращения мышечных волокон диафрагма уплощается, немного выдается в брюшную полость, за счет чего объем грудной клетки увеличивается. В грудной клетке создается отрицательное давление, побуждающие легкие расшириться и впустить воздух, поступающий извне.
Диафрагмальный стимулятор — уникальное изобретение, одобренное американской организацией FDA для лечения пациентов с БАС. Показанием к применению диафрагмального стимулятора является наличие БАС и сопутствующей дыхательной недостаточности.
NeuRX DPS состоит из следующих компонентов:
- 4 электрода, которые имплантируют в мышцу диафрагмы
- 1 электрод для подкожной имплантации
- коннектор, соединяющий между собой все 5 электродов
- фиксатор, закрепляющий коннектор на поверхности кожи
- наружный импульсный генератор
Генератор представляет собой устройство, посылающее электрический сигнал к диафрагме. В норме этот сигнал продуцируется головным мозгом и передается через диафрагмальный нерв. Под воздействием электрического импульса диафрагма сокращается, и происходит акт вдоха. По мере использования стимулятора происходит тренировка и укрепление мышечных волокон, входящих в состав диафрагмы.
Генератор настраивают таким образом, чтобы обеспечить пациенту комфортную частоту дыхательных движений. При желании прибор легко отключается нажатием двух кнопок на передней панели. Размер генератора сопоставим с размерами пульта дистанционного управления для телевизора. Он прост в обращении, не занимает места и легко может быть скрыт от посторонних глаз.
Основой для создания прибора послужили результаты работы американского исследователя доктора Ханда. В 90-х годах ХХ века доктор Ханда изучал воздействие электрической стимуляции на мышцы конечностей у больных боковым амиотрофическим склерозом. Стимуляция производилась при помощи миниатюрных подкожных электродов. Доктор Ханда пришел к выводу, что электростимуляция обладает положительным эффектом, как краткосрочным, так и долгосрочным, и замедляет прогрессирование мышечной атрофии. Доктор Ханда не изучал влияние стимуляции диафрагмы на состояние пациентов с БАС, но результаты его исследований стали теоретической базой для клинических испытаний диафрагмального стимулятора NeuRX DPS, о которых будет рассказано ниже.
- Пациенты, использовавшие диафрагмальный стимулятор NeuRX DPS и систему неинвазивной вентиляции легких (например, BIPAP), в среднем прожили на 16 месяцев дольше*, чем те, кто пользовался исключительно системами неинвазивной вентиляции (НВЛ).* — срок измерялся с момента постановки диагноза.
- Средняя продолжительность жизни в группе пациентов с начала момента использования NeuRX DPS + НВЛ на 9 месяцев превышает аналогичный показатель в группе, использовавшей только НВЛ.
- Средняя продолжительность жизни пациентов, перенесших имплантацию диафрагмального стимулятора, и у которых по разным причинам пришлось отказаться от НВЛ, составила 16 месяцев (с момента имплантации).
- У части пациентов была произведена оценка качества сна. У тех, кто на протяжении 4 месяцев использовал диафрагмальный стимулятор, качество сна было лучше по сравнению с периодом, предшествовавшим имплантации.
Чтобы получить лицензию FDA, создатели прибора должны были доказать, что положительный эффект от имплантации стимулятора превышает тяжесть потенциальных рисков и осложнений, связанных с его использованием. Кроме того, необходимо было произвести сравнительный анализ преимуществ и недостатков стимулятора NeuRX DPS с характеристиками других образцов медицинской техники, применяющейся в процессе лечения БАС.
Результаты клинических испытаний продемонстрировали, что основной риск связан непосредственно с процедурой имплантации диафрагмальных электродов.
- Капноторакс. Одним из осложнений процедуры имплантации является капноторакс — проникновение в грудную клетку воздуха, находящегося в брюшной полости. Двум пациентам из 86 человек, принимавшим участие в испытаниях, понадобилось специальное лечение в связи с капнотораксом. Еще у 13 человек это состояние не потребовало никакого лечения, и через некоторое время его симптомы исчезли самостоятельно.
- Реакция на общий наркоз. У одного из пациентов была отмечена тяжелая реакция на анестезию, и процедура была прекращена еще до выполнения разреза кожи.
В Израиле диафрагмальный стимулятор NeuRX DPS получил разрешение Министерства здравоохранения и одобрен к клиническому использованию.
Все электроды выполнены из биосовместимых материалов. Их имплантация осуществляется малоинвазивным методом — в ходе процедуры лапароскопии. Для выполнения лапароскопии производят небольшие разрезы кожи, на которые затем накладывают швы. Хирург исследует состояние диафрагмы, выбирая наиболее подходящие участки для подсоединения электродов. Заживление послеоперационных ран сопровождается определенными болевыми ощущениями. Для облегчения симптомов назначают соответствующие болеутоляющие препараты.
В клинике Шиба имплантацию диафрагмального стимулятора производят в отделении торакальной хирургии. Оперирующий хирург — один из ведущих торакальных хирургов Израиля, доктор Бен Нун. Процедура занимает около 4 часов, а средняя продолжительность госпитализации составляет 3 дня. На сегодняшний день в клинике Шиба успешно выполнено более 10 имплантаций диафрагмального стимулятора у пациентов с БАС. Все процедуры увенчались успехом.
На следующий день после имплантации электроды, от которых отходят наружные провода длиной 3-5 см, подсоединяют к генератору. Генератор настраивают таким образом, чтобы процесс стимуляции диафрагмы был комфортным для пациента. При необходимости настройки корректируют и подбирают удобный режим стимуляции.
Перед выпиской из стационара пациент и его родственники получают подробные инструкции по обращению с прибором и письменное руководство по эксплуатации. Рекомендуется постепенно адаптироваться к стимулятору и использовать его для тренировки диафрагмальной мышцы. В первые недели желательно пользоваться диафрагмальным стимулятором три раза в день по 30 минут. Затем это время можно увеличить, чтобы улучшить вентиляцию легких. Если у пациента наблюдается дыхательная недостаточность во время сна, диафрагмальный стимулятор NeuRX DPS можно использовать по ночам. Также параллельно с диафрагмальным стимулятором можно применять систему неинвазивной вентиляции легких.
На протяжении первых 1-3 недель после имплантации происходит адаптация к диафрагмальному стимулятору, его регулировка и настройка. Пациент должен находиться под наблюдением медицинского персонала, прошедшего специализацию в области интенсивной терапии и реабилитации. Госпитализации в этот период не требуется.
Дышать сами теперь смогут тысячи детей по всей стране. В России проведена первая операция по вживлению стимулятора дыхания - устройства, которое позволит обходиться без громоздкого стационарного аппарата. И для маленькой Камиллы это единственный шанс на реабилитацию после шестилетней комы.
На глазах у мамы Камиллу в 6 лет сбила машина. Она получила настолько тяжелые травмы головного и спинного мозга, что врачи не давали никаких шансов на то, что девочка очнется. Даже советовали отключить ее от систем жизнеобеспечения.
"Мне сказали в Германии, что она и мизинцем не зашевелит. Я как мама не могла смириться и хотела доказать, что будет все наоборот", - рассказывает Лейла Гаджибекова.
Почти 6 лет Камилла находилась в коме, ни на что не реагировала. Все это время мама девочки была рядом, делала массаж, читала книжки и просто разговаривала. В результате малышка очнулась, сегодня она узнает близких и даже улыбается. Для дальнейшей реабилитации необходимо Камиллу отключить от аппарата искусственной вентиляции легких, но самостоятельно она дышать не может.
"Здесь вы видите, что был перелом, постравматические изменения и в этой зоне есть явления прерывания неполного и атрофия спинного мозга, из-за чего ребенок дышать не может", - говорит завотделением реанимации Геннадий Прокопьев.
Благодаря уникальной технологии шанс жить и развиваться нормально получит сегодня Камилла, а потом и тысячи детей по всей стране. В Научно-практическом центре медицинской помощи детям сегодня специалисты из России и США совместно выполнили операцию по имплантации стимулятора диафрагмального нерва.
"Эта система дает возможность не зависеть от аппарата искусственной вентиляции легких, позволяет дышать самостоятельно. Это дает большую свободу", - говорит хирург из США Дон Хэдли.
Устройство имплантируют симметрично с двух сторон через небольшие разрезы. Основная часть стимулятора крепится к диафрагмальному нерву. Электроды, принимающие сигнал, находятся в области ключицы. Вдох происходит благодаря сокращению диафрагмы, самой большой дыхательной мышцы. Стимул поступает из этого устройства, пациент его носит всегда с собой. Параметры выставляют индивидуально и все время корректируют, ведь, по сути, ребенка учат заново дышать.
"Прогресс у нас есть. Мы ходим в специализированный садик, с нами занимаются. У нас сейчас прогресс с речью", - говорит Анна Кокарева.
Разговаривать Илюша пока еще не может, потому что большую часть жизни за него дышал аппарат. Мальчик родился с редкой болезнью — синдромом Ундины. Это неофициальное название патологии, при которой остановка дыхания может произойти ночью во время сна. Два года назад, благодаря помощи зрителей Первого канала и Русфонда, в США мальчику имплантировали стимулятор дыхания. Многие родители уверены, что такое лечение можно получить только в зарубежных клиниках. До этого дня все так и было. Но теперь российские медики говорят, что готовы помочь абсолютно всем здесь, дома.
"В России очень много детей, которые нуждаются в проведении таких оперативных вмешательств. Эта операция положила начало серии других операций в стенах научно-практического центра медицинской помощи детям", - сказал директор НПЦ медицинской помощи детям Андрей Притыко.
Мама Камиллы считает, что даже в самой тяжелой ситуации не стоит опускать руки. Каждая улыбка её девочки, а теперь и каждый ее самостоятельный вдох - это их маленькие, но такие долгожданные победы, которые делают их жизнь счастливее.
Электрическая стимуляция диафрагмальных нервов
Искусственной вентиляцией легких (ИВЛ) называют обеспечение газообмена между окружающим воздухом (или специально подобранной смесью газов) и альвеолярным пространством легких искусственным способом. Основными задачами ИВЛ в интенсивной терапии являются обеспечение адекватного метаболическим потребностям организма газообмена в легких и полное освобождение больного от работы дыхания. Вспомогательной вентиляцией легких (ВВЛ) принято называть поддержание заданного (или не ниже заданного) минутного объема вентиляции при сохраненном дыхании больного.Основными задачами ВВЛ являются поддержание адекватного газообмена в легких, уменьшение работы дыхания, а также облегчение перехода больного от ИВЛ к самостоятельному дыханию.Основным методом ИВЛ в настоящее время является вдувание газа в дыхательные пути. Но не меньший интерес вызывает проблема управления функцией внешнего дыхания путем ритмической электрической стимуляции диафрагмальных нервов (ЭСДН) и диафрагмы (ЭСД).
Электрическая стимуляция диафрагмального дыхания
Методика проведения чрескожной электрической стимуляции диафрагмального дыхания
Большинство пациентов отмечали состояние комфорта при длительности 0,5—0,8 мс. Мы отметили, что у больных с выраженной эмфиземой легких приходилось задавать наибольшие напряжение и длительность импульсов. Иногда у больных может возникать кратковременное головокружение, связанное с избыточной вентиляцией легких. В этом случае рекомендуется уменьшить частоту дыхания, генерируемую аппаратом так, чтобы она была на 10—20 % меньше частоты самостоятельного дыхания. При собственной частоте дыхания больше 20 в минуту следует устанавливать частоту импульсов близкой к частоте дыхания пациедта, а для исключения гипервентиляции уменьшать амплитуду тока до 80—90 % от субмаксимального уровня. Продолжительность первого сеанса обычно составляет 15— 20 мин, последующих, в зависимости от переносимости процедуры, — 20—30 мин. Частота проведения сеансов —1—2 в сутки. Для повышения эффективности чрескожной ЭСД рекомендуется сочетать ее с ингаляцией кислорода и ультразвуковой аэрозольной терапией. Предложены различные составы для ингаляций, например: раствор йо-дида калия 3 % — 7,0 мл раствор эуфиллина 2,4 % — 2,0 мл раствор эфедрина 5% —0,5 мл ИВЛ (в первую очередь при катетерном способе) и необходимого мониторинга является важной задачей.
Роль этих факторов существенно возрастает при проведении длительной струйной ВЧ ИВЛ. При инжекционной ВЧ ИВЛ проблемы кондиционирования могут быть достаточно успешно решены за счет эжекции аэрозоля, горячего пара (при коммутации аэрозольного ингалятора или увлажнителя-обогревателя с инжектором) или гипербарического кондиционирования, при чрескатетерной струйной ВЧ ИВЛ — путем использования гипербарического кондиционирования, а при проведении ВЧ ВВЛ — за счет ингаляции теплого аэрозоля пациентами, находящимися в сознании. Рекомендуется также сочетать сеансы ЭСД с массажем грудной клетки и лечебной физкультурой, стационарной фибробронхоскопией, физиотерапевтическими процедурами, направленными на ослабление воспалительного процесса в бронхах. Таким образом, для ЭСД характерно:
- частота дыхания полностью определяется больным;
- дыхательный объем несколько увеличен за счет увеличения амплитуды движения диафрагмы;
- работа дыхания не уменьшается, а несколько увеличивается.
Если параметры чрескожной ЭСД подобраны правильно, во время сеанса больной не отмечает никаких неприятных ощущений. Наоборот наступает состояние покоя, расслабленности. Многие пациенты во время сеанса засыпают, у них уменьшается частота дыхания, менее выражено ощущение нехватки воздуха. При откашливании облегчается отхождение мокроты. Непосредственно после сеанса ЭСД несколько улучшаются спирографические показатели и РО2 капиллярной крови. Однако эффект от одного сеанса ЭСД нестоек и перед следующим сеансом основные параметры дыхания возвращаются к исходным величинам. Более стойкое улучшение наступает после 5 – 6 сеансов. В раннем периоде после полостных оперативных вмешательств у больных, которым до операции применяли ЭСД, быстрее восстанавливается спонтанное дыхание. Своеобразная тренировка дыхания во время сеансов ЭСД позволяет больным в послеоперационном периоде легче контролировать процесс вентиляции легких, периодически увеличивать дыхательный объем и откашливать мокроту. Методика ЭСД во время операций не отличается от общепринятой. Для поддержания стабильного эффекта рекомендуется постепенно увеличивать амплитуду напряжения, а в раннем послеоперационном периоде для облегчения синхронизации с электростимулятором проводить процедуру в положении Шеде (с согнутыми в коленях ногами).
Электростимулятор дыхания ЭСД-2П
Электростимулятор дыхания ЭСД-2П (рис. 2.17) представляет собой переносной прибор настольного типа, конструктивно выполненный в виде двух блоков, габариты каждого блока 25 × 25 × 13 см, общая масса аппарата не превышает 5 кг. На лицевой панели каждого из блоков размещены ручки и кнопки для подбора выходных параметров. Первый блок служит для регулирования выходных энергетических сигналов: амплитуды импульсов от 0 до 20 мА и напряжения от 0 до 50 В в зависимости от применяемого типа электростимуляции. На лицевой панели второго блока расположены два ряда кнопок, по 10 кнопок в каждом. Они служат для установления длительности одиночного импульса от 0,1 до 1,0 мс (верхний ряд) и частоты следования пачек импульсов (частота дыхания) с дискретным регулированием от 10 до 56 циклов в минуту. Принципиальным для электростимуляции дыхания является, как происходит заполнение пачек импульсов, от этого зависит характер сокращения диафрагмы и вдоха — будет ли он достаточно плавным или резким, тетанического типа.

Рис. 1. Электростимулятор дыхания ЭСД-2П.
Использование реографических методов для оценки интенсивности дыхания
Реография – это бескровный метод исследования кровоснабжения различных органов, основанный на регистрации изменения электрического сопротивления тканей органов человека помещенных в электрическое поле или включенных в электрическую цепь. Биофизически основой этого метода является зависимость сопротивления тканей органов от изменения объёма и состава крови в исследуемом участке тела человека. Измеренный при реографических исследованиях полный импеданс состоит из переменной и постоянной составляющих. При исследовании гемодинамики информативной является переменная составляющая (пульсовой импеданс). Имеются сообщения об использовании при реографии значений постоянной составляющей компоненты сопротивления (базового импеданса) грудной клетки. По мнению большинства специалистов величина базового импеданса (R) определяется видом и объёмом биологических тканей, заключенных в межэлектродном пространстве. При этом одни из них (жировая клетчатка, сердце, костная, лёгочная и соединительная ткани) обладают относительным постоянством при формировании базового импеданса, другие (биологические жидкости и альвеолярный воздух) являются наиболее изменяющимися компонентами базового импеданса. Эти данные позволяют использовать величину базового импеданса как для суждения об уровне давления в лёгочной артерии, так и для оценки изменения насыщения крови и альвеол кислородом, зависящей от интенсивности дыхания. При таких исследованиях целесообразно использовать отношение расчетного и истинного базовых импедансов, условно названное индексом базового импеданса (ИБИ). Величина расчетного базового импеданса определяется исходя из формулы:

Где ρ - удельное сопротивление крови (Ом * см), l – расстояние между электродами, V – межэлектродный объём биоткани. Считаем в первом приближении объём биоткани пациента в межэлектродном пространстве близким к цилиндрическому. Исходя из этого получаем:

Где с – окружность грудной клетки в состоянии выдоха на уровне мечевидного отростка грудины (см). Величина истинного базового импеданса вычисляется по формуле:
Чрескожную ЭСД проводят с помощью электростимулятора дыхания ЭСД-2П. Перед началом лечения с больным следует провести беседу для ознакомления его с методикой и обучения синхронизации собственного дыхания с работой электростимулятора.
Для ЭСД используют четыре сетчатых плоских электрода, которые входят в комплект аппарата.
Процедуру выполняют натощак или через 1,5—2 ч после еды в положении больного лежа на спине.
Наложение электродов. На поверхность электродов наносят тонкий слой токопроводящей пасты (можно использовать пасту для электродов ЭКГ) или накладывают марлевые салфетки, смоченные изотоническим раствором хлорида натрия. Два катода (активные электроды) накладывают в седьмом межреберье кнаружи от срединно-ключичной линии симметрично с обеих сторон. Электроды должны плотно прилегать к коже. Для этого в зависимости от формы грудной клетки их можно сдвинуть на 2—3 см в ту или другую сторону по ходу межреберья. Два анода (пассивные электроды) накладывают на спину на уровне Thx по горизонтали и так, чтобы они находились напротив катодов (расположенных спереди) по вертикали. Электроды закрепляют резиновым ремнем.
При неэффективности процедуры можно поменять расположение электродов (катоды сзади, аноды спереди).
дыхания пациента снижается, частоту импульсов также следует уменьшить.
Подбор напряжения (от 10 до 50 В) осуществляют путем постепенного его повышения, до появления у больного ощущения сокращения диафрагмы, синхронно с началом спонтанного вдоха, обязательно (!) совпадающего с сигналом аппарата. Обычно при повышении напряжения вначале начинают слегка сокращаться мышцы передней брюшной стенки, а затем появляется глубокий вдох, свидетельствующий об активизации диафрагмы. При появлении ощущения покалывания в местах наложения электродов необходимо уменьшить напряжение. Чаще всего напряжение подбирают в диапазоне от 20 до 50 В. Однако у некоторых больных на протяжении сеанса может наступить привыкание диафрагмы к электрическому раздражению и дыхательный объем уменьшается. При этом следует несколько повысить напряжение импульса.
В наших наблюдениях длительность импульса также подбирали индивидуально, в зависимости от ощущений больного. Большинство пациентов отмечали состояние комфорта при длительности 0,5—0,8 мс. Мы отметили, что у больных с выраженной эмфиземой лёгких приходилось задавать наибольшие напряжение и длительность импульсов.
Иногда у больных может возникать кратковременное головокружение, связанное с избыточной вентиляцией лёгких. В этом случае рекомендуется уменьшить частоту дыхания, генерируемую аппаратом так, чтобы она была на 10—20 % меньше частоты самостоятельного дыхания. При собственной частоте дыхания больше 20 в минуту следует устанавливать частоту импульсов близкой к частоте дыхания пациента, а для исключения гипервентиляции уменьшать амплитуду тока до 80—90 % от субмаксимального уровня.
Продолжительность первого сеанса обычно составляет 15— 20 мин, последующих, в зависимости от переносимости процедуры, — 20—30 мин. Частота проведения сеансов — 1—2 в сутки.
Для повышения эффективности чрескожной ЭСД рекомендуется сочетать её с ингаляцией кислорода и ультразвуковой аэрозольной терапией.
Предложены различные составы для ингаляций, например:
раствор йодида калия 3 % — 7,0 мл
раствор эуфиллина 2,4 % — 2,0 мл
раствор эфедрина 5 % — 0,5 мл ! i
раствор димедрола 1 % — 0,5 мл
йодид калия можно заменить раствором фурагина 1:13 000 —
Рекомендуется также сочетать сеансы ЭСД с массажем грудной клетки и лечебной физкультурой, санационной фибро-бронхоскопией, физиотерапевтическими процедурами, направленными на ослабление воспалительного процесса в бронхах.
Таким образом, для ЭСД характерно:
— частота дыхания полностью определяется больным;
— дыхательный объем несколько увеличивается за счет увеличения амплитуды движения диафрагмы;
— работа дыхания не уменьшается, а несколько увеличивается.
Если параметры чрескожной ЭСД подобраны правильно, во время сеанса больной не отмечает никаких неприятных ощущений. Наоборот, наступает состояние покоя, расслабленности. Многие пациенты во время сеанса засыпают, у них уменьшается частота дыхания, менее выражено ощущение нехватки воздуха. При откашливании облегчается отхождение мокроты. Непосредственно после сеанса ЭСД несколько улучшаются спирографические показатели и РО% капиллярной крови.
Однако эффект от одного сеанса ЭСД нестоек и перед следующим сеансом основные параметры дыхания обычно возвращаются к исходным величинам. Более стойкое улучшение наступает через 5—6 сеансов.
В раннем периоде после полостных оперативных вмешательств у больных, которым до операции применяли ЭСД, быстрее восстанавливается спонтанное дыхание. Своеобразная тренировка дыхания во время сеансов ЭСД позволяет больным в послеоперационном периоде легче контролировать процесс вентиляции лёгких, периодически увеличивать дыхательный объем и откашливать мокроту.
Высокая эффективность ЭСД отмечена у больных ХОЗЛ в стадии обострения: улучшается общее состояние, возрастают ЖЕ Л и MB Л, снижается степень обструкции бронхов [Мана-кова Е.Н., 1987; Караилов А.И., 1994]. У больных, у которых отсутствовали признаки декомпенсации кровообращения, отмечено снижение давления в легочной артерии на 8 %, повышение эластичности легочно-артериального русла на 40 % , увеличение ударного индекса на 33 %. Данные стимуляцион-ной электромиографии свидетельствуют об улучшении функционального состояния диафрагмы. У больных с признаками недостаточности кровообращения ЭСД неэффективна [Пале-ев Н.Р. и др., 1994; Туранова З.Р., 1996].
Достаточно эффективной оказалась чрескожная ЭДС и при оперативных вмешательствах, выполняемых в условиях внут-фивенной анестезии [Климов А.Г., Левшанков А.И., 1993; Hedenstierna G. et al., 1994]. Методика ЭСД во время операции не отличается от общепринятой. Для поддержания стабильного эффекта рекомендуется постепенно увеличивать амплитуду напряжения, а в раннем послеоперационном периоде для облегчения синхронизации с электростимулятором проводить процедуру в положении Шеде (с согнутыми в коленях ногами).
Читайте также:


