Взаимоотношения артерий и нервов
Топография сосудов и нервов переднего фасциального ложа плеча. Расположение нервов и сосудов на плече.
В верхней трети плеча n. medianus располагается рядом с артерией латерально от нее. Медиально от артерии лежит n. ulnaris и еще медиальнее — n. cutaneus antebrachu medialis. Кнутри от основного пучка наиболее медиально и поверхностно лежит v. basilica, которая присоединяется к пучку на границе верхней и средней трети, сразу по выходе из канала Пирогова. В верхней трети плеча эта вена впадает либо в одну из плечевых вен, либо переходит в подмышечную область и впадает в подмышечную вену (рис. 3.17).
N. musculocutaneus выходит с латеральной стороны клювовидно-плечевой мышцы, которую он прободает на пути из подмышечной ямки на переднюю поверхность плеча, и уходит под длинную головку двуглавой мышцы плеча, а на границе со средней третью ложится на глубокую фасцию, покрывающую плечевую мышцу. На своем пути он отдает ветви ко всем мышцам переднего фасциального ложа.
На границе передней области плеча и подмышечной области сразу ниже нижнего края сухожилия широчайшей мышцы спины позади артерии определяется крупный ствол n. radialis. Почти сразу он направляется в заднее фасциальное ложе между длинной и латеральной головками трехглавой мышцы плеча.
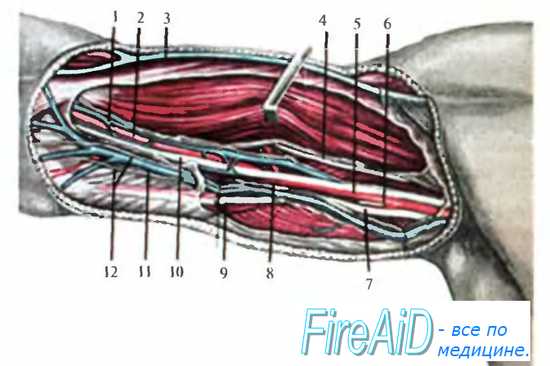
Рис. 3.17. Передневнугренняя поверхность плеча. 1 — v. brachialis; 2, 5 — a. brachialis; 3 — v. cephalica; 4 — n. musculocutaneus; 6 — a. profunda brachii; 7 — n. radialis; 8 — канал Пирогова; 9 — n. ulnaris; 10 —n. medianus; 11 — v. basilica; 12 — n. cutaneus antebrachii medialis.
Плечевая артерия в верхней трети плеча отдает крупную ветвь — глубокую артерию плеча, a. profunda brachii, которая почти сразу уходит вместе с лучевым нервом в заднее фасциальное ложе. На границе верхней и средней трети плеча от плечевой артерии отходит еще одна ветвь: верхняя локтевая коллатеральная артерия, a. collateralis ulnaris superior, которая далее сопровождает локтевой нерв.
В средней трети плеча n. medianus располагается спереди от плечевой артерии (перекрещивая ее).
N. ulnaris смещается еще более медиально от артерии и на границе с верхней третью прободает медиальную межмышечную перегородку, переходя в заднее ложе плеча. Вместе с ним идет и а. collateralis ulnaris superior.
N. cutaneus antebrachii medialis также покидает переднее фасциальное ложе, входя в расщепление собственной фасции (канал Пирогова), откуда в подфасциальное пространство выходит v. basilica.
N. musculocutaneus направляется косо сверху вниз и изнутри кнаружи между двуглавой и плечевой мышцами.
В нижней трети плеча n. medianus располагается уже медиальнее артерии, но рядом с ней. От артерии здесь отходит еще одна ветвь: a. collateralis ulnaris inferior. Она идет косо вниз по поверхности плечевой мышцы в локтевую область (название артерии не связано с локтевым нервом, которого в переднем ложе уже нет, а обозначает лишь локтевую сторону конечности), где принимает участие в образовании локтевой коллатеральной сети.
С латеральной стороны нижней трети плеча в переднем ложе вновь появляется n. radialis. который прободает латеральную межмышечную перегородку и переходит из заднего ложа в переднее. Он располагается глубоко между мышцами: плечевой и латеральной головкой трехглавой. На границе с локтевой областью он лежит столь же глубоко, но уже между плечевой и плечелучевой мышцами. В этих межмышечных щелях нерв идет в сопровождении лучевой коллатеральной артерии, a. collateralis radialis, — конечной ветви a. profunda brachii.
Таким образом, в пределах переднего фасциального ложа плеча на всем протяжении проходят лишь плечевая артерия с венами (ближе всего к кости), срединный нерв и мышечно-кожный нерв. Срединный нерв на плече ветвей не дает. Остальные сосудисто-нервные образования переходят либо в заднее ложе (лучевой нерв с глубокой артерией плеча в верхней трети, локтевой нерв с верхней локтевой коллатеральной артерией в нижней трети), либо в подкожную клетчатку плеча.
Анатомо-топографические взаимоотношения кровеносных сосудов и нервов в различных частях тела и органа
Колоколова Анастасия Андреевна
доц. Мельников Игорь Иванович
Содержание
1. Различия в формировании, ходе, ветвлении и связях кровеносных сосудов и нервов……………………………………………………………………………3
3. Общее положение топографии кровеносных сосудов……………………….5
4. Основные принципы коллатерального кровообращения……………………6
Различия в формировании, ходе, ветвлении и связях кровеносных сосудов и нервов
Закономерности распределения артерий
1. Артерии располагаются по ходу нервной трубки и нервов.
2. Артерии делятся на париетальные (к стенкам полостей тела) и висцеральные (к содержимому их, т.е. к внутренностям).
3. Каждая конечность получает один главный ствол.
4. Артерии туловища сохраняют сегментарное строение.
5. Большая часть артерий располагается по принципу двухсторонней симметрии: парные артерии сомы и внутренностей.
6. Артерии идут вместе с другими частями сосудистой системы – с венами и лимфатическими сосудами, образуя общий сосудистый комплекс (пучок).
7. Артерии идут соответственно скелету, составляющему основу организма.
Форма ветвления бедренной артерии
А) Рассыпная форма ветвления
Б) Магистральная форма ветвления
Закономерности распределения вен
1. В венах кровь течет в большей части тела (туловище и конечности) против направления действия силы тяжести и потому медленнее, чем в артериях.
2. Венозное русло в своей массе значительно шире, чем артериальное.
Большая ширина венозного русла по сравнению с артериальным обеспечивается большим калибром вен, большим их числом, парным сопровождением артерий, наличие вен не сопровождающих артерии, большим количеством анастомозов и большей густотой венозной сети, образованием венозных сплетений и синусов наличием воротной системы в печени.
3. Глубокие вены, сопровождающие артерии, при своем распределении подчиняются тем же законам, что и сопровождаемые ими артерии, при этом в большинстве случаев одну артерию сопровождают две вены.
4. Вены идут по кратчайшему расстоянию, т.е. приблизительно по прямой линии, соединяющей место происхождения данной вены с местом впадения ее.
5. Венозные сплетения встречаются главным образом на внутренних органах, объем которых изменяется, но располагаются в полостях с неподатливыми стенками и облегчают отток венозной крови. Этим объясняется обилие венозных сплетений вокруг органов малого таза, в позвоночном канале, где постоянно колеблется давление спиномозговой жидкости, и в других аналогичных местах при увеличении органов и сдавлении их стенки.
6. В полостях черепа, где мельчайшее затруднение венозного оттока отражается на функции головного мозга, имеются, кроме вен, специальные приспособления – венозные синусы с неподатливыми стенками, образованными твердой мозговой оболочной.
7. К специальным приспособлениям относятся вены, расположенные в каналах diploe – venae diploicae.
8. У человека в связи с вертикальным положением тела ряд вен имеют клапанны, особенно в нижних конечностях.
Закономерности распределения нервов
1. Соответственно группировке органов тела вокруг нервной системы нервы расходятся стороны о срединной линии, на которой располагается центральная нервная система.
2. Соответственно строению тела по принципу двусторонней симметрии нервы являются парными и идут симметрично.
3. Соответственно метамерному строению туловища нервы этой области сохраняют сегментарное строение.
4. Нервы идут по кратчайшему расстоянию от места выхода из спинного или головного мозга к органу.
Три закона Пирогова
Первый (основной) закон
Все сосудистые влагалища образованны фасциями мышц, расположенных возле сосудов.
Задняя стенка влагалища мышцы является, как правило, передней стенкой влагалища сосудисто-нервного пучка, проходящего возле этой мышцы.
Второй закон
Если натянуть стенки мышечных влагалищ, имеющих отношение к сосудам, то форма артериальных влагалищ представится призматической, а в поперечном разрезе – треугольной.
Третий закон
Вершина призматического влагалища, как правило, прямо или опосредованно соединяется с близлежащей костью или капсулой сустава.
Общее положение топографии кровеносных сосудов
Сосудисто-нервный пучок (нерв, артериальные и венозные стволы и лимфатические сосуды) представляет собой анатомически и функционально единое целое.
Между компонентами сосудисто-нервного пучка существует взаимосвязь: нервы обеспечивают иннервацию соседних артерий, вен и лимфатических сосудов, артерия снабжает перечисленные образования кровью, в вены и лимфатические сосуды происходит венозный и лимфатический отток из всего пучка в целом.
Различия во внешнем строении нервов, артерий и вен
1. Артериальный ствол в составе сосудисто-нервного пучка, как правило, имеет меньший диаметр, чем сопровождающая его вена, но более плотную и толстую стенку.
2. При повреждении просвет артерии зияет, впросвет вены чаще спавшийся.
3. На конечностях артерию сопровождают две вены.
4. Нервный ствол имеет более светлую окраску, никогда не спадается при сдавлении и не имеет пульсации.
Сосудисто-нервный пучок
1. Сосудисто-нервный пучок располагается на сгибательных поверхностях тела.
2. Крупные сосудисто-нервные пучки находятся в укрытых местах, в желобах и каналах, образованных костями, мышцами и фасциями.
3. На фасциях в местах, соответствующих межмышечным промежуткам и расположениям сосудисто-нервных пучков видны беловатые полоски.
У относительно крупных артерий, вен и нервов почти всегда есть собственные фасциальные влагалища разной степени выраженности, которые составляют единый комплекс с общими фасциальными влагалищами сосудисто-нервных пучков.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Литвиненко Л. М.
12. Синяк Ю.Е. и др. // Авиакосм. и экол. медицина.- 1999.— № 1.— С. 56—59.
13. Bild W. // Rom. J. Physiol.— 1999.— Vol. 36, № 3—4.— Р. 205—218.
14. Петров Р.В. Иммунология и иммуногенетика.— М., Медицина, 1976.— 335с.
D.E. GRIGORENKO, D.V. RAKOV, M.R. SAPIN, B.S. FEDORENKO Summary
- rays on 1-t and 3-d days. The positive influence of LW is the tendency to processes of restoration in the cooperation of lymphoid cells to 3-d day of experiment, in comparison with 1-t day. It was established that the content of blasts in proliferation cells and the content of plazmacyties in organ’s white pulp less, than in intact group, 3 days after using gamma - rays. These results testify the reduction of lym-phocytopoiezis and immunocytopoiezis in the spleen and, according to this, the falling of the humoral immunity at animal’s organism, after gamma - rays influence.
Key words: light water, lymphocytopoiezis
О СОСУДИСТО-НЕРВНЫХ КОМПЛЕКСАХ И ФОРМИРОВАНИИ СОСУДИСТО-НЕРВНЫХ ПУЧКОВ
Артерии, вены, лимфатические сосуды и нервы (соматические и вегетативные) идут, как правило, вместе, образуя сосудисто-нервные комплексы [1]. Пока анатомия и топографическая анатомия не располагает научными данными о сосудистонервных комплексах, включающих все 4 компонента. Изучены отдельно артериальная, венозная, лимфатическая и нервная системы. Научных работ, посвященных изучению одновременно артерий, вен, лимфатических сосудов и нервов, а также формированию сосудисто-нервных структур, практически нет. Для того, чтобы это изучить, надо понять закономерности образования сосудисто-нервных структур, особенности взаимоотношений их компонентов, различные их формы.
Цель работы - попытка решения некоторых из этих проблем на основании собственных наблюдений при препарировании сосудов и нервов на трупах и анализа разрозненных данных научной и учебной литературы 2.
Сосудисто-нервный комплекс (СНК) - это анатомический и функциональный комплекс образований, включающий в себя артерию, вену, лимфатический сосуд и нерв, находящиеся в рыхлой соединительной ткани. СНК - это структура, обеспечивающая сосудисто-нервное снабжение органов и тканей, к которым направляется или в которых располагается, а также это самообеспечивающаяся морфологическая структура. Сосудистонервное снабжение СНК обеспечивается за счет vasa vasorum, vasa nervorum, nervi vasorum, nervi nervorum, отходящих от компонентов СНК. СНК могут быть в виде всем известных сосудисто-нервных пучков (СНП) [9], которые располагаются в основном на конечностях, в межреберьях. Второй крайней формой СНК является сетчатая форма - т.н. сосудисто-нервные сети (СНС), которые встречаются, например, на микроциркуляторном уровне, в подкожной клетчатке. Между этими двумя крайними формами изменчивости можно выделить промежуточную форму СНК - смешанную форму, когда в одном сосудисто-нервном комплексе можно наблюдать и СНС и СНП. Например, на лице
имеется два СНП: латерально расположенный СНП, образованный наружной сонной артерией с симпатическим сплетением, занижнечелюстной веной, лимфатическими сосудами, и медиально расположенный СНП, образованный лицевой артерией с симпатическим нервным сплетением, лицевой веной и лимфатическими сосудами. Эти продольно расположенные СНП пересекаются поперечно ветвями лицевого нерва. Перпендикулярно в эту сеть из клыковой ямки верхней челюсти проникают ветви подглазничного СНП. В результате образуется своеобразная объемная СНС на лице. В подкожной клетчатке верхней конечности на фоне СНС образуются медиальный и латеральный подкожные СНП, а на нижней конечности - большой и малый подкожный СНП. В СНК может входить различное количество сосудов (артериальных, венозных, лимфатических) и нервов соматических и вегетативных. Количественные соотношения компонентов СНК могут быть различными. В зависимости от количества компонентов можно выделить: оптимальный, упрощенный, усложненный СНК.
Оптимальный СНК содержит 4 компонента: артериальный, венозный, лимфатический и нервный. И неважно, какое число отдельных компонентов, а также какие нервы входят в состав СНК - соматические или вегетативные. Это, например, межреберные и все глубокие СНП, расположенные на конечностях.
Упрощенный СНК имеет Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
1. Литвиненко Л.М. // Рос. морфол. ведомости.- М.- 1996.-№ 215.- С. 100-102
2. А.С.Вишневский, А.НМаксименков. Атлас периферической нервной и венозной систем / Под ред. В.Н.Шевкуненко.-Медгиз.- 1949.- 383 с.
3. Синельников Р.Д., Синельников Я.Р. Атлас анатомии человека.- М.:Медицина.- 1996.- С. 3-4.
4. Корнинг Г.К. Топографическая анатомия.- Биомедгиз.-1936.- 791 с.
5. Валькер Ф.И. и др. Краткий курс оперативной хирургии и топографической анатомии / Под ред. В.Н.Шевкуненко, А.Н.Максименкова.- Л.: Медгиз.- 1951.- 795 с.
6. Johannes W. et at. Color atlas of anatomy.- Philadelphia -Baltimore - New York - London - Buenos Aires - Hong Kong -Sydney - Tokyo.-2002.- 500 c.
7. Anne M.R. et at. Grants atlas of anatomy. // Baltimore -Philadelphia - Hong Kong - London - Munich - Sydney - Tokyo.-1991.- 650 c.
8. Pernkopf Anatomie. Atlas der topographischen und angewandten Anatomie des Menschen. Herausgegeben von W. Platzer // München - Wien - Baltimore.- 1987.- 1 Band.- 372 p.- 1989.- 2 Band - 408 p.
9. E.M3. // 1984.- T.23.- C. 538
МИКРОЭЛЕМЕНТНЫЙ СПЕКТР ВОЛОС И ТИРЕОИДНЫЙ СТАТУС У
БОЛЬНЫХ ЗОБОМ, ПРОЖИВАЮЩИХ В РАЗЛИЧНЫХ ГЕОХИМИЧЕСКИХ УСЛОВИЯХ
А.Ж. ГИЛЬМАНОВ, В.В. СПЕРАНСКИЙ, Л.М. ФАРХУТДИНОВА *
Введение. Причина развития эндемического зоба принадлежит йодному дефициту. Патогенетическую значимость имеют изменения содержания в организме ряда микроэлементов, влияющих на синтез тиреоидных гормонов либо на обмен йода [1, 3-4, 6]. Раз микроэлементный состав биосферы зависит от геологического строения местности [7], изучение взаимосвязи микроэлементного статуса больных зобом с особенностями геологической среды проживания является актуальным. Химический состав горных пород, почвы, воды, продуктов питания в различных районах Башкортостана изучался многими специалистами [2, 5, 8]. Особенности микроэлементного состава биосферы согласуются с закономерностями распределения элементов-примесей в горных породах.
Цель работы - оценка информативности микроэлементно-го спектра волос в части геохимических условий местности.
* Башкирский госмедуниверситет, 450000, Уфа, ул. Ленина, 3
NEUROVASCULAR RELATIONSHIPS IN HEMIFACIAL SPASM
Yu. A. Grigoryan, A. R. Sitnikov
The article describes our results of surgical treatment of 37 patients suffered from hemifacial spasm (HS) as well as results of the morphological studies of facial nerve root exit zone (REZ). The morphological studies showed that the length of central myelin covered zone was between 0.9 and 3.6 mm long (mean - 2.24 mm). This zone didn’t spread longer than 1.1 facial nerve diameter. Intra- operatively 27 cases of compression by a single vessel and 9 cases of multiple vessels compression were found. In cases of a single vessel compression the compression was due to AICA in 11 cases, due to PICA - 12 cases and due to VA – 4 cases. In 35 cases we achieved the full decompression of facial nerve REZ. In one case the complete decompression was not possible because the penetration of the vestibular nerve by AICA, what made manipulations on this artery and on facial nerve almost impossible. Excellent results of surgical treatment achieved in 33 patients. One patient had unsatisfied outcome as mentioned above. There were no serious complications after the surgical procedure. A vascular decompression is a highly effective and relatively safe method of treatment of HS. Hemifacial spasm occurs due to compression of facial nerve’s central myelin covered zone, so the surgical decompression must be done close to REZ nearby brain stem.
Введение. Гемифациальный спазм (ГС) или болезнь Бриссо (Brissand) представляет собой нервно-мышечное заболевание, проявляющееся безболезненными односторонними насильственными клонико-тоническими сокращениями лицевой мускулатуры. Согласно P. J. Jannetta основополагающим фактором в возникновении “гиперфункциональных синдромов краниальных нервов”, включая гемифациальный спазм, является сдавление парастволовой входной/выходной зоны соответствующего нервного корешка [3, 10-12, 16]. Исследования микрохирургической анатомии корешков черепных нервов мостомозжечкового угла, показало значительную вариабельность взаиморасположения комплекса VII VIII нервов и прилежащих сосудов [10, 19, 21]. Микрохирургическая эксплорация структур мостомозжечкового угла на стороне поражения у пациентов с ГС в подавляющем большинстве случаев выявляет сосудистую компрессию корешка лицевого нерва в зоне его выхода из ствола головного мозга. Эффективность васкулярной декомпрессии в лечении ГС зависит от правильной идентификации сдавливающего сосуда, топографические взаимоотношения которого с корешком лицевого нерва имеют четкие отличительные черты, позволяющие подтвердить наличие нейроваскулярного конфликта. Неадекватная микрохирургическая эксплорация парастволового отдела лицевого нерва и неправильная идентификация сдавливающего сосуда приводят к увеличению числа осложнений и ухудшению результатов лечения ГС [1-5, 9-13, 15-20, 23]. Волокна парастволовых отделов нервных корешков окружены миелином центрального типа, образованным олигодендроглией (глиальный конус), а относительно дистальные отделы нервных волокон покрыты миелином периферического типа, сформированного Шванновскими клетками. Центральный тип миелина является менее прочным, легче подвергается разрушению при различных компрессионных воздействиях, и поэтому, сосудистое или опухолевое сдавление нервного корешка на уровне его глиального сегмента, приводит к локальной демиелинизации с последующим рядом патофизиологических феноменов, формирующих клиническую картину заболевания [1, 6, 17].
Цель настоящего исследования заключается в исследовании протяженности выходной зоны корешка лицевого нерва из ствола головного мозга, а также в оценке нейроваскулярных взаимоотношений и эффективности сосудистой декомпрессии у пациентов с ГС.
Материалы и методы. Проведено исследование 20 корешков лицевого нерва на 10 препаратах ствола головного мозга, извлеченных во время аутопсии у пациентов (6 женщин и 4 мужчин, в возрасте 60-71 лет), при жизни не страдавших заболеваниями центральной нервной системы. Для последующего исследования оставляли поперечный срез ствола головного мозга с исходящими из него волокнами лицевых нервов. Полученные после фиксации и заливки тонкие срезы окрашивались гематоксилином-эозином и по Ван-Гизону для идентификации в корешке лицевого нерва сегментов с центральным типом миелинизации. Протяженность глиального конуса измерялась от поверхности ствола головного мозга вдоль лицевого нерва до начала участка со Шванновским (периферическим) типом миелина. Анализ нейроваскулярных взаимоотношений проведен у 37 пациентов (из них женщин – 29 и мужчин - 8, в возрасте от 20 до 77 лет), страдающих ГС. Всем больным проводились неврологический осмотр, МРТ и/или КТ головного мозга. У 17 пациентов был выявлен левосторонний ГС, у 20 пациентов – правосторонний. У всех пациентов при клиническом осмотре отмечали односторонние насильственные безболезненные неконтролируемые сокращения лицевых мышц. Во всех наблюдениях отмечено типичное прогрессирующее развитие ГС, манифестирующее с подергиваний нижних отделов круговой мышцы глаза и последующим распространением в течение 1-3 лет на остальные мимические мышцы. Средняя длительность заболевания до проведения хирургического лечения составила 6, 8 года (от 1 до 16 лет). Проводимое в течение длительного времени разнообразное медикаментозное лечение и применение препаратов ботулотоксина приводило к незначительному и транзиторному уменьшению степени гемифациального спазма с неизбежным постепенным прогрессированием клинической картины. Неврологическая оценка выявила во всех случаях наличие одностороннего ГС с различным сочетанием клонических и тонических компонентов спазма. У всех больных наблюдались четкие синкинетические феномены на стороне поражения. В начальные периоды заболевание проявлялось клоническими сокращениями, а последующее распространение насильственных сокращений на большую часть мимических мышц характеризовалось нарастанием тонического компонента спазма. Слуховые феномены в виде щелчка одновременно с сокращениями мышц лица вследствие судорожного напряжения m. stapedius отмечались у 9 пациентов. Только в 6 случаях выявлены клинические признаки легкого пареза лицевого нерва (2 степень по шкале House-Brackmann), оцениваемые в межприступном интервале. Случаев семейного заболевания в представленной группе больных не зафиксировано. У 1 пациента ГС сочетался с ипсилатеральной тригеминальной невралгией (painful tic convulsif, согласно определению в англоязычной литературе) и в 1 случае наблюдалась контралатеральная тригеминальная невралгия. По МРТ головного мозга у 29 пациентов были выявлены признаки нейроваскулярного конфликта на стороне поражения и у 1 пациентки была обнаружена невринома области левого яремного отверстия. КТ и МРТ ангиография у 16 пациентов показала выраженную патологическую извитость и эктазию вертебробазилярных артерий (мегадолихобазилярная аномалия). Оперативное вмешательство осуществлялось ретромастоидальным подходом в положении больного сидя. Обнажение сосудистого сплетения в боковом вывороте IV желудочка, латеральной поверхности ствола головного мозга и зоны выхода лицевого нерва проводилось вдоль языкоглоточного нерва оттеснением вверх и медиально нижне-латеральных отделов полушария мозжечка. Идентификация сдавливающего сосуда осуществлялась последовательной микродиссекцией васкулярных структур, после чего оценивались их взаимоотношения со стволом мозга и выходной зоной корешка лицевого нерва. Декомпрессию производили путем рассечения арахноидальных сращений между стволом головного мозга, корешком лицевого нерва и сосудами. Сосудистая структура, вызывающая нейроваскулярный конфликт, отводилась от зоны выхода корешка лицевого нерва с последующей фиксацией ее нового положения с помощью нескольких участков (2-3 мм) мышечной и фасциально-жировой тканей пациента (29 случаев) или синтетических цилиндрических протекторов (8 случаев), устанавливаемых между стволом головного мозга и прилежащими сосудами.
Результаты и их обсуждение. Микроморфологические исследования выявили, что протяженность глиального конуса, т.е. участка корешка лицевого нерва с центральным типом миелинизации нервных волокон, достаточно вариабельна. Протяженность данного участка корешка от поверхности ствола головного мозга до начала периферического сегмента со Шванновским миелином составляла 0,9 — 3,6 мм (в среднем – 2,24 мм) (рис. 1).
Рис. 1 Микрофотография парастволового отдела корешка лицевого нерва (ув. 4х10, окраска гематоксилином и эозином). А – длина глиального конуса от поверхности ствола головного мозга, В – ширина нервного корешка, С – переходная зона Obersteiner-Redlich. Соотношение А/В – 1.1.
Более значительное распространение глиального конуса в относительно периферические отделы нервного корешка в сторону внутреннего слухового прохода не было выявлено ни в одном из исследованных нами препаратов. Сопоставление протяженности парастволовых сегментов центрального типа миелинизации с обеих сторон ствола головного мозга выявило незначительную асимметрию глиального конуса в пределах 0,1- 0,8 мм (в среднем — 0,3 мм). Сходные результаты были опубликованы ранее различными авторами. Так, H. Skinner, оценивая результаты собственных исследований миелинизации нервных корешков на препаратах ствола головного мозга, показал, что расстояние между стволом мозга и отрезком нерва, волокна которого покрыты миелином Шванновских клеток (длина глиального конуса) является специфичным для разных черепных нервов. Согласно исследованиям аутопсийного материала автор обнаружил, что длина глиального конуса корешка лицевого нерва равна в среднем 2,5 мм [24]. В работе, посвященной анатомическому исследованию краниальных нервов, J. Lang и U. Reiter было показано, что от поверхности ствола головного мозга сегмент лицевого нерва с центральным типом миелинизации распространяется на 2,05 мм [14]. В нашем исследовании поперечный размер корешка лицевого нерва в парастволовой зоне составлял в среднем 2,21 мм, варьируя от 1,9 до 3,7 мм. Полученные результаты позволяют приблизительно оценить протяженность глиального конуса относительно толщины нервного корешка во время хирургического вмешательства. Согласно представленным данным длина выходной зоны с центральным типом миелинизации в 1,1 раз превышала толщину корешка лицевого нерва. Полученные нами данные подтверждают предположение о том, что интраоперационные манипуляции, направленные на выявление и устранение сосудистой компрессии корешка лицевого нерва должны проводиться на небольшом (до 4 мм) участке парастволовой зоны, протяженность которого приблизительнео равна толщине нервного корешка. M. Tomii и соавт. показали, что после выхода из понтомедуллярной борозды лицевой нерв плотно сращен с боковой поверхностью ствола головного мозга на протяжении 8-10 мм и потом отделяется от поверхности Варолиева моста, формируя цистернальный сегмент [25]. Эти данные указывают на необходимость хирургической эксплорации участка ствола головного мозга, расположенного вентрокаудальнее от цистернального сегмента лицевого нерва, во время оценки нейроваскулярных взаимоотношений при ГС. Дополнительные хирургические действия на относительно периферических (дистальных) отделах корешка лицевого нерва не являются оправданными с позиции теории нейроваскулярной компрессии и могут привести к нежелательным неврологическим последствиям. У всех пациентов с ГС была обнаружена компрессия выходной зоны корешка лицевого нерва из ствола головного мозга. В 27 случаях была выявлена компрессия одним сосудом и в 9 – несколькими васкулярными структурами. В группе одиночных компрессионных воздействий сдавление корешка лицевого нерва было вызвано передней нижней мозжечковой артерией (ПНМА) у 11 пациентов, задней нижней мозжечковой артерией (ЗНМА) - у 12 пациентов и у 4 больных выявлена компрессия позвоночной артерией (ПА), причем у 2 из них в нейроваскулярном конфликте участвовала противоположная ПА [7, 8]. В случаях множественной компрессии, вызывающей нейроваскулярный конфликт, обнаружены следующие варианты сочетанного расположения сосудов в выходной зоне корешка лицевого нерва: ПА + ЗНМА – 4 пациента, ПА + ПНМА — 1, ПНМА + длинная огибающая артерия ствола — 1, ЗНМА + ПНМА — 1, БА + ПНМА – 1 и ПНМА + вена – 1 пациент. В 1 наблюдении невриномы яремного отверстия после диссекции и удаления опухоли было обнаружено сдавление выходной зоны корешка лицевого нерва петлей ЗНМА, смещенной опухолевым узлом вверх. В 35 случаях последовательная микродиссекция арахноидальных сращений позволила мобилизовать васкулярные структуры и отвести их от ствола головного мозга для полноценной декомпрессии выходной зоны корешка лицевого нерва. В 1 наблюдении адекватная декомпрессия не была достигнута ввиду того, что в аномальной петле ПНМА, поднимавшейся вверх от ствола мозга располагались волокна вестибулокохлеарного нерва. Отведение артерии от ствола головного мозга и корешка лицевого нерва вследствие имеющихся анатомических особенностей неизбежно привело бы к повреждению волокон вестибулокохлеарного нерва. У пациентки с невриномой яремного отверстия проведено тотальное удаление опухоли с васкулярной декомпрессией корешка лицевого нерва. При одностороннем сочетании ГС и тригеминальной невралгии проведена одновременная декомпрессия корешков лицевого и тройничного нервов [7], а в случае сочетания с контралатеральной невралгией тройничного нерва лицевая пароксизмальная боль устранена чрезкожной радиочастотной тригеминальной ризотомией. Летальных исходов и инфекционных осложнений после хирургического лечения в представленной группе больных не было зафиксировано. Среди неврологических осложнений нейроваскулярной декомпрессии отмечены признаки локального тракционного поражения комплекса вестибулокохлеарный – лицевой нервы. У 9 пациентов наблюдалось послеоперационное снижение слуха на стороне проведенного вмешательства, которое у 3 из них сочеталось с ощущением заложенности уха. У этих 3 больных нарушение слуха было обусловлено вскрытием и последующей тампонадой воздухоносных ячеек сосцевидного отростка и спустя 1-2 месяца отмечено восстановление функции слуха. У остальных 6 пациентов восстановления слуховой функции не наблюдалось. В 2 наблюдениях на фоне резкого снижения слуха выявлен транзиторный ипсилатеральный парез лицевого нерва до 3 баллов по шкале House-Brackmann, регресс которого отмечался в течение 1 и 3 месяцев соответственно. У 34 пациентов ближайший результат хирургического лечения оценен как отличный, характеризующийся полным исчезновением клонико-тонических сокращений и синкинезий лицевой мускулатуры. В 1 случае, когда по указанным выше причинам не была произведена адекватная сосудистая декомпрессия, клиническая картина ГС не претерпела изменений. Следует особо подчеркнуть, что у 2 пациентов с послеоперационным тракционным парезом лицевого нерва восстановление функций мимических мышц не привело к возобновлению ГС. Таким образом, полное исчезновение клинических проявлений ГС было достигнуто у 36 из 37 оперированных пациентов. У большинства пациентов клинические проявления исчезли сразу же после операции, а в 8 наблюдениях ГС, затухающий по своей частоте и выраженности, наблюдался в течение 3-7 дней после сосудистой декомпрессии до полного регресса неврологических проявлений. Вместе с исчезновением ГС отмечен регресс легкого пареза лицевого нерва, имеющегося в дооперационном периоде. При этом замечено, что у пациентов с более длительным анамнезом заболевания и выраженным тоническим компонентом спазма регресс симптомов наступал несколько позже, чем у пациентов, которым хирургическое лечение было проведено в сравнительно ранние сроки с преимущественно клоническим типом ГС. Отдаленные результаты сосудистой декомпрессии прослежены у 32 пациентов. Срок последующего наблюдения за оперированными пациентами составил в среднем 9,7 лет (от 1 до 18 лет). Каких-либо отсроченных неврологических осложнений, также как и рецидивов ГС отмечено не было. Полученные нами результаты подтверждают общепризнанное мнение о ведущей роли сосудистой компрессии глиального сегмента корешка лицевого нерва в возникновении ГС. Во всех случаях во время микрохирургической эксплорации выявлено сдавление различными сосудами парастволового отдела лицевого нерва с его четким перегибом и деформацией, а иногда и образованием борозды вдавления. Обнаруживаемая деформация нервных волокон выявлялась вблизи ствола мозга, причем часто сдавливающая сосудистая структура прилежала непосредственно к стволу головного мозга. По протяженности дислоцированная и деформированная часть корешка лицевого нерва составляла обычно не более 3 мм от поверхности ствола головного мозга, незначительно распространяясь на свободный цистернальный сегмент нерва. Нейроваскулярные конфликты при ГС в зависимости от сдавливающих сосудов можно условно подразделить на три типа. Первый тип представлен дополнительными петлями мозжечковых артерий (ПНМА и ЗНМА), внедряющихся в зону выхода корешка лицевого нерва (рис. 2).
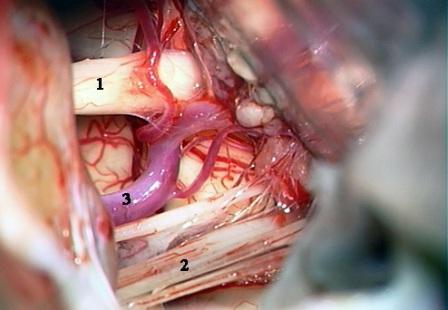
Рис. 2. Интраоперационная фотография при ГС слева. Компрессия лицевого нерва петлей передней нижней мозжечковой артерией.
Второй топографический вариант нейроваскулярного конфликта обусловлен патологической деформацией таких крупных сосудов как ПА и БА (рис. 3) и третий включает в себя особенности первых двух вариантов (рис. 4).
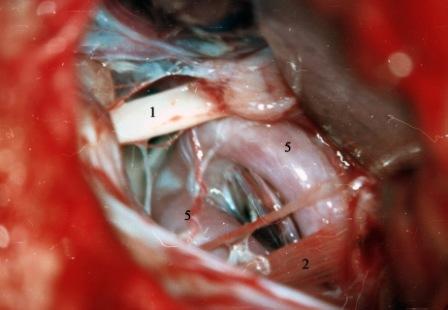
Рис. 3. Интраоперационная фотография при ГС слева. Компрессия лицевого нерва контралатеральной позвоночной артерией.
Читайте также:


