Анти-линго от рассеянного склероза
Рассеянный склероз (РС) — это хроническое аутоиммунное заболевание нервной системы, при котором происходит поражение миелиновой оболочки, покрывающей нервные волокна головного и спинного мозга, в результате чего нарушается проходимость сигналов в ЦНС. Заболевание выражается различными по количеству и интенсивности неврологическими симптомами, при этом течение болезни и степень поражения ЦНС у каждого отдельного пациента почти невозможно предсказать. Последствиями рассеянного склероза могут стать различные формы нарушения моторных, когнитивных и психологических функций, вплоть до частичной или полной инвалидности. В настоящее время полное излечение от рассеянного склероза — это весьма редкое явление, но появление препаратов нового поколения подает надежду на большие шансы на выздоровление, нежели это было в прошлом

Ранняя диагностика рассеянного склероза имеет первостепенное значение, так как она позволяет остановить развитие заболевания, и предотвратить ухудшение состояния здоровья пациента. За последние десять лет подход к лечению рассеянного склероза претерпел существенные изменения. Если ранее целью терапии рассеянного склероза было уменьшение количества неврологических приступов, то сегодня успехом лечения у израильских врачей считается подбор таких лекарственных препаратов, которые устранят все симптомы рассеянного склероза: как приступы заболевания, так и очаговые поражения миелиновых оболочек, определяющиеся на снимках МРТ.

Новейшие препараты для лечения рассеянного склероза
LINGO-1 — моноклональное антитело, специфичное к белку LINGO-1, которое восстанавливает повреждённую миелиновую оболочку нервных волокон головного и спинного мозга. При лечении рассеянного склероза есть необходимость в восстановлении тканей ЦНС, которые были повреждены в результате заболевания. С этой целью был создан препарат LINGO-1, который способствует регенерации миелиновой оболочки и росту новых клеток. На данный момент находится на последней стадии клинических исследований.
Что ожидается в лечении рассеянного склероза
Результаты последних исследований показали высокую эффективность препаратов нового поколения. Современные препараты для лечения рассеянного склероза позволяют устранить проявления болезни и максимально полно вернуть пациента к обычной жизни. Особое значение имеет также меньшее количество побочных эффектов, риск возникновения которых определяется с помощью анализа крови. Следует отметить, что данные препараты применяются при рецидивирующе-ремиттирующем рассеянном склерозе, который составляет около 85 % всех случаев заболевания.
Особое место занимает поиск препаратов для лечения прогрессирующего рассеянного склероза, возможности терапии которого на сегодняшний день ограничены. Без подходящего лечения состояние таких пациентов быстро ухудшается вплоть до полной инвалидности. Ученые занимаются разработкой препарата для лечения этой разновидности рассеянного склероза, и есть надежда, что в скором будущем появится лекарство, которое совершит прорыв в лечении этого заболевания.
Безусловно, самые дорогие препараты — те, которые создаются для людей с неизлечимыми или смертельными заболеваниями со сложной морфологией. Например, компания Novartis при описании стоимости своих препаратов делает акцент на их клиническом значении, влиянии на пациентов и систему здравоохранения в целом, а также на существенном улучшении качества жизни.
Симптомы рассеянного склероза существенно варьируются. Некоторые люди с тяжелым течением заболевания могут потерять способность ходить и есть, в то время как другие могут испытывать длительные периоды ремиссии без каких-либо новых симптомов.
Ремиттирующий рассеянный склероз — наиболее распространенное течение заболевания. Он характеризуется четко выраженными приступами новых или нарастающих неврологических симптомов. Эти приступы, также называемые рецидивами или обострениями, сопровождаются периодами частичного или полного выздоровления (ремиссиями). Во время ремиссий, все симптомы могут исчезнуть, или некоторые симптомы могут становиться постоянными. Однако явного прогрессирования заболевания в периоды ремиссии не наблюдается. Приблизительно у 85% людей с РС первоначально диагностируется именно РРС.
Большинство людей с диагнозом РРС в срок от 3–5 лет с появления первых симптомов приходят к вторичному прогрессирующему течению болезни, при котором со временем происходит ухудшение неврологических функций и инвалидизация пациента.
В 2010 году FDA одобрило препарат Gilenya, ставший широко применяемым для лечения РС. Месячный курс данного препарата стоит $2500.
Novartis даже подала иск в прошлом году, пытаясь заблокировать продажи непатентованных версий Gilenya после истечения срока действия основного патента на препарат в августе. Однако пока судебная тяжба ни к чему не привела.
В США около миллиона человек живут с РС, в России — порядка 150 тыс. человек с подтвержденным диагнозом РС, а во всем мире этим недугом страдают 2,3 млн человек. Последним методом лечения РС, одобренным FDA, был окрелизумаб в 2017 году. Это анти-CD20 моноклональное антитело, поражающее зрелые B-лимфоциты, являясь иммуносупрессором. Он вышел на рынок с заявленной стоимостью $65 000 за год лечения.
По сравнению с естественным течением болезни, пациенты, которых лечили препаратом, демонстрировали значительные улучшения моторного развития — дети смогли держать головку и самостоятельно сидеть.
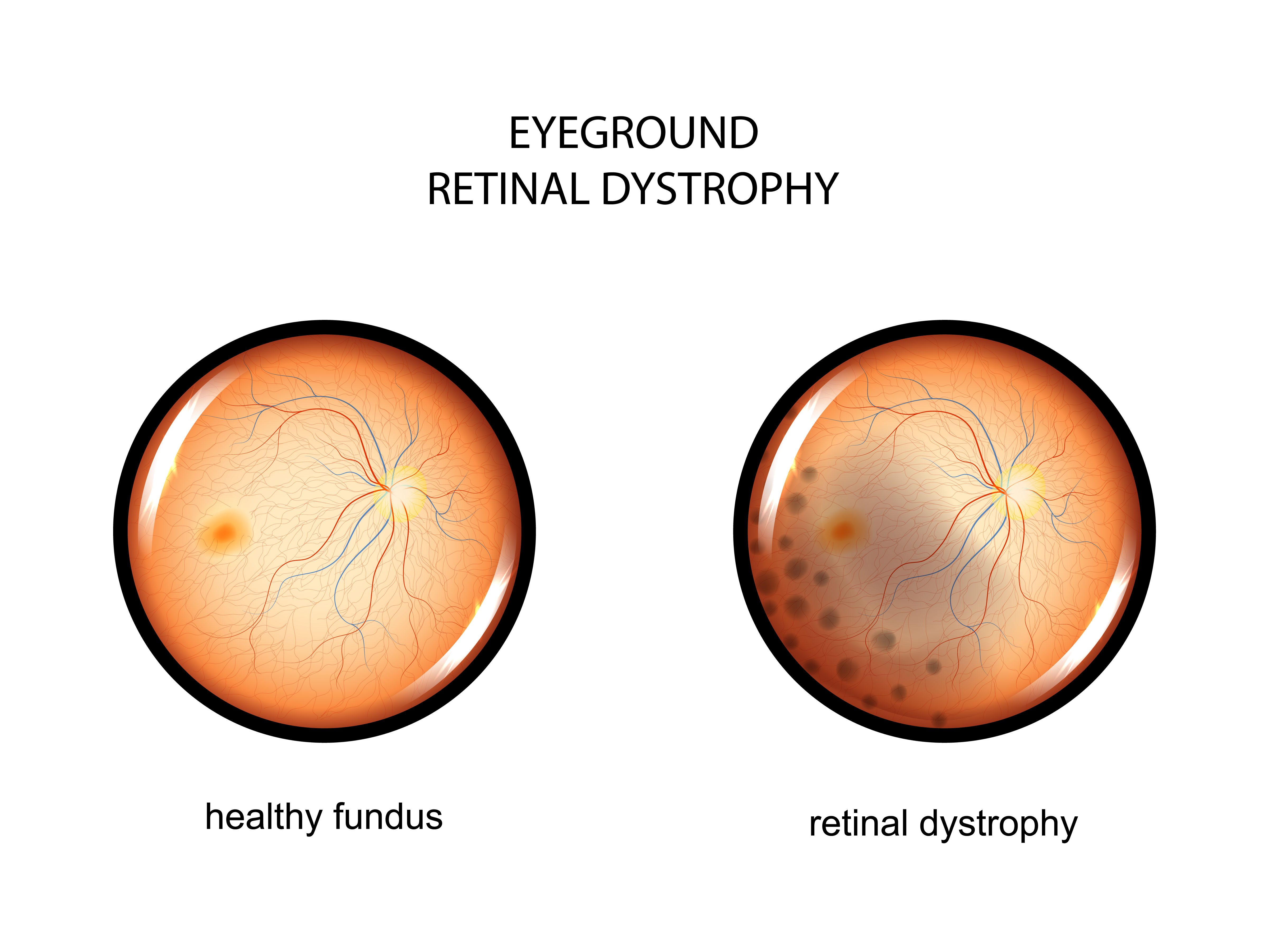
Ген RPE65 кодирует специфичный фермент клеток сетчатки глаза, участвующий в регенерации светочувствительного пигмента, который необходим для палочек и колбочек, чтобы обеспечить человеку нормальное зрение. Мутации в этом гене приводят к снижению или отсутствию уровней активности фермента, блокируя зрительный цикл и приводя к ухудшению зрения. Существует несколько типов наследственных заболеваний сетчатки, связанных с вышеназванным геном. Наиболее распространенными считают врожденный амавроз Лебера и пигментный ретинит. Из-за биаллельных мутаций гена RPE65 (генных мутаций обоих родителей) страдающие этими заболеваниями часто сталкиваются с никталопией (ночной слепотой) из-за снижения светочувствительности в детском или раннем взрослом возрасте и нистагмом (непроизвольными движениями зрачков). По мере прогрессирования заболевания происходят потеря периферического зрения, развитие туннельного зрения и, в конечном итоге, потеря центрального зрения, что означает полную слепоту.
Ретинальная дистрофия или наследственные дегенеративные заболевания сетчатки — это целый ряд болезней, которые отличаются по своей патологии, симптомам, а также последствиями. Очень трудно предсказать, насколько сильно ухудшится зрение, и как быстро будет прогрессировать заболевание, но во многих случаях люди с наследственной дистрофией сетчатки могут полностью потерять свое зрение.
Врожденный амавроз Лебера (ВАЛ) — редкое наследственное заболевание, которое приводит к нарушению деятельности сетчатки глаза и ухудшению зрения в раннем детстве, часто прямо с рождения. Из всех заболеваний, связанных с дегенерацией сетчатки, ВАЛ начинается раньше всего и может иметь наиболее тяжкие последствия. Уровень потери зрения при ВАЛ различается от случая к случаю, но остается стабильным в 75% случаев. У примерно 15% детей отмечается прогрессирующая потеря зрения, а у 10% может отмечаться некоторое незначительное, часто временное, улучшение.
Но FDA уже одобрило его для лечения двух редких заболеваний — хронического гранулематозного заболевания и тяжелого злокачественного остеопороза.
Хроническое гранулематозное заболевание — наследственное заболевание, при котором иммунная система отсутствует или не функционирует должным образом.
Синдром Хантера представляет собой рецессивное наследственное заболевание, вызванное недостаточным уровнем в организме лизосомального фермента. Проще говоря, необходимый для правильного углеводного обмена фермент не вырабатывается в нужных количествах и полисахариды (естественные сахара) неправильно усваиваются. В связи с отсутствием или наличием дефектного фермента у пациентов с синдромом Хантера полисахариды накапливаются в лизосомах клеток, приводя к клеточному перенасыщению, органомегалии, разрушению тканей и нарушению функций внутренних органов. Частота заболевания в мире составляет один человек на 100 тысяч. В России зарегистрировано около 150 пациентов.
Наследственный ангионевротический отек (HAE) — очень редкое и потенциально смертельное заболевание, которое встречается примерно у одного из 10 тыс. человек в мире. Главный симптом HAE — отеки в различных частях тела. У пациентов часто бывают приступы мучительной боли в животе, тошнота и рвота, вызванные отеком кишечной стенки. Отек дыхательных путей особенно опасен и может привести к смерти от удушья.
У пациентов с НАЭ имеется дефект в гене, который контролирует белок крови, называемый ингибитором С1. Генетический дефект приводит к выработке либо неадекватного, либо нефункционального белка C1-Inhibitor. Нормальный C1-Inhibitor помогает регулировать сложные биохимические взаимодействия систем на основе крови, участвующих в борьбе с болезнями, воспалительной реакцией и коагуляцией. Поскольку дефектный C1-Inhibitor не выполняет надлежащим образом свою регуляторную функцию, может возникнуть биохимический дисбаланс и продуцировать нежелательные пептиды. Они побуждают капилляры высвобождать жидкость в окружающую ткань, вызывая тем самым отек.
Стоимость жизненно важных препаратов зависит от множества исходных данных, но и их польза неоспорима. Обеспечить идентичную замену дефектным клеткам или способствовать выработке нужных для больного ферментов, зачастую могут только сложные разработки, в которых задействованы большое количество специалистов. В России, к большому сожалению, еще не все эти лекарства одобрены или выдаются по квоте всем нуждающимся. Но однажды мы к этому придем.
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Бойко А.Н., Лащ Н.Ю., Гусева М.Е.
В обзоре представлены данные, характеризующие механизм действия анти-В-клеточной терапии при рассеянном склерозе (РС), а также результаты клинических исследований окрелизумаба первого препарата из этой группы, разрешенного для применения при РС. В многоцентровых рандомизированных контролируемых исследованиях показана эффективность этого препарата как при течении РС с обострениями, так и при первично-прогрессирующем РС. В настоящее время окрелизумаб является единственным препаратом, который может быть использован в качестве патогенетического лечения при таком типе течения РС.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Бойко А.Н., Лащ Н.Ю., Гусева М.Е.
New drugs for anti-B-cell therapy of multiple sclerosis
The review presents the data characterizing the mechanism of action of anti-B-cell therapy for multiple sclerosis (MS) and the results of clinical trials of ocrelizumab , the first drug of this group, which has been approved for use in MS. Multicenter randomized controlled studies have shown that this drug is effective in treating both MS with exacerbations and primary progressive MS. Currently ocrelizumab is the only drug that can be used as a pathogenetic treatment for this MS course type.
Бойко А.Н., Лащ Н.Ю., Гусева М.Е.
Новые препараты для анти-В-клеточной терапии
В обзоре представлены данные, характеризующие механизм действия анти-В-клеточной терапии при рассеянном склерозе (РС), а также результаты клинических исследований окрелизумаба — первого препарата из этой группы, разрешенного для применения при РС. В многоцентровых рандомизированных контролируемых исследованиях показана эффективность этого препарата как при течении РС с обострениями, так и при первично-прогрессирующем РС. В настоящее время окрелизумаб является единственным препаратом, который может быть использован в качестве патогенетического лечения при таком типе течения РС.
Ключевые слова: рассеянный склероз; терапия; анти-В-клеточная терапия; окрелизумаб Контакты: Алексей Николаевич Бойко; boykoan13@gmail.com
Для ссылки: Бойко АН, Лащ НЮ, Гусева МЕ. Новые препараты для анти-В-клеточной терапии рассеянного склероза. Неврология, нейропсихиатрия, психосоматика. 2018;10(1):70—73.
New drugs for anti-B-cell therapy of multiple sclerosis Boyko A.N., Lashch N.Yu., Guseva M.E.
Department of Neurology, Neurosurgery, and Medical Genetics, N.I. Pirogov Russian National Research Medical University,
Ministry of Health of Russia, Moscow, Russia
1, Ostrovityanov St., Moscow 117997
The review presents the data characterizing the mechanism of action of anti-B-cell therapy for multiple sclerosis (MS) and the results of clinical trials of ocrelizumab, the first drug of this group, which has been approved for use in MS. Multicenter randomized controlled studies have shown that this drug is effective in treating both MS with exacerbations and primary progressive MS. Currently ocrelizumab is the only drug that can be used as a pathogenetic treatment for this MS course type.
Keywords: multiple sclerosis; therapy; anti-B-cell therapy, ocrelizumab. Contact: Aleksey Nikolaevich Boyko; boykoan13@gmail.com
Рассеянный склероз (РС) — одна из наиболее актуальных проблем современной неврологии, что связано с увеличением числа таких пациентов во всем мире. Рост заболеваемости объясняется в том числе и улучшением методов диагностики РС, внедрением в рутинную практику магнитно-резонанасной томографии (МРТ), разработкой ранних уточняющих диагностических критериев заболевания, а также повышением настороженности различных специалистов в отношении развития демиелинизирующих заболеваний [1—3].
Увеличение числа пациентов с РС, уточнение вариантов его развития диктуют необходимость тщательного изучения патогенетических механизмов повреждения ткани мозга и поиска новых более эффективных и безопасных препаратов для лечения этой патологии. С конца прошлого века при РС активно используются иммуномодулирующие и иммуносупрессивные препараты, изменяющие течение РС (ПИТРС). Их эффективность показана в многочисленных международных клинических исследованиях, проведенных на основе принципов доказательной медицины. Это инъекционные препараты бета-интерферона и глатирамера
ацетата, препараты для внутривенного введения митоксан-трон, натализумаб, алемтузумаб, пероральные препараты терфлуномид, финголимод, диметилфумарат.
Современные ПИТРС при правильном и своевременном назначении позволяют существенно снизить, а иногда и практически полностью контролировать активность де-миелинизирующего процесса у пациентов. Основная задача врача при назначении ПИТРС — индивидуальный подбор терапии, которая наилучшим образом подходит данному пациенту, постоянный мониторинг эффективности и безопасности этой терапии, а при ее неэффективности или повышении риска нежелательных явлений (НЯ) — назначение другого лечения [4]. Полностью остановить патологический процесс при РС невозможно. У части пациентов, несмотря на терапию, сохраняются обострение, клинические и МРТ-признаки активности РС, прогрессирует инвалидизация.
Доказано, что в иммунопатогенезе РС важную роль играют и Т-, и В-клетки. В-клетки участвуют в патогенезе РС путем презентации антигена, образования аутоантител или продукции активационных цитокинов. Кроме того, В-клетки задействованы в формировании эктопических лим-
фоидных фолликулоподобных агрегатов в менингеальной оболочке мозга. Образование этих агрегатов связывают с развитием кортикальных очагов демиелинизации, локальной и диффузной нейродегенерации [5—7]. В этих агрегатах также находятся короткоживущие плазматические клетки, образующиеся из В-клеток, которые вырабатывают специфические для РС олигоклональные иммуноглобулины, участвующие в гуморальных реакциях в ЦНС [6].
Достаточно давно разрабатываются подходы к лечению РС, основанные на анти-В-клеточной терапии [7]. Первые обнадеживающие результаты были получены при использовании моноклональных антител (МАТ) к поверхностному рецептору В-клеток CD20. Этот мембранный белок состоит из 297 аминокислотных остатков и экспресси-руется на пре-В-клетках, зрелых B-клетках и В-клетках памяти, но не на более ранних предшественниках B-клеток или плазматических клетках. МАТ к CD20 селективно уменьшают количество В-клеток посредством антителоза-висимого клеточного фагоцитоза, антителозависимой клеточной цитотоксичности, комплемент-зависимой цитоток-сичности и апоптоза. Так как истощение популяции касается определенного пула В-клеток, сохраняются способность к восстановлению В-клеток и существующий гуморальный иммунитет. Уменьшение пула данных клеток и ведет к стиханию иммунопатологического воспаления при РС, при этом не страдает врожденный иммунитет и практически не изменяется общее количество Т-клеток [8, 9].
Первым МАТ к CD20, эффективность которого в отношении снижения частоты обострений и замедления про-грессирования при различных формах РС доказана в клинических исследованиях, стал окрелизумаб1. В марте 2017 г. ок-релизумаб был зарегистрирован в Северной Америке, а в октябре 2017 г. одобрен к применению в Российской Федерации для лечения взрослых пациентов с различными формами РС: 1) РС с обострениями или рецидивирующий РС (РРС) и 2) первично-прогрессирующий РС (ППРС). В конце 2017 г. препарат зарегистрирован в странах Европейского Союза и многих других странах. Его регистрация проводилась на основании трех больших клинических исследований 3-й фазы: OPERA I, OPERA II (РРС) и ORATORIO (ППРС).
Окрелизумаб при РРС
Эффективность и безопасность окрелизумаба оценивали у пациентов с РС с обострениями (РРС) в двух рандомизированных двойных слепых клинических исследованиях с одинаковым дизайном, двойной имитацией и использованием активного препарата сравнения (высокодозный интерферон бета-1а — стандартный препарат первой линии ПИТРС), длительностью 96 нед (OPERA I и OPERA II). Пациенты были рандомизированы в соотношении 1:1 на две группы: в группе окрелизумаба (n=827) они получали препарат в дозе 600 мг каждые 24 нед и плацебо подкожно 3 раза в неделю; в группе сравнения (n=829) — интерферон бета-1а в дозе 44 мкг подкожно 3 раза в неделю и плацебо в виде внутривенных (в/в) инфузий каждые 24 нед. В качестве первичной конечной точки оценивали среднегодовую частоту обострений (СЧО) на 96-й неделе исследования.
Также были установлены вторичные конечные точки, характеризующие скорость нарастания инвалидизации по
шкале EDSS (Expanded Disability Status Scale) и динамику показателей МРТ
Результаты исследований показали, что в группе окрелизумаба СЧО была достоверно ниже, чем в группе сравнения (0,155 и 0,156 против 0,290 и 0,292; р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
личества пациентов не наблюдалось увеличения частоты серьезных инфекций [10, 12]. В то же время в группе окре-лизумаба несколько чаще отмечались нетяжелые инфекции верхних дыхательных путей (15,2% в сравнении с 10,2% при введении интеферона бета-1а). Частота герпетической инфекции у пациентов с РРС была также выше на фоне терапии окрелизумабом по сравнению с использованием интерферона бета-1а: опоясывающий лишай (Herpes Zoster; 2,1 и 1,0% соответственно), простой герпес (0,7 и 0,1%), герпес ротовой полости (3,0 и 2,2%) [10]. Герпетические инфекции были преимущественно легкой и умеренной степени тяжести и проходили после стандартного лечения. Случаев дис-семинированного герпеса не наблюдалось.
Окрелизумаб при ППРС
Эффективность и безопасность окрелизумаба при ППРС оценивали в рандомизированном двойном слепом плацебоконтролируемом клиническом исследовании ORATORIO длительностью 120 нед [13]. Пациентов рандо-мизировали в соотношении 2:1 на группы, получавшие окрелизумаб 600 мг в/в каждые 24 нед или плацебо. Результаты исследования показали, что окрелизумаб в дозе 600 мг каждые 6 мес статистически достоверно замедляет прогрес-сирование инвалидизации по шкале EDSS на 24% по сравнению с плацебо. Также отмечено, что в группе окрелизума-ба медленнее нарастало замедление скорости ходьбы в сравнении с группой плацебо: доля пациентов с ухудшением ходьбы в группе окрелизумаба составила 38,9%, а в группе плацебо — 55,1% (р=0,04). Были выявлены статистически значимые различия и в отношении конечных точек, связанных с показателями МРТ Так, общий объем Т2-очагов в ходе исследования увеличился на 7,4% в группе плацебо, тогда как в группе окрелизумаба он уменьшился на 3,4% (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
13. Montalban X, Hauser SL, Kappos L, et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. N Engl J Med. 2017 Jan 19;376(3):209-220. doi: 10.1056/NEJMoa1606468. Epub 2016 Dec 21.
14. Hauser SL, Belachew S, Kappos L. Ocrelizumab in Primary Progressive and Relapsing Multiple Sclerosis. N Engl J Med. 2017 Apr 27;376(17):1694. doi: 10.1056/NEJMc1702076.
Декларация о финансовых и других взаимоотношениях


Еще 15-20 лет назад диагноз "рассеянный склероз" звучал как приговор. Лекарств для его лечения не было. Заболев в 35-40 лет, человек через три года становился глубоким инвалидом и еще через несколько - умирал. Но в середине 90-х годов больные получили шанс: была найдена группа сложных лекарств, воздействующих на иммунную систему - так называемые глатирамоиды, и первым в этой группе стал препарат для лечения рассеянного склероза израильского производителя. Победить недуг полностью пока не удается. Но лекарство с международным названием глатирамера ацетат тормозит развитие болезни и уменьшает количество рецидивов. Человек может работать и жить полноценной жизнью. Срок наступления инвалидности удается отодвинуть на 15-20 лет.
В нашу страну лекарство стало завозиться только в 2006 году, но его высокая стоимость делала лечение доступным немногим. Только включение рассеянного склероза в федеральную программу "Семь нозологий" в 2008 году гарантировало больным обеспечение лекарством за счет государства. Цена вопроса для одного пациента 30-40 тысяч рублей в месяц, то есть до 500 тысяч в год. Ежегодные закупки - более 5 млрд рублей. Терапия пожизненная, прерывать ее нельзя. Так что все эти годы больные оставались на пороховой бочке: будет бюджет - не будет, закупят - не закупят.
Одним словом, появление российского аналога - дженерика - это большая удача и победа, не только для компании-производителя, но и для российских пациентов. Но при одном условии: если препарат действительно работает, если он эффективен и безопасен.
К российским лекарствам у многих врачей и у пациентов отношение часто настороженное и скептическое. Это понятно: надежнее лечиться проверенными препаратами. Тем более, когда речь идет о новых, сложных лекарствах.
Глатирамера ацетат - как раз из таких. У него очень сложный состав - статистическая смесь синтетических полипептидов. Авторы оригинального лекарства до последнего утверждали, что повторить их находку без ущерба для эффективности лечения невозможно. Малейшие отклонения в составе исходных веществ, в условиях проведения синтеза приводили к нарушению молекулярной структуры - и фармакологическое действие препарата на организм могло кардинально поменяться.
Эта неразрешимая, казалось, проблема была успешно решена. Правда, на поиски решения ушло 10 лет. Группа молодых талантливых биохимиков начала исследование на одной из кафедр химфака МГУ, а на определенном этапе работа продолжилась уже при поддержке "Ф-Синтеза".
"Это была действительно сложная цель, - рассказала "РГ" одна из разработчиков препарата, руководитель отдела разработки Виктория Сергеева. - Оговорюсь сразу: мы не искали новую формулу, не создавали принципиально новое лекарство. Мы поставили задачу максимально качественно скопировать известный и хорошо себя зарекомендовавший препарат. Во время моей работы в Каролинском институте в Стокгольме я занималась фундаментальными исследованиями центральной нервной системы, и меня очень увлекла возможность прикладного применения моих знаний. Начинали буквально "на коленке". Нашей группе крупно повезло, что исследованиями заинтересовалась компания "Ф-Синтез", и мы получили возможность продолжить работу в ее лабораториях, оснащенных на уровне лучших западных институтов".
"Это один из самых сложных синтетических лекарственных препаратов, известных на сегодняшний день, - поясняет коллега Сергеевой, руководитель проекта Юрий Скорняков. - Дело в том, что это не индивидуальное вещество, а белковый "бульон" из множества синтетических пептидов. Чтобы было понятнее: мои студенты подсчитали, что если взять килограмм уже синтезированного препарата - в нем не будет ни одной одинаковой молекулы, все они разные. И при этом нам было необходимо добиться, чтобы полученная смесь полностью совпала по своим характеристикам с оригиналом".
Когда у оригинальных препаратов истекает срок патентной защиты и их разрешается воспроизводить, дженериковые компании обычно уже стоят "на низком старте". Формула любого оригинала известна. Поэтому вся работа по созданию копии проводится заранее. Даже зарегистрировать аналог можно заблаговременно. Тем более что процесс этот долгий.
В принципе, дженерики, и это общемировая практика, регистрируются по упрощенной схеме. Производителю не нужно проводить длительных и дорогих клинических исследований, достаточно доказать точное соответствие состава действующего вещества оригинальному препарату. Отсюда и более доступная цена. Но в случае с российским глатирамера ацетатом этот упрощенный подход не применялся. Лекарство прошло три фазы клинических исследований в течение двух лет в 10 клиниках по всей России. В испытаниях участвовали 150 больных. Результат: сделано заключение о сопоставимой эффективности, безопасности и переносимости отечественного дженерика по сравнению с оригинальным лекарством.
"Когда мы узнали, что к выводу на рынок готовится российский аналог израильского лекарства, ощущения были двойственными, - рассказал "РГ" глава Общероссийской общественной организации инвалидов - больных рассеянным склерозом, профессор Ян Власов. - С одной стороны, без сомнения, такой препарат в отечественном исполнении очень нужен, потому что с поставками импортного неоднократно возникали сложности. С другой, у нас был негативный опыт. Несколько лет назад нашим пациентам был предложен российский аналог немецкого интерферона. Полноценной "клиники" он не прошел. Тем не менее больных стали переводить на него по умолчанию, у многих возникли претензии, и нам пришлось приложить массу сил, чтобы урегулировать ситуацию. Поэтому с компанией "Ф-Синтез" мы договорились заранее: они проводят полноценные исследования в центрах, которые мы знаем, с участием врачей, которым мы доверяем. Я сам обзванивал все клиники, постоянно общался с врачами и пациентами и уверен, что нет никаких оснований не доверять новому препарату".
"При регистрации дженерика обычно достаточно подтвердить химическую формулу, идентичную структуру копии, - поясняет Юрий Скорняков. - Но в нашем случае мы имеем дело со смесью, и смесью сложной. Поэтому мы стремились не только проверить эквивалентность субстанции оригиналу, для чего необходимо было проанализировать более 20 параметров соответствия, но и получить клинические доказательства эффективности".
Такой подход оправдан: ведь одно дело получить нужный препарат в лаборатории, условно говоря, в пробирке. И совсем другое - повторить синтез в промышленном масштабе.
Первая пробная партия лекарства была произведена еще в 2012 году для проведения клинических испытаний. Все прошло удачно: производственная площадка компании одна из самых современных в стране - ни на оборудование, ни на обучение персонала средств не жалеют. Три сертификата, подтверждающие соответствие международным стандартам GMP, - тому свидетельство.
"Нам "помогал" сам препарат, - Виктория Сергеева говорит о нем как о любимом ребенке. - У него такая интересная особенность: если в процессе синтеза есть хотя бы малейшее отклонение, несоответствие исходной структуре, то препарат не получается в принципе. И его невозможно очистить, поменять, переделать. Лекарственная форма - это раствор для инъекций, расфасованный в одноразовые шприцы. Раствор белковый, любой микроб, попади он внутрь, с удовольствием начнет его "есть" и размножаться. Так что требования к стерильности воды, воздуха, производственных помещений и оборудования - предельно высокие".
Препарат долгожданный. Регистрация его ожидалась еще в прошлом году, но затянулась на несколько месяцев. Завершилась процедура только несколько дней назад. Компания "Ф-Синтез" готова участвовать в госзакупках, тем более что по решению ФАС, чтобы не нарушалось антимонопольное законодательство, начало аукциона было отложено.
"Вывод на рынок препарата - это результат многолетней усердной работы всей команды. Процесс регистрации занял порядка шести лет, и все это время мы конструктивно работали с минздравом, старались учесть все замечания, - говорит председатель совета директоров "Ф-Синтез" Олег Михайлов. - Мы готовы произвести такое количество лекарства, которое необходимо для полного удовлетворения потребности российских пациентов, и ресурсов, и мощностей у нас хватает".
Один из главных козырей компании - 100-процентное импортозамещение. Лекарство производится в России с нулевого цикла, начиная с синтеза фармсубстанции. В отличие от весьма распространенных случаев "локализации",
когда готовые субстанции и лекарственные препараты завозятся из-за рубежа, а на российских площадках происходит лишь заключительный этап - расфасовка.
Поэтому никакой зависимости от импортного сырья, скачущих курсов валют и других рисков при производстве российского лекарства нет.
А вот падение цены из-за того, что на торги придет конкурент, эксперты прогнозируют. Олег Михайлов заявил, что вывод на рынок отечественного аналога позволит удешевить закупки не менее чем на 20%.
Читайте также:


