Энцефалограмма головного мозга при дцп

- О методе обследования и показаниях к его проведению
- Подготовка к процедуре
- Как делается электроэнцефалография?
- Результаты и их анализ
О методе обследования и показаниях к его проведению
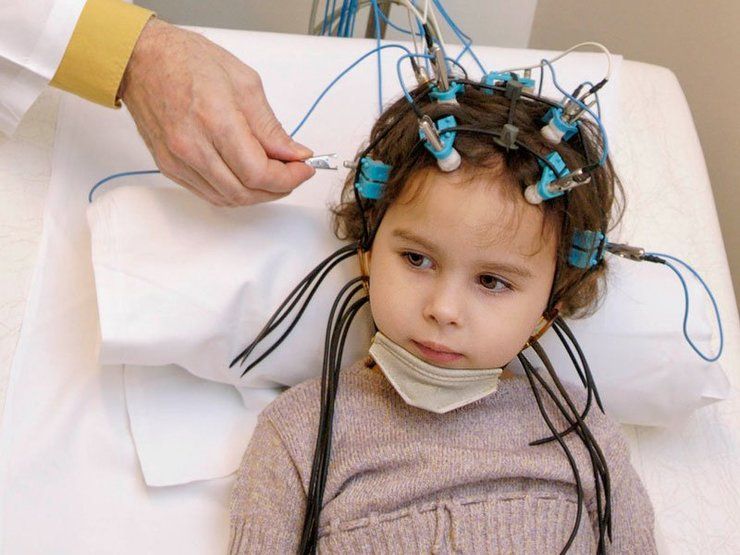
ЭЭГ головного мозга ребенку: показания и проведение
ЭЭГ или электроэнцефалография — современная диагностическая процедура в неврологии, позволяющая оценивать электрическую активность головного мозга. Метод безопасен для детей и не приводит к негативным последствиям для их здоровья. Фиксация результатов проводится на бумажную ленту или в цифровом виде. Это облегчает врачу постановку диагноза.
ЭЭГ проводят по строгим медицинским показаниям. К ним относят следующие состояния:
- частые обмороки у ребенка и неустойчивое артериальное давление;
- головные боли, не связанные с недосыпанием и переутомлением;
- черепно-мозговые травмы;
- беспричинный плач;
- ночной энурез;
- нарушения памяти, внимания и другие когнитивные расстройства;
- судорожные приступы без повышения температуры;
- признаки менингита, гидроцефалии и других органических патологий;
- задержка речевого и психомоторного развития, формирование заикания и др.;
- детский церебральный паралич.
Показания к проведению ЭЭГ в детском возрасте определяет педиатр или невролог.
ЭЭГ не проводят детям, имеющим открытые раны на поверхности черепа, в том числе с наложенными швами. Других противопоказаний к исследованию нет.
Подготовка к процедуре
Если ребенку менее 1 года, то электроэнцефалографию проводят во время сна. Это позволяет получить достоверные результаты и избежать стресса для грудничка. В редких случаях возможно назначение седативных медикаментов после консультации с врачом.
Перед проведением ЭЭГ проводится подготовка ребенка:
- кожу головы очищают от жира. Для этого накануне процедуры голову моют с шампунем, тщательно промывая волосы от его остатков;
- детей первого года жизни за 30–40 минут до обследования кормят;
- снимают металлические изделия;
- если ребенок принимает противосудорожные препараты, то их отменяют за 3–4 дня до ЭЭГ. В случае невозможности их исключения родители обязательно рассказывают о медикаментах. Это позволяет правильно расшифровать результаты;
- любые напитки и продукты, стимулирующие головной мозг, должны быть исключены из рациона питания. К ним относят шоколад, чай, энергетические напитки и пр.
Родители перед посещением больницы обязательно беседуют с ребенком и объясняет ему суть предстоящего исследования. Это позволяет снизить стресс.
Если у ребенка наблюдается острое инфекционное заболевание или имеется кашель, то проведение ЭЭГ откладывают до выздоровления. Указанные факторы приводят к изменению получаемых результатов.
Как делается электроэнцефалография?
ЭЭГ проводят в специальной комнате, имеющей звуко- и светоизоляцию. Кожу головы смазывают электропроводящим гелем и одевают сетчатый шлем. На нем размещены электроды, считывающие электрическую активность головного мозга. Они подключаются к электроэнцефалографу и процедура начинается.
Исследование проводится в несколько этапов:
- Изучение мозговой активности в покое. Ребенка просят сидеть с закрытыми глазами и не шевелиться.
- Снятие ЭЭГ при мозговой активности. Врач просит ребенка открыть и закрыть глаза, вызывая изменения в электрических импульсах головного мозга.
- Проведение пробы с гипервентиляцией. По команде специалиста ребенок совершает глубокие вдохи и выдохи. Указанная стимуляция позволяет выявить скрытые эпилептические очаги.
- Проба с фотостимуляцией. Глаза ребенка закрыты, однако на них воздействует свет от лампы с определенным ритмом включения и выключения. Проба позволяет оценить электрическую активность головного мозга при сильном раздражителе.
Что показывает ЭЭГ?
На первом году жизни процедура проводится в ночное время. Пробы с гипервентиляцией и фотостимуляцией не проводятся. В этих случаях возможно использование предварительной депривации сна, т.е. его сокращения в ночь накануне исследования.
Результаты и их анализ
Расшифровка показателей ЭЭГ проводится только врачом-неврологом. Самостоятельная диагностика и назначение лечения недопустимы. В норме на электроэнцефалограмме могут быть выявлены четыре типа волн: альфа, бета, дельта и тета. Каждый из них имеет характерные особенности.
Альфа-ритм характеризуется частотой 8–14 Гц. Он наблюдается у детей в состоянии покоя. Увеличение частоты характерно для сосудистых заболеваний головного мозга или после черепно-мозговых травм. Ее уменьшение выявляется у детей с неврозами и слабоумием.
Вредно или нет для ребенка? Специалисты отмечают, что ЭЭГ — безопасная процедура, которая проводится только по медицинским показаниям.
Бета-ритм имеет амплитуду 2–5 мкВ. Выявляется в моменты бодрствования и мыслительной активности. При травмах черепа амплитуда увеличивается. Ее снижение характерно для менингита, энцефалита и задержках психического развития. Дельта и тета-ритм выявляются во время сна. Изменения в их амплитуде свидетельствуют о росте новообразований и других органических патологиях.
Говоря о том, что показывает ЭЭГ, врачи отмечают, что метод подходит для изучения активности отдельных частей головного мозга. Специалисты в процессе исследования получают возможность выявить отклонения в основных ритмах ЦНС и эпилептическую активность.
Если электроэнцефалография выявляет отклонения в мозговой активности, для уточнения диагноза назначают дополнительные методы: компьютерную или магнитно-резонансную томографию, УЗИ мозговых сосудов с допплерографией и др. На основании полученных результатов для ребенка подбирают терапию и методы реабилитации.

В Клинике Мельниковой Е.А. проводится полная диагностика и оценка состояния центральной и периферической нервной системы.
1. Электрофизиологические методы:
- электроэнцефалография на приборах ("Nicolet", CША);
- электроэнцефалография, с картированием, трехмерной локализацией - программа Brainloc 5 на приборах ("Nicolet, США);
(от греческого enсephalos - мозг и grapho - пишу). ЭЭГ - это метод исследования биоэлектрической активности головного мозга, возникающей в процессе его деятельности, с компьютерной обработкой данных и полным анализом электроэнцефалографии.
Компьютерная ЭЭГ (КЭЭГ) оценивает функциональное (рабочее) состояние головного мозга в целом, а также отдельных его областей. КЭЭГ применяется для выявления объёмных процессов (опухоли, кисты и т.д.), воспалительных (энцефалиты, менингиты и т. д.), сосудистых (дисциркуляторная энцефалопатия) и травматических заболеваний головного мозга (перенесённые черепно-мозговые травмы).
При помощи КЭЭГ производится уточнение и выявление эпилептических очагов с их локализацией и просмотром интенсивности патологического очага, а также уточнением его траектории по областям головного мозга, межполушарной ассиметрии, зрелости мозга и др.. ЭЭГ - это запись биоэлектрическуой активности нейронов коры головного мозга.
Программа Brainloc 5 - метод трёхмерной локализации патологических очагов головного мозга. Данным методом можно узнать и увидеть локализацию в структурах головного мозга выявленные при записи компьютерной электроэнцефалографии очаги патологической активности при эпилепсии, опухолях, травмах, инсультах и т.д. Данный метод позволяет врачу максимально точно поставить диагноз, назначить эффективное лечение, а при необходимости помочь специалистам другого профиля (нейрохирургам, онкологам) в уточнении диагноза и проведении лучевой терапии и оперативного вмешательства. В отличии от ранее применяемых методов (компьютерной томографии и магнитно-резонансной томографии) программа Brainloc позволяет выявить патологическую активность участков головного мозга в начальной стадии, которые не выявляются на КТ и МРТ, т.к. при этих обследованиях выявляются очаги разрушения группы клеток.
- вызванные потенциалы мозга различных модальностей: зрительные, слуховые, соматосенсорные (включая пудендальные), когнитивные (P300) на приборах ("Nicolet", США)
Методика вызванных потенциалов мозга (ВП) заключается в выделении и усреднении слабых и сверхслабых потенциалов биоэлектрической активности мозга в ответ на различные афферентные стимулы. Виды подаваемых стимулов могут быть как экзогенные - зрительные, слуховые, чувствительные, так и эндогенные - когнитивные.
Зрительные Вызванные потенциалы(ЗВП).
Метод объективизации состояний зрительных функций у детей раннего возраста и взрослых.
Различные модификации методами позволяют изучить синдромы поражения зрительного анализатора на различных уровнях: сетчатка глаза, зрительный нерв, зрительный тракт с перекрёстом, затылочные доли головного мозга.
Этот метод позволяет объективно оценить состояние зрительного нерва и определить уровень его поражения.
Слуховые Вызванные потенциалы (СВП).
Этот метод позволяет максимально точно определить поражение слухового нерва у новорожденных (исключить врождённую глухоту), у детей с ДЦП (детский церебральный паралич), позволяет проследить в динамике функции восстановления нерва у глухонемых и слабослышащих, после оперативного вмешательства на органах слуха, помогает максимально точно подобрать слуховой аппарат.
Соматосенсорные Вызванные потенциалы (ССВП).
ССВП - это электрические ответы нервных проводников и центров на стимуляцию нервных стволов.
Можно зарегистрировать ВП афферентных (восходящих) волокон периферических нервов, проводящих путей серого вещества спинного мозга, мозгового ствола и больших полушарий головного мозга.
ССВП очень информативны у детей и взрослых, пациентов с неадекватным поведением, при оценке степени травматического повреждения нервов, сплетений, спинного мозга, диагностика комы.
ССВП применяются для оценки восстановления проводимости нерва парализованной конечности.
Когнитивные Вызванные потенциалы (КВП).
Классические методики выделения и анализа ВП, служащие для диагностики уровня и степени поражения анализаторов (органов чувств), могут быть использованы для анализа высших корковых функций (мышление, память и т.д.). Процессы узнавания и запоминания информации, а также принятия ответного решения, сопровождаются более или менее закономерными нейродинамическими измерениями, которые можно объективно зафиксировать. Этот метод применяется для определения объема оперативной памяти, для проф.отбора при приеме на работу, для диагностики самых ранних стадий деменции (деградации личности), для контроля результатов лечения расстройств психики у взрослых и детей и выявления побочного действия лекарственных препаратов.
- электронейромиография на приборах ("Нейрософт", Россия);
Метод основанный на регистрации и анализе электрической активности мышечных и периферических нервных волокон. Различают спонтанную и вызванную ЭНМГ. При спонтанной ЭНМГ получают характеристики, отражающие состояние периферических нервов и мышц, находящихся в покое или в состоянии мышечного напряжения. При вызванной ЭНМГ получают ответы, возникающие в ответ на стимуляцию периферического нерва или мышцы электрическим током.
Изучение функционального состояния мышцы, степени ее вовлеченности в патологический процесс, сохранности иннервации или определение объема реиннервации, являются основными вопросами, решаемыми при проведении электромиографического исследования. ЭНМГ широко используется для проведения дифференциальной диагностики между неврогенными и первично-мышечными заболеваниями, способствует их ранней диагностике, позволяет решать вопросы, касающиеся патогенеза отдельных форм нервно-мышечных заболеваний, судить о ходе денервационно-реиннервационного процесса в мышцах в условиях формирования компенсаторной иннервации, позволяет очень точно проследить все этапы развития и степень выраженности денервационного синдрома в мышце.
2. Нейроиммунологическое исследование крови.
- Исследование крови на вирусы (до 16 видов), на различные виды антител к мозгоспецифическим белкам (до 10 видов, на различные виды ДНК, а также на антитела изотопов IgG и IgE к основному белку миелина
Исследования крови пациентов Клиники Мельниковой Е.А. проводятся в Клинико-диагностической лаборатории "Медполюс", совместно с "НИИ вакцин и сывороток им. Мечникова", а также совместно с отделом нейровирологии "The stanley of developmental neurovirolgy The Johns Hopkins University school of medicine, department of pediatrics.
Метод исследования крови на инфекции TORCH- комплекса методами полимеразной цепной реакции и иммуноферментного анализа с определением иммуноглобулинов G и M. Высокоточное вирусологическое исследование крови на TORCH – синдром проводится в соответствии с правилами GCP и GLP, с оценкой клеточного, гуморального иммунитета для исключения аутоиммунного демиелинизирующего процесса с %-м определением деструкции белого вещества мозга , и прогнозированием клинического исхода перинатальной гипоксии.
Использование нейроспецифических белков (НСБ) в качестве маркеров различных патологических изменений, происходящих в ЦНС, особенности экспрессии нейропептидов , участвующих в патогенезе гипоксического поражения ЦНС у детей и возможность их использования для диагностики перинатальных поражений и прижизненной оценки тех процессов, которые происходят в клетках нервной ткани в постнатальном периоде является одним из перспективных направлений современной нейрофизиологии и медицины.
Установлено, что уровень Белка S-100 у детей является показательным при поражении мозга при нейроинфекции: отмечено повышение уровня данного антигена в раннем неонатальном периоде. Уровень S-100 прямо коррелирует с тяжестью поражения головного мозга и обратно - с восстановлением неврологического статуса. Концентрацию S-100 для прогнозирования течения заболевания можно определять в сыворотке крови, ликворе и моче.
В настоящее время показано, что S-100 - это группа уникальных для нервной ткани кислых кальций-связывающих белков, отличающихся по заряду и массе, но тождественных иммунологически. Концентрация их в мозге в 100 000 раз превышает содержание в других тканях и составляет до 90% растворимой фракции белков нервных клеток.
Одним из представителей группы S-100 является S-100β, наиболее специфичный белок мозговой ткани. Известно, что при деструкции мозговой ткани S-100β наряду с другими белками этой группы может обнаруживаться в крови и цереброспинальной жидкости больных. Белок S-100β представляет особый интерес в связи с недавним выявлением у него нейроростовых и нейротрофических свойств фактор (CNTF-ciliary neurotrophic factor).
Факторы роста поддерживают жизнь нейронов, которые в их отсутствие не могут существовать. Трофическая дизрегуляция является одной из универсальных составляющих патогенеза повреждения нервной системы. При лишении трофической поддержки зрелых клеток развивается биохимическая функциональная дедифференциация нейронов с изменениями свойств иннервируемых тканей.
Трофическая дизрегуляция оказывает влияние на состояние макромолекул, принимающих участие в мембранном электрогенезе, активном ионном транспорте, синаптической передаче и эффекторной функции.
В развивающемся организме нейротрофический фактор головного мозга (BDNF) синтезируется клеткой-мишенью (например, мышечным веретеном), диффундирует по направлению к нейрону, связывается с молекулами рецепторов на его поверхности, что приводит к
активному росту аксона. В результате аксон достигает клетки-мишени, устанавливая с ней синаптический контакт. Исследованию нейротрофических факторов посвящено достаточно много работ.
У беременных женщин при исследовании уровня BDNF в амниотической жидкости обнаружено снижение его концентрации при развитии в последующем гидроцефалии у новорожденного (не связанной с пороками развития), при развитии инфекционного процесса у ребенка в постнатальном периоде.
Таким образом, изучение нейротрофических факторов в раннем неонатальном периоде является очень важным, поскольку позволит выявить механизмы повреждающего воздействия гипоксии на мозг и определить степень влияния уровня нейротрофинов на прогноз формирования структурных постгипоксических изменений головного мозга.
Сосудистый эндотелиальный фактор роста - VEGF (Vascular Endothelial Growth Factor)
Васкулоэндотелиальный фактор (VEGF-А)- гетеродимерный гликопротеиновый ростовой фактор, продуцируемый различными типами клеток. В отличие от других митогенов для эндотелиоцитов, таких как - фактор роста фибробластов и тромбоцитарный фактор роста, васкулоэндотелиальный фактор синтезируется как предшественник, содержащий 226 аминокислот. Идентифицированы 5 вариантов VEGF-A: VEGF121, VEGF165, VEGF183, VEG189, VEGF206.
VEGF участвует в развитии и функционировании сосудистой системы во время эмбриогенеза и в постнатальном развитии. Неоваскуляризация, является благоприятным признаком, позволяющим прогнозировать улучшение процессов восстановления. Ростовые факторы относятся к наиболее важным физиологическим ингибиторам запрограммированной гибели клеток. Они снижают концентрацию эффекторов апоптоза или их активность до безвредного уровня, активируют антиапоптотические факторы. Клиническими исследованиями подтверждено повышение VEGF при отеке мозга, субарахноидальном кровоизлиянии, травмах и ишемических поражениях головного мозга. Основанием для его изучения является то, что он как основной индуктор ангиогенеза, может влиять на формирование постгипоксических структурных изменений головного мозга. VEGF связан с нейротрофическими факторами (находятся в синергическом взаимодействии) и является ингибитором процессов апоптоза, имеющих важное значение при гипоксических поражениях ЦНС.
Каскад апоптозных процессов может быть спровоцирован либо прямым действием на геном клетки (вирусы), либо через нейромедиаторы (глутамат), либо причинами, связанными с ишемией клетки, ее физическим повреждением, реперфузией,токсическим воздействием.
Биохимические и цитоморфологические исследования апоптоза выявляют несколько стадий его развития в поврежденной нервной ткани: непосредственную и отсроченную. Как правило, исходное повреждение ткани не ограничивается областью воздействия разрушающей силы, а, продолжаясь во времени, захватывает первично интактные клетки и приводит к расширению очага повреждения.
В отличие от некроза, при апоптозе происходит включение специализированных биохимических механизмов, в результате которых возникает разрыв молекулы ДНК и уничтожение белоксинтезирующих структур. Умирающая клетка сохраняет целостность своей мембраны до полного завершения процесса и только тогда разрушение ее оболочки является сигналом для расположенных вблизи фагоцитов к поглощению оставшихся фрагментов и завершению клеточной деградации. Апоптотические клетки, не подвергшиеся немедленному фагоцитозу, превращаются в мелкие, связанные с мембраной фрагменты, называемые апоптотическими тельцами. Важной чертой апоптоза является то, что удаление умирающих клеток происходит без развития воспаления.
Среди нейротрофических ростовых факторов выявляются те, которые играют роль индукторов апоптических процессов или, наоборот, противодействующих развитию нейроапоптоза. Например, в исследованиях подтверждено участие фактора некроза опухоли (TNF) в апоптозе глиальных и нейрональных клеток как следствие аутоиммунной нейропатологии и патологии мультисклероза .
Рецептор смерти-5 (death receptor 5 – DR5, TRIALR2, TRICK 2)
Во всех анализируемых с помощью иммуноблоттинга (northern blot) средах, TRAILR2 экспрессировался в виде 4.4 kb матричной РНК, при этом максимальные уровни экспрессии отмечались в периферических лимфоцитах крови, селезенке и яичниках.
Исследования последних лет показали, что патогенез многих болезней человека, в том числе рака, лейкозов, аутоиммунных болезней и вирусных инфекций связан с неспособностью клеток подвергаться апоптозу. Другие болезни, такие как нейродегенеративные расстройства, СПИД, остеопороз, апластическая анемия и др. могут быть связаны, напротив, с повышенной способностью клеток к запрограммированной гибели. Исследование маркера апоптоза у I новорожденных, перенесших гипоксически-ишемическое поражение головного мозга, позволит расширить представление о патогенезе выявленных изменений, установить взаимосвязь процессов апоптоза и трофических факторов.
Молекулы клеточной адгезии (МИА)
На ранней стадии микроциркуляторно-клеточных нарушений (6-72 часа ’ после развития ишемии тканей) активно формируется цитотоксический отек. Глиальные клетки, увеличиваясь в объеме, теснят близлежащие структуры, сдавливают микроциркуляторное русло, продолжается миграция лейкоцитов в ишемизированную ткань мозга, максимум отмечается через 24-72 часа. Лейкоцитарная реакция ослабляется к 7 суткам. Характерно резкое повышение продукции лейкоцитами и эндотелиальными клетками множества токсичных соединений. Молекулы клеточной адгезии играют в этом временном промежутке важную роль. Они усиливают адгезию лейкоцитов к эндотелию сосудов, создавая дополнительную окклюзию и поддерживая воспаление.
Повышение адгезивности имеет большое значение в патогенезе дисфункции эндотелия при воспалении, атеросклерозе, септическом шоке и нарушении кровообращения. Миграция клеток - это сложный процесс, в котором на разных стадиях принимают участие несколько МКА.
МКА ALCAM (Activated Leukocyte Cell Adhesion Molecule) - в нормальных условиях находится в небольшом количестве на эндотелии, посредством этой МКА происходит формирование пула лейкоцитов в венозных сосудах ЖКТ, легких и других органов. ALCAM относится к суперсемейству иммуноглобулинов. Молекулы этого семейства применяются для диагностики и прогноза аллергических реакций, опухолевых заболеваний, инфекциях (ВИЧ, малярия, гепатит). Уровень МКА увеличивается после трансплантации, при гломерулонефрите. Растворимый sICAM-1 повышается во 2-м триместре беременности при синдроме задержки развития плода. sPECAM-1 является чувствительным и специфичным маркером определения меланома-ассоциированного ангиогенеза и раннего выявления метастазов.
Изучена взаимосвязь молекул клеточной адгезии в функционировании зародышевого матрикса и связь МКА с факторами сосудистой индукции.
Исследование МКА с учетом роли лейкоцитов в развитии локальной воспалительной реакции в очаге ишемии, а также в возникновении клеточно- миркуциркуляторных нарушений у новорожденных представляет практический интерес. Доказано, что антитела к МКА предотвращают адгезию лейкоцитов к эндотелию сосудов, уменьшают размер инфаркта мозга и улучшают исход преходящей, но не длительной фокальной ишемии
Таким образом, завершая обзор перечисленных исследований, следует отметить, что в нашей клинике достаточно подробно изучаются механизмы гипоксического пери- и постнатального поражения головного мозга у детей, глубоко оценивается роль анте- и интранатальных факторов в патогенезе гипоксии. В результате формируются четкие представления о молекулярных механизмах, которые могут в дальнейшем приводить к необратимым структурным изменениям головного мозга. Также учитываются нейротрофические, ростовые и факторы апоптоза, играющие важную роль в патогенезе гипоксических пери и постнатальных нарушений.
Важность таких исследований нельзя переоценить, т.к. от своевременной и правильной оценки состояния внутриутробного периода, определения факторов риска развития тяжелых поражений мозга и возможности ранней диагностики в значительной степени зависит тактика ведения и прогноз состояния у детей с гипоксическими поражениями ЦНС.
При обращении в больницу врач может назначить ЭЭГ головного мозга ребенку, чтобы можно было убедиться в отсутствии патологий. Процедура безопасна и не оказывает негативного воздействия на организм, но к ней нужно подготовиться.
Суть метода
Электроэнцефалография – регистрация электрической активности мозга. В педиатрии зарекомендовал себя как безвредный и безопасный метод диагностики. Что такое ЭЭГ головного мозга у детей — это возможность зафиксировать на бумажный носитель даже незначительные импульсы активности в корковых структурах.
Данный метод сканирует энергию в мозговых структурах в миллисекундах и дает точную информацию за небольшой отрезок времени. Аппарат ЭЭГ фиксирует импульсы через электроды расположенные на голове у пациента и выдает данные путем записи на бумажный носитель, либо отображает информацию на компьютере.
ЭЭГ сна – для чего проводится и насколько информативно данное исследование?
Без такого исследования, как ЭЭГ, сегодня невозможно представить диагностику большинства неврологических и психических заболеваний, в основе которых лежит судорожная готовность головного мозга, а также выявление причин бессонницы. У детей начальные стадии заболевания часто проявляются в виде судорог на фоне высокой температуры. У взрослых это может быть следствием перенесенной черепно-мозговой травмы, инсульта или развивающейся опухоли.
Показания к проведению
Электроэнцефалограмма — высокоэффективный и безболезненный метод диагностики патологий головного мозга у детей с расстройствами центрального органа нервной системы или вызванные вследствие травм.
Процедура ЭЭГ назначается невропатологом на основе жалоб и по медицинским показаниям при патологиях мозговых структур:
- Обмороки;
- Головные боли;
- Неустойчивое АД;
- Травмы головы в анамнезе;
- Нарушение сна;
- Беспричинный плач;
- Ночной энурез;
- Заикание;
- Вспышки агрессии;
- Когнитивные нарушения (снижение памяти, концентрации внимания);
- Судорожный синдром (без гипертермии);
- Воспалительные поражения оболочек мозга (менингит);
- Гидроцефалия у новорожденных;
- ЗРР (задержка речевого развития);
- ЗПР (задержка психического развития);
- Оценка динамики после инструментальных вмешательств;
- Эпилептические приступы;
- ДЦП.
Диагностика методом ЭЭГ в педиатрической практике не имеет возрастных ограничений, что позволяет оценить воздействие анестезии при сложных операциях на мозге и показывает степень зрелости нейронов у ребенка. Процедура противопоказана при наличии открытых ран на черепе или наложенных швах.
Расшифровка результатов у детей
Как правило, результаты можно забрать на следующий день. Самостоятельно проанализировать результаты электроэнцефалограммы не получится, потому что на руки выдается расшифровка с начерченными кривыми линиями активности мозга или компьютерный файл.
Интерпретировать их под силу только опытному специалисту. Он оценит частоту, амплитуду, ритм кривых, их скачки в определенные моменты.
Диагноз же будет поставлен невропатологом, наблюдающим малыша, на основании расшифровки энцефалограммы и симптомов, которые стали основанием для направления на обследование.
В зависимости от возраста малыша различаются показатели нормы. ЭЭГ покажет отклонения ритмов мозга конкретного человека от среднестатистических, нормальных. В заключении родители найдут следующие данные:
- Альфа-ритм. Он отражает состояние покоя, его фиксируют в бодрствовании с закрытыми глазами. Он перестает регистрироваться приборами при появлении раздражителя. О развитии опухоли или кисты, инсульте или психическом расстройстве говорят сбои в альфа-ритме. Для травмы головного мозга характерна высокая частота, при неврозе появляются слабая выраженность ритма и пароксизмальная активность.
- Бета-ритм. Регистрируется при тревожности, беспокойстве, депрессии. Сбои бета-ритма свидетельствуют о сотрясении мозга (рекомендуем прочитать: основные симптомы сотрясения головного мозга у детей). Некоторые его показатели указывают на энцефалит.
- Тета-ритм. Регистрируется в состоянии естественного сна. Тета-ритм в состоянии активности говорит о наличии патологии в той области мозга, где он обнаружен. Если он появляется во всех областях мозга, то имеет место значительное поражение ЦНС. В норме его должно быть не более 15%. Нарушение тета- и дельта-ритма совокупно обнаруживается при задержке психического развития, психопатии, слабоумии. Пароксизмальные тета- и дельта-волны в состоянии бодрствования говорят о патологии глубоких частей мозга. Пароксизмальная активность в центральных частях мозга свидетельствует о приобретенном слабоумии.
- БЭА. Показатель биоэлектрической активности мозга в норме ритмичен, он синхронный. Его сбой появляется при наличии судорожного синдрома и эпилепсии. По этому показателю диагностируется мигрень и головные боли. Если в расшифровке ЭЭГ говорится о диффузных изменениях, это свидетельствует о предрасположенности к эпилепсии (рекомендуем прочитать: первые признаки эпилепсии у детей до года). Умеренная дизритмия не является серьезным нарушением и требует только симптоматического лечения.
- М-ЭХО. На его основе оценивают смещение отделов мозга. В норме допускается отклонение около 1 мм. Если этот показатель выше, то фиксируется неправильное расположение отделов головного мозга.
Показателей ЭЭГ достаточно много, их расшифровкой занимается грамотный специалист. Очень важна квалификация и опыт врача. Так, например, эпилептиформные изменения на ЭЭГ могут возникать при движении глаз, пульсации сосудов, изменении дыхания, глотании и по другим причинам. У 10% эпилептиков эпилептиформные разряды могут не регистрироваться. Все эти нюансы должны быть учтены при подготовке выводов ЭЭГ.
ЭЭГ очень эффективна при обнаружении опухолей головного мозга. Она помогает выявить их точное местоположение. С помощью этого метода проводится диагностика травм, воспалительных заболеваний, гидроцефалии и других состояний.
Основные расстройства и заболевания, исследуемые с помощью ЭЭГ:
- Менингоэнцефалит. При этом заболевании в головном мозге происходит воспалительный процесс. Причина энцефалита – попадание в организм возбудителей (вирусов или бактерий). Как правило, появляется высокая температура, тошнота, рвота, сильные головные боли.
- Водянка (гидроцефалия) (рекомендуем прочитать: каким должно быть лечение гидроцефалии у детей?). Это частая врожденная патология, при которой в полости черепа скапливается жидкость. Развивается она вследствие родовых травм, воспалений ЦНС.
- Эпилепсия. Характеризуется судорогами и потерей сознания. Причиной эпилептических приступов малыша может быть злоупотребление матерью алкоголем во время беременности, наследственность, родовая травма, инфекционные заболевания.
- Новообразования в головном мозге. Проявляются потерей сознания, головными болями, нарушениями слуха, зрения и координации (дезорганизация в пространстве). Причины появления опухолей неясны, специалисты полагают, что это наследственность, ионизирующее излучение, травмы и перенесенные инфекционные заболевания.
- Кровоизлияние в мозг. Причинами могут быть травмы, гипертония, атеросклероз, болезни крови (анемия, лейкоз) (рекомендуем прочитать: симптомы лейкоза у детей по показателям анализа крови). Пациента беспокоит головокружение, боли в голове, невнимательность, медлительность и состояние общей заторможенности. При небольших травмах в заключении будет указано, что присутствуют диффузные изменения умеренного характера. На начальной стадии атеросклероза наблюдаются умеренно выраженные диффузные изменения биоэлектрической активности мозга (БЭА).
- Детский церебральный паралич. Поражается центральная нервная система и нарушается двигательная активность малыша. Среди причин выделяют внутриутробную патологию ЦНС, наследственность, асфиксию, инфекционные заболевания в первые месяцы жизни.
- Лунатизм, или сомнамбулизм (рекомендуем прочитать: причины появления лунатизма у детей). Проявляется в снохождении и сноговорении. Причины его неясны, но ученые полагают, что большую роль играют наследственность, воздействие окружающей среды, прием лекарственных препаратов.
- Психические нарушения у детей: аутизм, умственная отсталость, психическое отставание в развитии, синдром дефицита внимания. Провоцируют их наследственная предрасположенность, патологические изменения мозга, сильные психоэмоциональные потрясения.
- Заикание. Речевой дефект появляется из-за наследственной предрасположенности ребенка, перинатального поражения головного мозга, перенесенных инфекционных заболеваний, рахита, черепно-мозговых травм, психических потрясений.
Это неполный список детских нарушений, когда в диагностике на помощь приходит ЭЭГ. Этот метод поможет невропатологу поставить правильный диагноз и назначить эффективную терапию малышу.
Подготовка ребенка
ЭЭГ детям, не достигшим годовалого возраста, проводят при условии полного покоя (сна), когда ребенок полностью расслаблен, для получения достоверного результата исследования. Детям старшего возраста результаты фиксируются в состоянии бодрствования.
Читайте также:


